目的 评估高糖对肾组织干细胞(kidney stem cells,KSC)条件培养液修复缺氧损伤肾小管上皮细胞(renal tubular epithelium cells,RTEC)作用的影响。方法 分离肾乳头处的KSC,分别用正常糖浓度(简称“正糖”,5.6 mmol/L)和高糖(30 mmol/L)培养基对KSC进行预处理后制备KSC条件培养液。建立大鼠RTEC缺氧/复氧模型,比较高糖与正糖刺激后KSC条件培养液对缺氧/复氧RTEC修复作用的差异。结果 (1)缺氧4 h/复氧2 h为RTEC缺氧/复氧模型的最佳时间。(2)缺氧后,RTEC早期凋亡率和晚期凋亡率均升高,采用KSC条件培养液干预12 h和24 h后,与缺氧/复氧对照组相比,正糖缺氧/复氧组和高糖缺氧/复氧组RTEC的凋亡率均明显降低( P<0.01)。正糖组和高糖组比较,干预24 h后,正糖组RTEC的总体凋亡率显著低于高糖组( P=0.02)。(3)缺氧后,RTEC上清液的乳酸脱氢酶(lactic dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)水平明显升高( P<0.01),超氧化物歧化酶(superoxide dismutase,SOD)水平明显降低( P<0.01)。采用KSC条件培养液干预12 h和24 h后,与缺氧/复氧对照组相比,正糖缺氧/复氧组和高糖缺氧/复氧组的LDH和MDA水平均显著降低( P<0.01),SOD水平均显著升高( P<0.01)。正糖组和高糖组比较,高糖组的LDH和MDA水平要显著高于正糖组( P<0.05),SOD水平要显著低于正糖组( P<0.01)。结论 KSC条件培养液对缺氧损伤的RTEC有修复作用,这种作用主要是通过减少氧化应激、抑制细胞凋亡来实现的,而经高糖预处理的KSC条件培养液的抗氧化应激、抗凋亡作用减弱。
Objective: To evaluate the impacts of high glucose on the repair function of kidney stem cells (KSC) conditional medium to the hypoxia-injured renal tubular epithelium cells (RTEC). Me-thods: KSC were isolated from the renal papilla in 4-week-Sprague-Dawley rats. The KSC were pretreated in media with high glucose (30 mmol/L) or with normal glucose (5.6 mmol/L), respectively. The supernatants of the pre-treated KSC were collected as the conditional media. The hypoxia/reoxygenation (H/R) model of rat RTEC was established using the NRK-52E cell line. The effects of KSC conditional media on the H/R RTEC were investigated.Results: (1) The best H/R model of RTEC was established using hypoxia for 4 h and reoxygenation 2 h. (2) After hypoxia, the early and late cell apoptosis rates of the H/R RTEC were increased. The H/R RTEC were co-cultured with KSC conditional media for 12 h and 24 h, respectively. The H/R RTEC were co-cultured with DMEM/F12 as a control group. The cell apoptosis rate of H/R RTEC was lower after co-cultured with KSC conditional media ( P<0.01), and the cell apoptosis rate of H/R RTEC in high glucose group was much higher than that in normal glucose group after co-cultured 24 h ( P=0.02). (3) After hypoxia, the lactic dehydrogenase (LDH) and malondialdehyde (MDA) levels of the H/R RTEC supernatant were increased, and the superoxide dismutase (SOD) level decreased. The LDH and MDA levels were lower and the SOD level was higher after co-cultured with KSC conditional media for 12 h and 24 h, respectively ( P<0.01). The LDH and MDA levels of H/R RTEC supernatant were much higher in the high glucose group than in the normal glucose group ( P<0.05), and the SOD level of H/R RTEC supernatant was much lower in the high glucose group than in the normal glucose group ( P<0.01).Conclusion: KSC conditional media could repair the H/R injury of RTEC. The effects were mainly by inhibiting cell apoptosis, and reducing oxidative stress; the anti-cell apoptosis ability and the anti-oxidative stress capacity of the conditional medium were reduced after KSC were pre-treated with high glucose.
2型糖尿病影响着人体各个组织、器官的功能, 肾脏也不例外。有研究显示, 糖尿病患者急性肾损伤(acute kidney injury, AKI)的发生率显著高于非糖尿病患者, 且发生AKI后肾功能恢复慢, 预后差[1, 2], 导致这一改变的根本原因在于糖尿病的大环境下肾损伤后再生与修复能力减弱。我们之前的研究曾观察到, 存在于肾乳头处的肾组织干细胞(kidney stem cells, KSC)对缺氧损伤的肾小管上皮细胞具有一定的修复作用[3, 4]。众所周知, 干细胞主要通过两种形式对损伤的组织进行修复, 一是移动到损伤部位并分化为受损伤的细胞, 二是通过旁分泌机制来发挥作用[5]。关于肾组织干细胞的旁分泌作用在我们的早期研究中已经得到验证, 即分别应用KSC条件培养液和骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)条件培养液对缺氧损伤的肾小管上皮细胞进行修复, 结果显示氧化应激相关指标得到明显改善, 并且两种干细胞作用相当[3]。那么在高糖的微环境下, KSC的这种修复作用又会受到哪些影响?为了进一步探讨糖尿病对肾损伤的机制, 本研究通过高糖模拟糖尿病微环境, 从干细胞旁分泌角度分析高糖对KSC修复作用的影响, 从而为寻找新的治疗靶点奠定一定的实验室基础。
主要器材有T25细胞培养瓶、6孔板、24孔板、15 mL离心管, 均购自Corning公司。主要设备有UV5600型二氧化碳培养箱(德国Heraeus)、三气培养箱(德国Heraeus)、HD-1360超净工作台(哈尔滨东联电子技术开发有限公司)、调温低速离心机(日本KUBOTA KR/702J)、IX70 型倒置荧光显微镜(日本Olympus)、流式细胞分选仪(美国BD FACS Calibur)、紫外可见光分光光度计(中国科学院电子学研究所微波电子公司)。
指标检测试剂有Anexin v-FITC& PI凋亡试剂盒(嘉美生物技术有限公司), 乳酸脱氢酶(lactic dehydrogenase, LDH)测试盒、超氧化物歧化酶(superoxi-de dismutase, SOD)测试盒和丙二醛(malondialdehyde, MDA)测试盒均购自南京建成生物工程研究所。
细胞培养与计数的试剂有正常糖浓度(简称“ 正糖” )的间充质干细胞(mesenchymal stem cells, MSC)培养基, 购自北京金泽小星生物科技有限公司[基础成分α -MEM, 血清含量6%(体积分数), 糖含量5.6 mmol/L]; 高糖MSC培养基, 是在MSC培养基中加入D-葡萄糖, 使培养基中葡萄糖终浓度为30 mmol/L; 达尔伯克改良伊格尔培养基(Dulbecco’ s modified Eagle’ s medium and Ham’ s F-12, DMEM/F12)、胎牛血清和0.25%(体积分数)不含乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)的胰酶购自美国Gibco公司; 0.4%(质量分数)台盼蓝购自Sigma公司。
从4周龄清洁级雄性Sprague-Dawley(SD)大鼠肾乳头处原代分离培养大鼠KSC, 实验动物由中国医学科学院协和医科大学实验动物研究所提供, 动物许可证号为SCXK(京)20090007。大鼠肾小管上皮细胞(renal tubular epithelial cell, RTEC)NRK-52E细胞系购自中国科学院上海生命科学研究院细胞资源中心。
1.4.1 KSC分离培养、传代与鉴定
4周雄性SD大鼠取双肾, 剥离肾被膜, 置于解剖显微镜下, 沿冠状面纵行切开肾脏, 提起输尿管可见花瓣状乳突结构, 持显微剪将乳突前尖部完整剪下置入EP管中, 磷酸盐缓冲液(phosphate buffered saline, PBS)清洗、剪碎后加入胶原酶Ⅰ 充分消化, 离心, 弃上清液, 接种于25 cm培养瓶中, 置于37 ℃ CO2细胞培养箱内, 72 h后于显微镜下观察细胞的贴壁生长情况并换液, 之后每隔2~3 d换液, 当细胞生长至70%~80%融合时以1 ∶ 2的比例进行细胞传代。KSC的鉴定方法见参考文献[6, 7], 即通过流式细胞仪检测KSC表面标记(CD29、CD44、CD90阳性率分别为96.39%、93.50%、99.28%, CD45阳性率为0.72%), 通过成骨、成脂诱导培养鉴定KSC分化能力。
1.4.2 大鼠RTEC缺氧/复氧模型(hypoxia/reoxygenation, H/R)的建立
(1)待RTEC生长至80%融合时将细胞消化下来, 以2× 105/孔的密度接种于6孔板中; (2)24 h后RTEC贴壁生长, 以PBS清洗RTEC表面2次, H/R组加入含1%(体积分数)胎牛血清的DMEM/F12培养基, 调整三气培养箱氧浓度为1% O2+5% CO2+94% N2, 将6孔板置于三气培养箱中, 分别于缺氧培养后2 h、4 h、6 h取出6孔板, 正常对照组加入含10%(体积分数)胎牛血清的DMEM/F12培养基, 置于21%(体积分数)O2二氧化碳培养箱中继续培养, 同样分别于2 h、4 h、6 h取出6孔板; (3)弃去培养液, PBS清洗RTEC表面2次, 加入10%胎牛血清的DMEM/F12培养基, H/R组置于21%O2二氧化碳培养箱中进行复氧, 正常对照组同样处理, 分别于复氧0 h、2 h、4 h、6 h收集细胞及上清液, 检测细胞计数、存活率和凋亡率。
1.4.3 KSC条件培养液对H/R肾小管上皮细胞的修复作用
(1)KSC条件培养液的制备:P3代KSC以1× 105/孔的密度接种于6孔板中, 24 h后分别更换为正糖MSC培养基(5.6 mmol/L)和高糖MSC培养基(30 mmol/L), 培养4 d后两组KSC均生长融合至70%~80%, 弃去原培养基, PBS冲洗KSC表面2遍, 更换为10%胎牛血清的DMEM/F12培养基(2 mL/孔)稳定培养6 h, 收集上清液, 用0.22 μ m的小滤器过滤备用; (2)KSC条件培养基对RTEC损伤模型的修复:选取缺氧4 h/复氧2 h作为大鼠RTEC H/R模型, RTEC缺氧4 h/复氧2 h后收集上清液, PBS洗涤RTEC表面2次, 分别加入10% 胎牛血清的DMEM/F12(对照组)、正糖组KSC条件培养液、高糖组KSC条件培养液, 剂量均为2 mL/孔, 继续培养12 h及24 h, 收集上清液检测LDH、MDA、SOD等指标, 收集RTEC进行细胞计数并检测细胞凋亡率及存活率; (3)实验分组:正常对照组, 正常RTEC, 不予以H/R处理; H/R对照组, RTEC予缺氧4 h/复氧2 h后加入10% FCS DMEM/F12; 正糖H/R组, RTEC予缺氧4 h/复氧2 h后加入正糖预处理的KSC条件培养液; 高糖H/R组, RTEC予缺氧4 h/复氧2 h后加入高糖预处理的KSC条件培养液。
1.4.4 缺氧损伤及修复指标检测
(1)台盼蓝活细胞计数:将RTEC消化成单细胞悬液, 取待测的细胞悬液100 μ L, 加入0.4%台盼蓝10 μ L, 混匀, 滴入细胞计数板, 于低倍镜下计数4个大格内的活细胞数(透明未着色者)及死细胞数(染为蓝色), 活细胞数(个/L)=每个方格中未染细胞总数平均值× 稀释倍数× 104, 细胞存活率=未染细胞总数/(已染细胞总数+未染细胞总数)× 100%; (2)流式细胞术检测细胞凋亡, LDH、MDA、SOD的检测按照说明书步骤进行检测。
采用SPSS 13.0软件进行统计学分析, 计量资料以均数± 标准差表示, 两组间比较采用成组t检验, 多组间比较采用方差分析(其中两两比较采用q检验的方法, 即Newman-Keuls法), P< 0.05为差异有统计学意义。
2.1.1 形态学变化
倒置相差显微镜下观察缺氧培养后, RTEC形态未见显著变化, 随着缺氧时间延长, 漂浮细胞逐渐增加, 缺氧6 h时达高峰; 复氧后RTEC折光性减弱, 细胞间连接稍模糊, 悬浮细胞增多, 在缺氧6 h/复氧6 h达高峰, 但细胞形态改变尚不明显; 对照组细胞折光性强, 生长旺盛, 细胞间连接紧密。
2.1.2 各组RTEC活细胞计数及细胞存活率比较
H/R组较对照组生长缓慢, 细胞计数较对照组明显减少(P< 0.05), 随着复氧时间延长, 细胞计数逐渐增加, 但仍低于正常对照组(P< 0.05); H/R组细胞存活率亦较对照组明显下降(P< 0.05), 缺氧6 h/复氧6 h细胞存活率最低(表1)。
| 表1 RTEC活细胞计数及细胞存活率 Table 1 Living cells count and cells survival rate of RTEC |
2.1.3 流式细胞仪检测RTEC细胞凋亡
通过流式细胞仪检测RTEC细胞凋亡率结果显示, 正常对照组RTEC早期凋亡率为(1.43± 0.21)%, 晚期凋亡率为(5.13± 1.38)%; H/R模型组RTEC的早期凋亡率和晚期凋亡率均显著高于正常对照组, 且随着缺氧时间的延长逐渐升高。按缺氧时间划分亚组, 各个亚组内随着复氧时间的延长, 晚期凋亡率逐渐增高, 而早期凋亡率在复氧2 h时最高。按照以往文献报道, AKI早期RTEC以细胞凋亡为主, 随着损伤的加重出现细胞坏死[6, 7], 其中缺氧4 h/复氧2 h早期凋亡率最高, 为(21.57± 0.21)%, 而晚期凋亡和死亡率仅有(5.97± 0.14)%, 能更好地在体外模拟AKI早期改变, 是最佳缺氧/复氧时间(表2)。
| 表2 H/R模型RTEC凋亡率 Table 2 Cell apoptosis rate of RTEC H/R model |
2.2.1 流式细胞仪检测RTEC凋亡
表3结果显示, 建立H/R模型后, RTEC的总体凋亡率显著升高, 应用KSC条件培养液干预12 h和24 h后, 与H/R对照组相比, 正糖KSC条件培养液干预组和高糖KSC条件培养液干预组RTEC的总体细胞凋亡率均显著降低(P< 0.01)。干预12 h后, 正糖组RTEC的总体凋亡率略低于高糖组, 差异无统计学意义(P=0.09); 干预24 h后, 正糖组RTEC的总体凋亡率显著低于高糖组(P=0.02)。
| 表3 高糖与正糖KSC条件培养液干预后H/R RTEC凋亡率 Table 3 Cell apoptosis rate of RTEC H/R model co-cultured with normal and high glucose KSC conditional media |
2.2.2 缺氧损伤与氧化应激指标检测
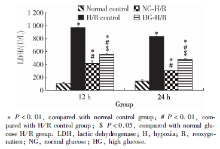
LDH含量的测定:进行KSC条件培养液干预前检测各组LDH基线值, 组间差异无统计学意义(P=0.89); RTEC建立H/R模型后, RTEC条件培养液的LDH水平显著升高(P< 0.01), KSC条件培养液干预12 h和24 h后, 与H/R对照组相比, 正糖H/R组和高糖H/R组RTEC上清液的LDH水平均显著降低(P< 0.01), 正糖组和高糖组两组间比较, 高糖组LDH水平要高于正糖组(P< 0.01, 图1)。
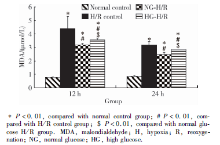
MDA含量的测定:进行KSC条件培养液干预前检测各组MDA基线值, 组间差异无统计学意义(P=0.84)。RTEC建立H/R模型后, RTEC上清液的MDA水平显著升高(P< 0.01), 进行KSC条件培养液干预12 h和24 h后, 与H/R对照组相比, 正糖H/R组和高糖H/R组RTEC上清液的MDA水平均显著降低(P< 0.01), 正糖H/R组和高糖H/R组比较, 高糖组RTEC上清液的MDA水平要高于正糖组(P< 0.05, 图2)。
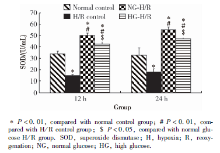
SOD含量的测定:进行KSC条件培养液干预前检测各组SOD基线值, 组间差异无统计学意义(P=0.89)。RTEC建立H/R模型后, RTEC上清液的SOD水平显著降低(P< 0.01), 进行KSC条件培养液干预12 h和24 h后, 与H/R对照组相比, 正糖H/R组和高糖H/R组RTEC上清液的SOD水平均显著升高(P< 0.01), 正糖组和高糖组比较, 高糖组RTEC上清液的SOD水平要低于正糖组(P< 0.01, 图3)。
AKI主要受累部位在肾近端肾小管上皮细胞, 当肾受到缺血再灌注打击后, 在损伤早期以RTEC凋亡为主, 随着损伤的加重出现细胞坏死[8, 9], 进而引起肾功能的急剧恶化。本研究通过调节三气培养箱的氧浓度来模拟人体的缺氧/复氧环境, 成功建立了大鼠肾小管上皮H/R模型, 研究结果显示, 缺氧4 h/复氧2 h是最佳H/R时间, 此时细胞的早期凋亡率最高而晚期凋亡和死亡率较低, 符合AKI肾小管损伤的早期病理生理改变, 可以更好地在体外模拟肾小管缺血再灌注早期损伤的过程。关于肾小管上皮H/R模型的建立方法国内外有许多相关报道[10, 11], 但由于所选细胞种类不同、培养环境不同, 模型的H/R时间有所差异, 但总体来讲细胞的凋亡率均在20%~23%, 且以早期凋亡为主, 这与我们的模型结果是一致的。
干细胞对AKI具有修复作用, 并且这种修复作用很大程度上来源于干细胞的旁分泌途径, 如以往研究显示, 给予AKI大鼠模型输注BMSCs, 大鼠的肾功能得到改善, 并且BMSCs移植组的肾组织促炎因子白细胞介素-6(interleukin-6, IL-6)和肿瘤坏死因子-α (tumor necrosis factor-α , TNF-α )表达降低, 而抗炎因子血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)表达升高, 提示BMSCs可以通过旁分泌作用修复受损的肾组织[12]。Gatti等[13]直接应用BMSCs分泌的微囊泡对AKI模型大鼠进行干预, 结果显示给予微囊泡治疗后, 大鼠肾功能得到改善, 这种作用主要是通过抑制肾小管上皮细胞的凋亡和促进其增殖来实现的。Brunswig等[14]在应用免疫调节功能异常的BMSCs治疗AKI时发现其肾脏保护作用消失了, 进一步证明了干细胞的旁分泌作用。然而, 干细胞的这种旁分泌作用在糖尿病的大环境下是受损的, 如Jarajapu等[15]发现CD34+细胞分泌的肝细胞生长因子(hepatic grouth factor, HGF)、促血小板生成素(thrombopoietin, TPO)等促血管生成因子减少, 而IL-1β 、TNF-α 等促炎因子分泌增加, 从而导致该细胞的血管形成能力下降。在糖尿病和肥胖同时存在的情况下会使CD34+细胞由促血管生成表型转换成抗血管生成表型[16]。有研究将糖尿病小鼠的骨髓移植到正常小鼠体内, 接受移植的小鼠虽然血糖正常, 但已有微量蛋白尿及糖尿病肾病早期病理表现, 从另一个角度间接证实了糖尿病对骨髓干细胞旁分泌作用的影响[17]。最新的一些研究还表明, 在糖尿病的微环境下, 干细胞的免疫调节作用也是受损的, 表现为T淋巴细胞和树突状细胞功能障碍等[18]。
我们前期的研究工作显示, KSC也可以通过旁分泌作用对缺氧损伤的RTEC发挥修复作用[3]。KSC这种修复作用是否会受到高糖的影响?为此, 我们分别制备了正常糖浓度培养的KSCs和经过高糖预处理过的KSCs两种细胞培养上清液作为条件培养液, 分别观察它们对H/R RTEC的作用, 结果显示RTEC建立H/R模型后, 细胞凋亡率增高, 细胞损伤指标LDH升高, 氧化应激指标MDA升高而抗氧化指标SOD降低, KSC条件培养液干预12 h和24 h后, 与对照组相比, 正糖组和高糖组RTEC细胞凋亡率下降, LDH、MDA降低而SOD升高, 再次证实了KSC条件培养液的修复作用, 并且这种作用主要是通过抑制细胞凋亡、减少氧化应激来实现的。正糖组和高糖组比较结果显示, 高糖组RTEC的总体凋亡率高于正糖组, 高糖组RTEC上清液的LDH和MDA水平要高于正糖组, SOD水平要低于正糖组, 提示KSC经高糖预处理后, 其抗凋亡、抗氧化应激作用减弱。氧化应激在缺血再灌注肾小管上皮细胞损伤中发挥重要的作用[19], 干细胞的抗氧化应激作用也在BMSCs中得到验证, 如Lv等[20]的研究显示BMSCs通过抑制氧化应激来改善糖尿病肾病的肾小球硬化和减少蛋白尿。Ezquer等[21]也观察到, 给予BMSCs治疗后, 糖尿病大鼠的肾小球硬化、肾纤维化、基底膜增厚等病理改变得到改善, 该研究认为BMSCs通过促进细胞增殖、抑制凋亡、减少氧化应激等旁分泌机制来发挥肾脏保护作用。干细胞抗氧化应激的作用机制尚不清楚, 有人认为核因子相关因子-2(nuclear factor erythroid-2, Nrf-2)及其下游靶基因血红素氧化酶-1(heme oxygenase-1, HO-1)可能是其作用靶点[22], 跨膜受体蛋白Notch1信号通路也可能与干细胞的抗氧化应激作用有关[23], 还有研究认为干细胞的抗氧化作用与其促进超氧化物歧化酶、过氧化氢酶及谷胱苷肽过氧化物酶的表达有关, 从而增强干细胞排除过氧化氢及过氧硝酸盐的能力[24], 具体的相关作用机制还有待进一步研究。
综上所述, KSC条件培养液对缺氧损伤的RTEC有修复作用, 这种作用主要是通过减少氧化应激、抑制细胞凋亡来实现的, 而经过高糖预处理的KSC条件培养液的抗氧化应激、抗凋亡作用明显减弱。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|