目的 评估在超声引导下采用平面内方法,经外侧肋间入路行胸椎旁阻滞技术的可行性和成功率。方法 选取27例择期行胸外科手术的患者,于术前进行胸椎旁阻滞。超声探头置于脊柱旁8 cm左右,平行肋骨长轴在第5肋间隙进行扫描,以肋间内肌和肋间最内肌之间的间隙作为穿刺目标进针,穿刺针到达目标区域后,推注0.5%(质量分数)罗哌卡因20 mL后置管,在超声下评估导管头端位置是否良好,记录给药后10、20、30 min冷触觉阻滞平面。术后连接镇痛泵经导管持续泵注0.2%罗哌卡因6 mL/h进行镇痛,记录术后1、6、24、48 h冷触觉阻滞平面及疼痛程度评分。结果 1次置管成功率81.48%(22/27), 另5例患者分别在第2次置管和第3次置管后成功。给予负荷剂量给药后10、20、30 min冷触觉阻滞平面数中位数分别为2、3、4,术后1、6、24、48 h冷触觉阻滞平面数及疼痛程度评分中位数分别为5、5、5、4以及1、1、2、2,无患者发生双侧阻滞、气胸及误穿血管等并发症。结论 采用上述外侧肋间入路技术进行胸椎旁阻滞具有良好的可行性,阻滞成功率高,并发症少。
Objective: To evaluate the feasibility and success rate of in-plane ultrasound-guided paravertebral block using laterally intercostal approach.Methods: In the study, 27 patients undergoing elective thoracic surgery were selected to do paravertebral block preoperatively. The fifth intercostal space was scanned by ultrasound probe which was placed along the long axis of the rib and 8 cm lateral to the midline of the spine. The needle was advanced in increments aiming at the space between the internal and innermost intercostal muscles. Once the space between the muscles was achieved, 20 mL of 0.5% (mass fraction) ropivacaine was injected and a catheter was inserted. Whether the tip of catheter was in right place was evaluated by ultrasound image. The block dermatomes of cold sensation were recorded 10, 20 and 30 min after the bolus drug was given. Then 0.2% ropivacaine was infused with 6 mL/h via the catheter by an analgesia pump postoperatively. The block dermatomes of cold sensation and pain score were recorded 1, 6, 24 and 48 h postoperatively.Results: The first attempt success rate of catheteration was 81.48% (22/27); the tips of catheter were proved in right places after the second or third attempt in 5 patients. The median numbers of the block dermatomes 10, 20 and 30 min after the bolus drug was given were 2, 3, 4; the median numbers of block dermatomes were 5, 5, 5, 4, and of pain score were 1, 1, 2, 2 at 1, 6, 24, 48 h postoperatively; no case of bilateral block, pneumothorax or vessel puncture occurred.Conclusion: Thoracic paravertebral block using laterally intercostal approach is feasible, which has high success rate of block and low rate of complications.
开胸手术经常导致严重的术后疼痛[1, 2], 有效的术后镇痛对患者的顺利康复非常重要。硬膜外阻滞镇痛曾被认为是开胸手术术后镇痛的“ 金标准” [1, 3], 但近几年随着超声引导神经阻滞技术的发展, 胸椎旁阻滞技术开始体现出独特的优势[4, 5, 6]。既往研究报道了在线性超声探头引导下采用平面内或平面外技术的几种不同的胸椎旁阻滞入路[7, 8, 9, 10, 11, 12, 13], 目前临床上常用的平面内胸椎旁阻滞技术有两种不同入路:探头旁开脊柱2~3 cm、与脊柱平行放置的旁矢状切面扫描(paramedian sagittal scan)入路, 探头与肋骨平行放置、与脊柱成斜轴位的横断面扫描(transverse scan)入路[14]。旁矢状位扫描平面内技术针尖不指向神经轴索, 但采用该方法进行平面内穿刺时, 探头与穿刺间隙上、下节段的横突会形成“ 双支点效应” , 穿刺针容易被横突阻挡[15]。斜轴位横断面扫描入路, 穿刺针行进路径无骨性结构阻挡, 操作简单, 但缺点是针尖指向横突下方的脊神经根。
Ben-Ari等[9]于2009年首次报道了一种外侧肋间入路技术, 其目标穿刺区域不是胸椎旁间隙(thoraci paravertebral space, TPVS), 而是位于TPVS外侧并与其相通的肋间内肌和肋间最内肌之间的肋间间隙。在此区域注入局部麻醉药, 利用药液向内侧的TPVS进行扩散可以实现椎旁阻滞, 还可以通过药液扩开后的肋间间隙将导管置入椎旁间隙, 进行术后持续胸椎旁阻滞。这个方法从理论上可以满足上述理想的穿刺入路的3点要求, 穿刺时针尖既不指向脊神经根, 同时穿刺路径上也无骨性结构阻挡, 操作较简单, 但该方法的应用目前还存在一些不明确之处, 比如单次阻滞时是否会因为局部麻醉药向TPVS扩散不足而影响阻滞效果?如果进行置管, 导管是否均能顺利沿两层肌肉间隙置入TPVS?
目前, 国内外采用该方法进行胸椎旁阻滞的研究报道并不多见, 本研究的目的是通过研究超声引导下采用外侧肋间入路进行胸椎旁阻滞的穿刺置管成功率、阻滞效果及并发症, 来进一步评估该方法在临床工作中应用的可行性及安全性。
选取北京大学第三医院胸外科27例美国麻醉医师学会(American Society of Anesthesiology, ASA)分级≤ Ⅲ 级, 于2015年4-7月之间择期行单侧开胸或胸腔镜手术患者。排除标准:年龄小于18岁或大于80岁; 凝血功能障碍; 慢性阿片类药物用药史; 穿刺部位感染。本研究经北京大学第三医院医学科学研究伦理委员会批准(2015医伦审第101-2号), 所有患者均签署知情同意书。
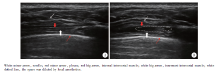
所有患者均由同一熟练掌握超声引导胸椎旁阻滞技术的麻醉医生在6~13 MHz线性超声探头(Sonosite EDGE, Bothell, WA)引导下采用平面内技术经外侧肋间入路进行超声引导下胸椎旁阻滞。患者入手术室后开放静脉通路, 常规生命体征监测, 静脉推注2 mg咪达唑仑。所有患者均术侧向上行侧卧位, 标记第5肋间隙作为穿刺部位, 进行标准的消毒铺巾后, 将超声探头置于距离脊柱8 cm左右, 平行于脊柱对第5肋间隙进行短轴位扫描, 辨认该间隙上下肋骨以及壁胸膜和脏胸膜。将探头旋转使其与相邻肋骨长轴平行, 并略向头端倾斜探头, 在肋间隙紧贴下一肋骨上方进行扫描, 寻找肋间内肌和肋间最内肌(图1A)。确定穿刺点后, 以1%(质量分数)利多卡因充分局部浸润麻醉, 采用超声引导平面内穿刺法, 穿刺针由外向内进针。当针尖突破肋间内肌后, 推注2 mL生理盐水, 如果两层肌肉间筋膜层被扩开, 且壁胸膜被推向深方, 则确认穿刺位置正确(图1B), 记录穿刺针置入深度。缓慢推入0.5%(质量分数)罗哌卡因20 mL, 药物推注完毕后进行置管, 导管置入深度为超出针尖7 cm, 所有患者均记录穿刺时间(从开始穿刺到导管留置成功后拔出穿刺针止)。穿刺针拔出后, 两组患者均将超声探头长轴沿胸椎旁纵向扫描, 获取TPVS旁矢状位图像, 通过导管注入0.5 mL空气与2 mL生理盐水的混合液。如果超声下旁矢状位TPVS区(肋横突上韧带和壁胸膜之间)可见到由生理盐水和空气混合液引起的“ 高回声闪烁(hyperechocic flash)” , 则确认为导管位置良好[16]; 如果无此征象, 则导管回退0.5 cm后再次注入生理盐水及空气混合液, 直至超声下出现上述征象; 如果导管回退3 cm后仍无“ 高回声闪烁” , 则拔出导管重新进行穿刺置管。直至确认导管位置良好后, 经皮荷包缝合固定导管, 给药后10、20、30 min测试患者双侧冷触觉阻滞平面[16]。
所有患者均采用相同的全身麻醉诱导和维持方案, 诱导药物为咪达唑仑、芬太尼、丙泊酚以及罗库溴铵。麻醉维持采用靶控输注丙泊酚、持续输注瑞芬太尼以及间断给予罗库溴铵, 保持血压、心率在基础值上下20%以内波动。术中进胸后请胸外科医生直视下检查穿刺区域胸椎旁壁胸膜, 评估是否发生导管穿透壁胸膜并置入胸腔内。
手术结束前60 min静脉给予1 μ g/kg芬太尼、40 mg帕瑞昔布和8 mg昂丹司琼。手术结束前10 min 经留置的胸椎旁导管给予0.5%罗哌卡因20 mL, 并连接镇痛泵, 6 mL/h持续输注0.2%罗哌卡因。患者回病房后前3天每12 h给予帕瑞昔布40 mg辅助镇痛。
术后1、6、24、48 h对患者冷触觉阻滞平面再次评估, 同时采用数字化评分量表(numerical rating scale, NRS)评估病人疼痛程度(0~10分)。如果患者疼痛评分大于3分, 给予曲马多50 mg静脉注射补救镇痛。记录患者有无恶心、呕吐以及口唇发麻、耳鸣等局部麻醉药中毒表现。
术后48 h评估完毕后拔除胸椎旁阻滞导管, 并采用数字化评分量表评估患者对术后镇痛的满意度(分值范围0~10分)。
采用SPSS 21.0软件包对数据进行分析。正态分布的连续变量以均值± 标准差表示, 分类数据以中位数(四分位距, interquartile range, IQR)(范围)表示。
所有27例患者均完成研究。患者一般情况见表1。
| 表1 患者一般资料 Table 1 Patient characteristic data |
所有患者超声下均可分辨穿刺侧第5肋间隙肋间内肌及肋间最内肌, 穿刺针针尖置入两层肌肉间隙后注药, 均可观察到肋间最内肌和壁胸膜被药液推向深方。22例患者第1次置管即成功, 1次置管成功率为81.48%, 另外有3例和2例患者分别在第2次和第3次置管后成功。经肋间隙给药后10、20、30 min患者穿刺侧冷触觉阻滞节段中位数分别为2(IQR 2~3)、3(IQR 3~5)、4(IQR 3~5), 同一时间所有患者对侧均未测出阻滞平面。以阻滞平面大于等于3个节段定义为阻滞成功, 给药后10、20、30 min阻滞成功率为44.44%(12/17)、92.59%(25/27)、100%(27/27)。所有患者穿刺及置管过程中回抽均无回血, 平均操作时间(9.0± 4.3) min, 皮肤至目标间隙深度平均为(2.2± 0.5) cm, 穿刺针平均置入深度为(4.8± 0.8) cm。手术开始后, 手术医生胸腔镜直视下检查均未发现穿刺导致胸膜破损及导管置入胸腔内。
术后镇痛阻滞平面、镇痛效果NRS评分、并发症发生率及患者满意度见表2。
目前临床上常用的超声引导下胸椎旁阻滞技术, 无论是采用斜轴位横断面扫描还是旁矢状切面扫描, 其本质都是直接在TPVS内进行注药和置管, 而本研究采用的外侧肋间入路, 单次阻滞时药液以及持续阻滞时置管都先经过两层肌肉之间的肋间隙, 然后才进入TPVS。Ben-Ari等[9]首次报道了该技术, 但该研究存在一些局限性, 其未测量经穿刺针在肋间间隙单次注药后的阻滞效果, 所以无法评估采用该方法进行单次阻滞时是否会因为局部麻醉药向TPVS扩散不足而影响阻滞效果。本研究穿刺针置入两层肌肉间隙后立即给予0.5%罗派卡因20 mL, 并在给药后10、20及30 min测量阻滞平面, 结果表明, 采用该方法单次阻滞时药液可以有效地扩散到胸椎旁间隙, 取得良好的阻滞效果, 给药30 min后阻滞成功率100%, 所有患者阻滞节段均不少于3个皮区。
| 表2 实验数据 Table 2 Data of the study |
既往研究表明, 通过单次注射药物进行单次胸椎旁阻滞时, 阻滞效果通常比较可靠, 但置管进行持续椎旁阻滞的效果差异较大[7, 17, 18]。在尸体上进行的研究发现, 在保障穿刺针位置正确的情况下进行置管, 仅有60%病例的导管头端位与TPVS, 其余20%位于椎体前, 5%位于硬膜外, 15%无法确定导管位置, 导管不在TPVS区是持续椎旁阻滞效果不佳的主要原因[17]。Ben-Ari等[9]的研究中没有确认置管后导管头端的位置, 因此, 关于导管是否会卡在两层肌肉之间而无法顺利置入TPVS、导管头端是否会因位于椎体前或硬膜外等非椎旁区域导致阻滞成功率低等问题尚不清楚。本研究中所有患者置管后通过超声下旁矢状位TPVS区都见到由生理盐水和空气混合液引起的“ 高回声闪烁” , 说明这种方法能保证导管尖端位置正确。术后随访表明, 在所有时间点阻滞节段中位数均大于等于4个皮区, 而且患者疼痛评分低, 对镇痛满意度高, 间接证实了导管位置良好。另外, 由于Ben-Ari等[9]的研究中所有患者均进行了双侧椎旁阻滞, 所以该研究也无法评估发生硬膜外置管导致双侧阻滞的发生率。本研究中患者均行单侧阻滞, 且所有患者对侧均未测出阻滞平面, 硬膜外置管发生率低, 而未发生双侧阻滞也是本研究中没有患者术后发生低血压及心动过缓等并发症的重要原因。
TPVS前外侧壁由胸内筋膜和壁层胸膜共同构成, 胸内筋膜将胸椎旁间隙分为前后两个部分, 前方为胸内筋膜与壁胸膜之间的胸膜外腔(extrapleural compartment), 后方为胸内筋膜与肋横突上韧带之 间的胸内筋膜下腔(subendothoracic compartment)[19]。脊神经及其发出的肋间神经位于胸内筋膜下腔, 既往研究证实局部麻醉药在这两个腔隙成不同扩散特征, 胸膜外腔的阻滞效果相对较差[18, 19, 20], 所以胸椎旁阻滞的理想腔隙应该在胸内筋膜下腔。发明在术中直视下经胸腔内将导管置入椎旁技术的Sabanathan等[21]认为, 有效地剥离胸内筋膜然后将导管置入胸内筋膜下腔对于保证椎旁阻滞效果非常重要。由于胸内筋膜很薄, 超声下无法显像, 所以采用传统方法经皮将穿刺针直接置入TPVS时, 无法确认针尖及所置入导管是在TPVS中的胸膜外腔还是胸内筋膜下腔。采用外侧肋间入路时, 该区域胸内筋膜位于肋间最内肌深方, 采用平面内技术, 避免穿刺针穿过肋间最内肌, 就能够保证所注入药物及置入的导管不进入胸内筋膜深方的胸膜外腔, 这可能是此方法保证良好的镇痛效果的另一原因。
胸椎旁阻滞的主要并发症包括胸膜穿透、气胸及误穿肋间血管。既往研究报道超声引导下胸椎旁阻滞引起的胸膜穿透及气胸的发生率为0.5%~1.1%, 误穿血管或皮下血肿的发生率为3.8%[22], 本研究中无患者发生胸膜穿透、气胸及误穿肋间血管, 原因可能与样本量较小有关, 但本方法在避免相关风险上也有一定优势。首先, 以TPVS为目标穿刺区域的入路, 目标区域深方即是壁胸膜, 而以肋间间隙作为目标穿刺区域时, 在穿刺区和壁胸膜之间还有肋间最内肌阻隔, 所以相对不容易发生胸膜穿透。其次, 胸3到胸11节段的肋间动脉自胸主动脉发出后, 在TPVS区域多数走行于上下节段横突及肋骨头所形成间隙的中部, 直到向外侧进入肋间内肌和肋间最内肌之间后, 才向上紧贴上一肋骨下缘沿肋沟向外走行[14], 而肋间静脉和肋间动脉伴行, 位于动脉上方[23], 所以, 同样在靠近下一肋上缘进行胸椎旁阻滞操作时, 在肋间隙内进行穿刺相对于TPVS内不容易误伤肋间血管。
本研究存在一些局限性。首先, 本研究采用前瞻性临床研究评估该方法可行性, 没有设对照组, 无法直接与其他胸椎旁阻滞技术进行比较, 要评估该方法与其他胸椎旁阻滞技术的优劣, 需要进一步行不同穿刺入路技术之间的随机对照研究。其次, 虽然本研究中所有患者均未发生与椎旁阻滞相关的并发症, 但仍需要大样本的研究来进一步评估该方法的安全性。
总之, 采用以肋间最内肌和肋间内肌之间的肋间隙作为目标穿刺区域的外侧肋间入路技术进行胸椎旁阻滞, 阻滞成功率高, 术后镇痛效果好, 并发症少。采用该方法为胸外科手术患者进行术后镇痛具有良好的可行性和安全性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|