目的 观察罹患重度牙周炎磨牙拔牙位点同期植入Bio-Oss®并覆盖 Bio-Gide®胶原膜愈合6个月后组织形态学特点和成骨效果。方法 6名研究对象共6颗罹患牙周病变磨牙拔除后即刻在拔牙窝内植入Bio-Oss®颗粒覆盖Bio-Gide®胶原膜。术后6个月,翻瓣再进入,在位点保存区取一块直径2.8 mm、长度6.0 mm的圆柱状骨组织,制作甲苯胺蓝染色的硬组织切片,进行组织学检查和骨组织形态计量学分析。结果 骨组织形态计量学结果显示平均11.54%(0~28.40%)新生骨形成和35.04%(13.92%~50.87%)Bio-Oss®颗粒残留,其中20.13%(0~48.50%)Bio-Oss®颗粒与新生骨组织直接接触,79.87%(51.50%~100.00%)颗粒被结缔组织包裹;上颌位点新生骨和Bio-Oss®颗粒百分比均较下颌位点少。结论 组织学检查发现罹患重度牙周炎磨牙拔牙窝内植入Bio-Oss®并覆盖 Bio-Gide®胶原膜愈合6个月后有新骨形成,仍有较多 Bio-Oss®颗粒残留。
Objective: To evaluate bone formation in human extraction sockets with absorbed surroun-ding walls augmented with Bio-Oss®and Bio-Gide®after a 6-month healing period by histologic and histomorphometric analyses.Methods: Six fresh molar tooth extraction sockets in 6 patients who required periodontally compromised moral tooth extraction were included in this study. The six fresh extraction sockets were grafted with Bio-Oss®particle covered with Bio-Gide®. The 2.8 mm×6.0 mm cylindric bone specimens were taken from the graft sites with aid of stent 6 months after the surgery. Histologic and histomorphometric analyses were performed.Results: The histological results showed Bio-Oss®particles were easily distinguished from the newly formed bone, small amounts of new bone were formed among the Bio-Oss®particles, large amounts of connective tissue were found. Intimate contact between the newly formed bone and the small part of Bio-Oss®particles was present. All the biopsy cylinders measurement demonstrated a high inter-individual variability in the percentage of the bone, connective tissues and Bio-Oss®particles. The new bone occupied 11.54% (0-28.40%) of the total area; the connective tissues were 53.42% (34.08%-74.59%) and the Bio-Oss®particles were 35.04% (13.92%-50.87%). The percentage of the particles, which were in contact with bone tissues, amounted to 20.13% (0-48.50%).Conclusion: Sites grafted with Bio-Oss®particles covered with Bio-Gide®were comprised of connective tissues and small amounts of newly formed bone surrounding the graft particles.
拔牙窝愈合过程如何形成和维持良好的软硬组织条件, 以利于未来的种植治疗, 是当前口腔界极为关注的临床问题。拔牙位点保存术是在拔牙窝内同期植入骨替代品或其他生物材料, 支撑和充填牙槽窝, 引导和促进拔牙窝的骨再生, 以最大程度保存利于修复和种植的硬组织条件[1]。重度牙周炎、牙周-牙髓联合病变的患牙在牙齿拔除前已经存在不同程度的牙槽骨吸收, 若进行种植治疗, 位点保存的必要性尤其重要, 以此重建牙槽嵴的三维形态, 创造种植体长期稳定和发挥功能的基础条件[2]。
近年来, 国内外已有大量应用生物膜和(或)骨替代品进行拔牙位点保存的动物实验和临床研究, 肯定了拔牙位点保存利于保存或重建牙槽嵴的三维形态[3, 4, 5, 6, 7, 8], 但有关应用不同生物材料进行拔牙位点保存后的骨质情况研究尚有不同结论。去蛋白牛骨基质Bio-Oss®作为一种商品化源自牛骨的天然无机异种移植材料, 具有良好的生物相容性和骨引导作用, 是临床上一种有价值的骨替代材料之一[9]。
本课题组既往针对罹患重度牙周炎磨牙拔牙窝内植入Bio-Oss®并覆盖可吸收膜Bio-Gide®进行位点保存, 较自然愈合拔牙窝维持了更好的骨高度和宽度, 保证了种植治疗的骨量条件[10, 11]。本研究试图通过组织学检查和骨组织形态计量学分析, 观察拔牙窝内植入Bio-Oss®并覆盖Bio-Gide®愈合6个月后组织形态学特点和成骨效果, 以指导临床。
所有研究对象均来自北京大学口腔医院牙周科因重度牙周炎需拔除磨牙的患者, 在拔牙同期进行拔牙位点保存, 并选择种植治疗修复该缺牙位点。本研究经北京大学医学伦理委员会审核批准(批件号:PKUSSIRB-201310068), 所有研究对象自愿参加本研究, 并签署知情同意书。
纳入标准:(1)全身健康; (2)良好的口腔卫生; (3)存在无望保留的罹患重度牙周炎的磨牙, 探诊深度> 6 mm, 牙槽骨吸收超过根长的1/2或以上; (4)患牙拔除后拔牙窝至少有两个骨壁剩余高度≥ 3 mm, 至少存在1颗邻牙; (5)经过牙周基础治疗后, 在拔牙同期进行拔牙位点保存(联合应用Bio-Oss®和Bio-Gide®)。
排除标准:(1)年龄< 18岁; (2)吸烟者; (3)怀孕期或哺乳期妇女; (4)有头颈部放射治疗史; (5)长期服用非甾体类抗炎药、皮质类固醇、四环素、双磷酸盐或者其他影响骨再生的药物; (6)牙齿明显拥挤、异位、扭转; (7)患牙存在急性感染; (8)相邻的牙齿一并拔除者。
拔牙位点保存术前治疗、检查和干预过程参照文献[10]进行(图1)。
1.2.1 取骨组织标本 术后6个月进行种植手术时, 翻黏骨膜瓣, 戴入导板, 明确位点保存区域。在该区域进行种植预备前用内径2.8 mm的取骨环钻取一块直径2.8 mm、长度6.0 mm的圆柱状骨组织(图2), 在组织块冠方做小“ V” 形切迹作为区别冠根方的标志。在种植手术时, 术者根据预备种植窝时的手感和观察判断牙槽骨骨质(Misch bone quality index, BQI)[12]。
1.2.2 制作硬组织切片 骨组织标本在4%(体积分数)甲醛溶液中固定, 流水冲洗24 h后, 将骨块从70%至100%(体积分数)乙醇溶液梯度脱水, 标本透明、过滤, 甲基丙烯酸酯树脂包埋。金刚石锯沿骨块长轴切片, 切片厚度约300 μ m, 用粘合剂将切片粘合至硬组织专用的有机玻璃载玻片上。切片24 h干燥后进行磨片和抛光, 在自动磨片机上使用SiC砂纸逐级磨片和抛光(400目、600目、800目、1 200目、2 400目)至切片厚度约30 μ m。切片进行甲苯胺蓝染色后用于组织形态学分析。
1.2.3 组织学定性分析 光学显微镜40倍、100倍、200倍和400倍放大图像下观察标本总体情况, 评价Bio-Oss®颗粒周围是否有新生骨形成。骨组织和Bio-Oss®颗粒的区分依据以下标准:健康的骨组织中板层骨有骨细胞位于骨陷窝, Bio-Oss®颗粒类似坏死骨组织的表现, 没有骨细胞胞核, 骨细胞陷窝是空的, 骨板层次模糊不清。
1.2.4 骨组织形态计量学分析 使用BIOQUANT骨科形态学分析测量系统扫描切片, 获取图像并储存, 在BIOQUANT骨科形态学分析软件上进行骨组织形态学计量。将植骨区域定义为感兴趣区域(region of interest, ROI), 在ROI区域内标定以下参数:整个ROI面积(cylinder area, Cr.Ar, 单位mm2)、新生骨组织面积(bone area, B.Ar, 单位mm2)、Bio-Oss®颗粒面积(Bio-Oss® particle area, BiOs.Ar, 单位mm2)、结缔组织面积(connective tissue area, Cv.T.Ar, 单位mm2)、Bio-Oss®_骨接触周长(bone_Bio-Oss®perimeter, B.BiOs.Pm, 单位mm)和Bio-Oss®_结缔组织接触周长(connective tissue_Bio-Oss® perimeter, T.BiOs.Pm, 单位mm)。在ROI区域内计量以下指标:新生骨组织面积百分比(B.Ar/Cr.Ar), 新生骨组织面积/整个ROI面积; Bio-Oss®颗粒面积百分比(BiOs.Ar/Cr.Ar), Bio-Oss®颗粒面积/整个ROI面积; 结缔组织面积百分比(Cv.T.Ar/Cr.Ar), 结缔组织面积/整个ROI面积; Bio-Oss®_骨接触百分比(B.BiOs.Pm/BiOs.Pm), Bio-Oss®_骨接触周长/Bio-Oss®颗粒周长; Bio-Oss®_结缔组织接触百分比(T.BiOs.Pm/BiOs.Pm), Bio-Oss®_结缔组织接触周长/Bio-Oss®颗粒周长。所有的指标均由同一测量者间隔1周重复测量2次, 进行自身一致性检验。
所有资料均采用SPSS 19.0软件进行统计学分析处理, 各测量指标采用均值± 标准差表示。采用组内相关系数(intraclass correlation coefficient, ICC)值检验自身一致性。
本研究共纳入6例患者, 男5例、女1例, 共有6个磨牙拔牙位点保存后的组织标本, 上、下颌各3个。6个组织标本均取自因牙周病变拔除的磨牙位点, 这些拔牙位点均存在骨壁缺损(表1)。
| 表1 纳入患者与位点情况 Table 1 Patients and sites distribution |
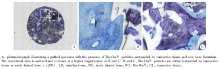
2.1.1 标本的一般特点 6个组织标本的硬组织切片经甲苯胺蓝染色后, 在光学显微镜40倍、100倍、200倍和400倍放大图像下观察, 可以区分紫色的 Bio-Oss®颗粒与淡蓝色骨组织; Bio-Oss®颗粒形态各异, 呈短、厚和边缘锐利的形态; Bio-Oss®颗粒特征与坏死骨组织类似, 缺乏骨细胞核, 骨陷窝空虚, 骨板层次模糊不清(图3)。
2.1.2 组织标本之间的差异 各个组织标本之间差异比较大, 3、4、5号标本Bio-Oss®颗粒表面有较多的新骨形成, 并与之紧密结合, 标本冠方和根方均可见新骨沉积于Bio-Oss®颗粒表面(图4); 1、2、6号标本Bio-Oss®颗粒表面的新骨形成量少, 可见到纤维结缔组织长入、包裹Bio-Oss®颗粒。
2.1.3 组织标本的位置特点 标本冠方可见大量形态大小不一的Bio-Oss®颗粒, 被纤维结缔组织包裹; 标本根方可见少量新生的骨组织沉积于Bio-Oss®颗粒表面(图5)。有的Bio-Oss®颗粒边缘不规则呈现锯齿状的“ 蚕蚀现象” , 表明曾发生过吸收。
2.2.1 测量者的自身一致性检验 ICC值(0.990~0.996)> 0.75, 自身一致性好。
2.2.2 骨形态计量学结果 各组织标本的骨形态计量学结果见表2。小部分Bio-Oss®颗粒(20.13%± 19.98%)与新生骨组织直接接触, 大部分Bio-Oss®颗粒(79.87%± 19.98%)被结缔组织包绕, 个体间差异较大:5号标本中新生骨组织较多(28.40%), Bio-Oss®颗粒残留量较少(36.35%), 且大部分的Bio-Oss®颗粒与新生骨组织接触(48.50%); 而2号标本中未见新生骨组织, 主要由结缔组织(74.59%)和Bio-Oss®颗粒(25.41%)组成。其他组织标本情况详见表2。
2.2.3 上、下颌位点的差异 上、下颌位点组织标本骨组织形态计量学结果之间存在差异, 上颌位点中新生骨和Bio-Oss®面积百分比均较下颌位点少(表3)。
| 表2 6个组织标本骨组织形态计量学结果 Table 2 Morphometric measurements of the tissue samples /% |
| 表3 上、下颌位点组织标本的骨组织形态计量学结果 Table 3 Morphometric measurements of the grafted specimens in the upper and lower area /% |
牙列缺损或缺失后的种植治疗已经成为常规的修复方法之一, 保存或重建牙槽嵴和牙龈解剖形态, 创造利于种植治疗的骨量基础十分关键。重度牙周炎、牙周-牙髓联合病变的患牙在牙齿拔除前已经存在不同程度的牙槽骨吸收, 重建牙槽嵴的三维形态尤为迫切。拔牙位点保存是在拔牙后即刻进行拔牙窝内生物材料移植, 支撑和充填牙槽窝, 其目的包括阻断或减缓牙槽骨吸收, 阻挡牙龈上皮或纤维组织进入拔牙窝, 引导和促进拔牙窝的骨再生, 实现牙槽骨的保存或增量[1], 目前国际口腔界对此已形成共识。
近年来, 国内外已有大量应用生物膜和或骨替代品进行拔牙位点保存的动物实验和临床研究, 已经明确位点保存利于保存或重建牙槽嵴的三维形态[3, 4, 5, 6, 7, 8], 但有关应用不同生物材料进行拔牙位点保存后的骨质情况研究尚有不同结论。本课题组既往针对罹患重度牙周炎磨牙拔牙位点保存的效果, 从临床影像学方面证实存在骨缺损的重度牙周炎磨牙拔牙同期在拔牙窝内植入Bio-Oss®并覆盖Bio-Gide®胶原膜可以一定程度地增加牙槽骨高度和宽度[10, 11], 本研究则期望通过组织学研究观察拔牙位点保存处组织形态学特点和成骨效果, 以为临床开展此项工作提供生物学依据。
牙槽窝自然愈合及不同生物材料进行拔牙位点保存后的组织学研究国内外报道较少, 体内研究更为少见。Chan等[13]的系统综述中总结自然愈合的拔牙窝内新生骨和结缔组织的面积百分比分别为38.5%和58.3%; 而应用异种移植材料后拔牙窝内新生骨组织面积百分比差异较大, 从减少22%到增加9.8%不等, 结缔组织百分比下降, 平均愈合5.6个月后仍有大量的异种移植物颗粒残留在牙槽窝内。Bio-Oss®为一种商品化的源自牛天然骨无机材料的异种移植物, 与人体骨无机结构有类似的化学成分、宏观与微观多孔结构, 具有良好的生物相容性和骨引导作用, 但是吸收替代率低。Piattelli等[9]长期临床研究也发现术后4年植骨区仍存在Bio-Oss®颗粒, 但体外实验显示, 破骨细胞可以在 Bio-Oss®颗粒表面增殖, 之后分化为破骨细胞样细胞, 产生吸收性陷窝, 体内实验也证实Bio-Oss®颗粒表面的多核细胞抗酒石酸磷酸酶染色呈阳性[14, 15, 16], 说明这些细胞具有破骨细胞样特性。因此, Bio-Oss®颗粒是否真正被吸收以及吸收降解的速率尚需进一步深入的研究。Gholami等[17]在非磨牙位点牙齿拔除后植入Bio-Oss®覆盖Bio-Gide®胶原膜, 愈合 6~8个月后骨组织百分比为27.35%(编织骨:18.21%), 结缔组织百分比为52.03%, 残留Bio-Oss®颗粒为20.62%。本研究观察到存在牙槽骨缺损的磨牙拔除后即刻在牙槽窝内植入Bio-Oss®并覆盖Bio-Gide®愈合6个月后, 拔牙窝内位点保存部位主要由结缔组织(53.42%± 16.52%)和Bio-Oss®颗粒(35.04%± 13.82%)占据, 四周和根方可见新生骨组织(11.54%± 11.29%)。本研究的结果与以往研究存在差异的原因有以下几个方面。
第一, 本研究纳入的拔牙位点为磨牙位点, 拔牙窝体积大、位点中存在骨缺损、牙槽窝内大部分根间隔消失, 导致成骨细胞来源少, 并且因存在骨壁缺损影响植骨空间的维持和植骨材料的稳定, 在一定程度上会影响骨再生的效果, 导致大量结缔组织形成, 少量新骨形成。Berglundh等[18]和Carmagnola等[19]分别在比格犬的下颌骨中人为制造长40 mm× 宽5 mm× 高8 mm的四周均存在骨壁的缺损和长25 mm× 宽4 mm× 高5~6 mm的仅留一侧骨壁的缺损, 均在骨缺损内植入Bio-Oss®, 愈合3个月后植入种植体, 种植体植入4个月后取组织标本进行组织学检查, 结果前者发现植骨位点有一定程度的新骨形成, 而后者发现植骨位点没有新骨形成, 提示骨缺损的类型和大小会影响成骨的效果。
第二, 本研究纳入的拔牙位点均因严重牙周病变导致牙齿拔除。牙周病是牙菌斑引起的感染性疾病, 造成牙周组织炎症性反应, 大量炎症细胞浸润, 释放大量炎症因子, 尽管拔牙前全口牙周基础治疗、拔牙清创过程严格, 但仍会在一定程度上影响拔牙窝的愈合。Ahn等[20]通过对无牙周炎的拔牙位点和存在牙周炎的拔牙位点愈合2~42周后的骨组织标本进行组织学检查, 发现存在牙周炎的拔牙位点骨再生速度较无牙周炎的位点慢。
第三, 本研究在牙齿拔除后牙槽窝内植入Bio-Oss®并覆盖Bio-Gide®, 通过龈瓣的松弛, 获得初期软组织的完全关闭, 但因术后组织水肿, 张力增大, 4个位点在术后1~2周均出现部分软组织开裂, 膜暴露, 可能不利于骨再生, 且软组织开裂后, 胶原膜及植骨材料暴露在口腔微环境中, 会有细菌的聚集, 直接影响Bio-Oss®发挥骨引导作用, 减少骨再生量。Simion等[21]的研究结果显示, 不可吸收屏障膜暴露的病例中骨再生量大大减少, 胶原膜暴露可能会减少约20%的新骨形成。
关于上、下颌颌骨生长特点和血供特点是否会影响位点保存效果, 本研究发现, 上、下颌位点组织标本的骨组织形态计量学结果存在差异, 上颌位点中新生骨和Bio-Oss®颗粒百分比均较下颌位点少, 这可能与上、下颌颌骨骨质本身特点不同有关。Lindhe等[22]研究结果显示, 健康患者上、下颌拔牙窝愈合至少6个月后牙槽骨组织成分有显著差异, 下颌位点板层骨约占63%、骨髓约占16%, 上颌位点板层骨仅占46%、骨髓约占23%, 提示拔牙位点完全愈合后上颌位点骨髓成分较下颌位点多, 板层骨较下颌少。这些特点同样会影响位点保存术后牙槽窝骨质的构成, 当然也与上颌位点Bio-Oss®颗粒因重力作用流失有关。
拔牙位点保存的位点植入种植体后, 残留的Bio-Oss®颗粒与种植体表面如何接触, 是否会影响植体的骨结合尚存在争议。Berglundh等[18]在动物实验中发现, Bio-Oss®颗粒不与种植体表面直接接触, 它们间有约0.5 mm宽的正常矿化骨, 在Bio-Oss®植骨区植入的种植体与在自体骨植入的种植体骨结合率没有明显差别。此外, 行位点保存后的拔牙区埋入种植体的时机也尚无定论, 存在牙周炎的位点骨再生速度较无牙周炎的位点慢, 植骨后可能会延长其愈合时间。本研究拔牙位点保存愈合6个月后虽然残留35.04%± 13.82%的Bio-Oss®颗粒, 新骨形成仅为11.54%(0~28.40%), 相对自然愈合(38.50%)[13]偏少, 后续对该6个位点实施正常的种植治疗, 种植体植入合适三维轴向时骨量充足不需要进行骨增量手术(图1), 植入后均获得一定的初期稳定性, 目前其中3例已完成修复并负重达20个月以上, 其余3例完成修复并负重半年以上, 植体周围健康、功能良好(相关资料另文发表), 当然长期效果尚需追踪观察。
综上, 本研究从有限的罹患重度牙周炎磨牙拔除后位点保存处组织学检查发现, 罹患重度牙周炎的磨牙拔牙窝内植入Bio-Oss®并覆盖 Bio-Gide®胶原膜愈合6个月后, 新生骨组织形成较少, 有较多Bio-Oss®颗粒残留, 并被结缔组织包裹。本研究纳入的样本量较小, 缺少自然愈合对照组的组织学结果, 今后的研究尚需扩大样本量进一步分析和探讨罹患重度牙周炎的磨牙拔除后位点保存的成骨效果、影响因素及埋入种植体的时机, 并结合后期种植治疗, 明确罹患重度牙周炎磨牙拔牙位点保存的组织学特点、生物学基础和长期的临床效果。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|