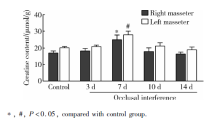
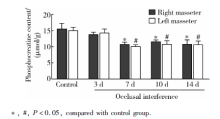
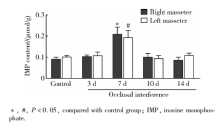
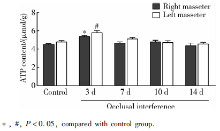
目的 观察咬合干扰后不同时间大鼠咬肌能量代谢产物腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、腺嘌呤核苷二磷酸(adenosine diphosphate,ADP)、次黄嘌呤核苷酸(inosine monophosphate,IMP)、磷酸肌酸、肌酸、乳酸及pH水平的变化,分析咬合干扰对咀嚼肌能量代谢的影响。方法 选用雄性Sprague-Dawley大鼠(220~250 g)50只,随机分为实验组(40只)和对照组(10只),实验组于右上第一磨牙粘固0.4 mm厚金属冠建立咬合干扰,并分别维持3、7、10、14 d(每个时间点各10只), 对照组不施加咬合干扰。各组大鼠全麻下取双侧咬肌组织,其中5只大鼠样本加入0.4 mol/L高氯酸(10 mL/g)充分匀浆,离心、过滤后采用高效液相色谱分析ATP、ADP、IMP、磷酸肌酸、肌酸及乳酸含量,另外5只大鼠样本加入含5 mmol/L碘醋酸钠的匀浆液(10 mL/g),充分匀浆后在37 ℃恒温水浴环境中利用pH计测试pH值。结果 与对照组相比,大鼠双侧咬肌ATP含量在咬合干扰3 d [右侧:(5.36±0.13) μmol/g,左侧:(5.77±0.25) μmol/g] 升高( P<0.05),7、10和14 d没有显著改变;大鼠双侧咬肌IMP[右侧:(0.21±0.03) μmol/g,左侧:(0.19±0.03) μmol/g]、肌酸[右侧:(24.76±2.94) μmol/g,左侧:(27.75±2.23) μmol/g]含量在咬合干扰7 d升高( P<0.05),3、10和14 d没有显著改变;大鼠双侧咬肌磷酸肌酸含量在咬合干扰7、10和14 d降低[右侧分别为:(10.70±0.71) μmol/g、(11.57±0.52) μmol/g、(10.74±1.39) μmol/g,左侧分别为:(10.05±0.57) μmol/g、(10.75±1.12) μmol/g、(10.61±1.15) μmol/g, P<0.05],3 d没有显著改变;大鼠双侧咬肌ADP、乳酸含量及pH水平在咬合干扰后各时间点均没有显著改变( P>0.05)。结论 咬合干扰导致大鼠咀嚼肌能量代谢产物含量改变,可能与咬合干扰诱发咀嚼肌疼痛、功能紊乱、肌纤维构筑改变等病理过程相关。
Objective: To investigate the effect of occlusal interference on the energy metabolism of masticatory muscle by studying the changes of adenosine triphosphate (ATP), adenosine diphosphate (ADP), inosine monophosphate (IMP), phosphocreatine, creatine, lactate and pH level in masseter muscles of rats after occlusal interference.Methods: Fifty male Sprague-Dawley rats were randomly assigned into experimental group ( n=40) and control group ( n=10). In experimental group, 0.4 mm thick metal crown was cemented to the upper right first molar of the rat, and maintained for 3, 7, 10, 14 d separately ( n=10 for each time point). No occlusal interference was applied for control group. Bilateral masseter muscles of all the rats were acquired under general anesthesia. The samples of 5 rats in each group were fully homogenized with 0.4 mol/L perchlorate (10 mL/g). The homogenates were centrifuged, filtered and analyzed for ATP, ADP, IMP, phosphocreatine, creatine and lactate content by high performance liquid chromatography. The other samples in each group were mixed with homogenates containing 5 mmol/L sodium iodoacetate (10 mL/g), then homogenized and measured for pH value by pH meter in thermostatic water bathunder 37 degrees centigrade.Results: Compared with control group, ATP content in bilateral masseter of the rats increased 3 d after occlusal interference [right side:(5.36±0.13) μmol/g,left side:(5.77±0.25) μmol/g] ( P<0.05), and back to normal on 7, 10 and 14 d. There was an increase in IMP [right side:(0.21±0.03) μmol/g,left side:(0.19±0.03) μmol/g]and creatine content [right side:(24.76±2.94) μmol/g,left side:(27.75±2.23) μmol/g]in bilateral masseter of the rats 7 d after occlusal interference ( P<0.05) and no difference was detected on 3, 10, and 14 . Phosphocreatine content in bilateral masseter started to decline 7 d after occlusal interference and maintained the low level on 10 and 14 d [right side:(10.70±0.71) μmol/g, (11.57±0.52) μmol/g, (10.74±1.39) μmol/g, left side:(10.05±0.57) μmol/g, (10.75±1.12)μmol/g, (10.61±1.15) μmol/g]( P<0.05). No change of ADP, lactate or pH level in bilateral muscles of the rats after occlusal interference was observed ( P>0.05).Conclusion: Occlusal interference influences the content of energy metabolites in masticatory muscle of rats, which may be related to the pathological process of masticatory muscles induced by occlusal interference, such as muscle pain, dysfunction and altered fiber architecture.
临床上常见因不恰当口腔治疗致咬合干扰(occlusal interference)的患者, 出现咀嚼肌酸痛、无力及紧张、痉挛甚至疼痛等咀嚼肌紊乱症状, 其机制尚不完全清楚, 缺乏明确有效的治疗手段。以往研究报道较严重的咬合干扰可导致咀嚼肌出现组织损伤和炎症表现[1]。本课题组前期通过在大鼠单侧磨牙粘固金属冠建立接近临床的咬合干扰致咀嚼肌疼痛动物模型[2, 3, 4], 观察0.4 mm厚的咬合干扰对大鼠咀嚼肌及神经系统的影响, 未发现咬肌出现明显损伤或炎症, 但检测到咬肌组织中P物质等神经活性物质出现上调[5], 同时支配咬肌三叉神经中与伤害感受相关的腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)和H+受体表达也出现上调[6, 7], 并发现咬合干扰可导致伤害感受初级中枢神经元敏化及胶质细胞活化[8], 提示较轻度的咬合干扰所致咀嚼肌疼痛是一种伴有神经病理性改变的非损伤非炎性疼痛, 但咬合干扰如何诱发口颌面神经系统产生疼痛相关病理性改变尚不清楚。
研究表明, 运动可导致骨骼肌能量代谢产物水平改变, 如磷酸肌酸消耗、ATP降解产物次黄嘌呤核苷酸(inosine monophosphate, IMP)升高、乳酸堆积、pH下降等, 这些代谢因素被认为在运动致肌疲劳和延迟性肌肉酸痛中起重要作用[9, 10]。以往研究已证实咬合干扰可影响咀嚼肌功能运动, 产生异常的肌电活动和运动型[11, 12, 13, 14], 而咬合干扰对咀嚼肌能量代谢产物的影响以及代谢因素是否参与诱发咬合干扰致咀嚼肌疼痛尚不清楚。有学者观察到兔咬合干扰后咬肌线粒体出现Ca2+超载、ATP合成被抑制等变化, 通过咬肌线粒体的代谢变化间接提示咬合干扰可能导致咬肌能量代谢紊乱[15], 但直接检测咬合干扰后咬肌能量代谢产物含量变化的研究较少, 本课题组建立的咬合干扰模型中咬肌能量代谢产物含量是否发生变化尚不清楚。
本研究拟检测咬合干扰后大鼠咬肌与能量代谢相关的腺嘌呤核苷酸ATP、腺嘌呤核苷二磷酸(adenosine diphosphate, ADP)及其脱氨基降解产物IMP、磷酸肌酸、肌酸、乳酸以及pH水平的变化, 以揭示咬合干扰对咀嚼肌能量代谢产物的影响, 初步探索咬合干扰诱发咀嚼肌疼痛可能的外周代谢机制。
实验动物:雄性Sprague-Dawley大鼠, 体质量220~250 g, 购自北京维通利华实验动物技术有限公司。大鼠饲养条件为:24 h昼夜交替, 室温25 ℃, 自由饮水饮食。随机分为:(1)实验组(n=40), 大鼠按已建立的方法[3]于右上第一磨牙粘固0.4 mm厚金属冠, 建立咬合干扰, 分别维持3、7、10、14 d(每个时间点10只); (2)对照组(n=10), 大鼠模拟实验组干预过程但不施加咬合干扰。实验组各时间点及对照组大鼠全麻下迅速取双侧咬肌组织于液氮冻存, 其中5只大鼠样本用于高效液相色谱分析, 5只用于检测组织pH水平。
高效液相色谱分析:咬肌组织于液氮冷却下研磨成粉末, 按1 g ∶ 10 mL比例加入0.4 mol/L高氯酸于冰浴环境中充分匀浆。匀浆液于0 ℃, 3 000× g离心10 min, 取上清液用K2CO3中和至pH6.8, 再次离心, 取上清液, 0.45 μ m滤器过滤后进行高效液相色谱分析。使用Shim-pack CLC-ODS反相色谱柱(长度:25 cm, 内径:4.6 mm, 粒径:5 μ m, 岛津公司, 日本), 柱温:室温。(1)乳酸分析条件:按照Hallströ m等[16]的方法, 流动相为0.1 mol/L磷酸盐缓冲液, pH 2.4; 流速为1.2 mL/min; 进样20 μ L; 紫外检测波长为210 nm; 出峰时间为6.8 min。(2)ATP、ADP、IMP、磷酸肌酸、肌酸分析条件:按照Ally等[17]的方法, 流动相A为35 mmol/L KH2PO4、6 mmol/L 四丁基硫酸氢铵, pH 6.0, 流动相B为A加入等体积乙腈; 梯度洗脱程序为:① 98% (体积分数)A+2% B运行10 min, ②10 min内逐渐变换为45%A+55%B, ③ 45%A+55%B维持 5 min; 流速为1.5 mL/min; 进样25 μ L; 紫外线检测波长:磷酸肌酸、肌酸为210 nm, ATP、ADP、IMP为260 nm; 肌酸、磷酸肌酸、IMP、ADP、ATP出峰时间分别为1.9、6.9、10.5、20.5和23.4 min。
检测咬肌匀浆液pH水平:按照Costill等[18]的方法, 从液氮中取出咬肌组织, 按1 g ∶ 10 mL比例加入匀浆液(145 mmol/L KCl, 10 mmol/L NaCl, 5 mmol/L碘醋酸钠, 用NaOH调至pH7.0), 于冰浴环境中充分匀浆。咬肌匀浆液在37 ℃恒温水浴环境中用pH计测试pH值。
统计学分析:以SPSS 20.0软件进行分析, 实验数据以均数± 标准误表示, 应用单因素方差分析检验咬合干扰不同时间对每侧咬肌相应能量代谢产物含量的影响, 使用Bonferroni法进行组间比较; 应用配对t检验分析各组左右侧咬肌相应能量代谢产物含量的变化。所有检验均采用双侧检验, P< 0.05为差异有统计学意义。
与对照组相比, 咬合干扰7 d大鼠双侧咬肌肌酸含量显著升高(P< 0.05), 咬合干扰3、10和14 d大鼠双侧咬肌肌酸含量没有显著改变(P> 0.05), 各组大鼠左右侧咬肌肌酸含量差异无统计学意义(P> 0.05, 图1)。
与对照组相比, 咬合干扰7、10和14 d大鼠双侧咬肌磷酸肌酸含量显著降低(P< 0.05), 咬合干扰3 d大鼠双侧咬肌磷酸肌酸含量没有显著改变(P> 0.05), 各组大鼠左右侧咬肌磷酸肌酸含量差异无统计学意义(P> 0.05, 图2)。
与对照组相比, 咬合干扰7 d大鼠双侧咬肌IMP含量显著升高(P< 0.05), 咬合干扰3、10和14 d大鼠双侧咬肌IMP含量没有显著改变(P> 0.05)。各组大鼠左右侧咬肌IMP含量差异无统计学意义(P> 0.05, 图3)。
与对照组相比, 咬合干扰3 d大鼠双侧咬肌ATP含量显著升高(P< 0.05), 咬合干扰7、10和14 d大鼠双侧咬肌ATP含量没有显著改变(P> 0.05), 各组大鼠左右侧咬肌ATP含量差异无统计学意义(P> 0.05, 图4)。
与对照组相比, 咬合干扰3、7、10和14 d大鼠咬肌ADP含量均没有显著变化(P> 0.05), 各组大鼠左右侧咬肌组织ADP含量差异无统计学意义(P> 0.05, 图5)。
 | 图5 咬合干扰大鼠咬肌ADP含量变化(n=5)Figure 5 Change of ADP content in bilateral masseter of rats after occlusal interference(n=5) |
与对照组相比, 咬合干扰3、7、10和14 d大鼠咬肌乳酸含量均没有显著变化(P> 0.05), 各组大鼠左右侧咬肌组织乳酸含量差异无统计学意义(P> 0.05, 图6)。
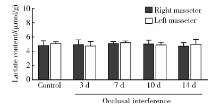 | 图6 咬合干扰大鼠咬肌乳酸含量变化(n=5)Figure 6 Change of lactate content in bilateral masseter of rats after occlusal interference(n=5) |
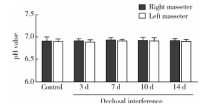
与对照组相比, 咬合干扰3、7、10和14 d大鼠咬肌pH水平均没有显著变化(P> 0.05), 各组大鼠左右侧咬肌组织pH水平差异无统计学意义(P> 0.05, 图7)。
ATP是已知各种生命活动唯一的直接供能物质, 在一定条件下, ATP中的高能磷酸键水解转化为ADP, 同时释放能量供生命活动使用。反之, 在一定条件下, ADP可以接受能量重新合成高能磷酸键, 转化为ATP。ATP和ADP的相互转化实现了能量的储存和释放, 而ATP/ADP含量的动态平衡保证了机体内稳定的供能环境。一般情况下骨骼肌所含ATP仅能维持1~3 s肌肉活动, 而肌组织内存在3种合成ATP的途径:磷酸肌酸途径、肌糖原无氧酵解途径和有氧氧化途径[10]。磷酸肌酸属磷酸原供能系统, 当ATP消耗时, 可以在肌酸激酶催化下快速生成ATP(磷酸肌酸+ADP← → 肌酸+ATP), 保证ATP含量的稳定, 肌内储存的磷酸肌酸一般可维持10 s左右肌肉活动; 无氧酵解途径是肌糖原在缺氧状态下分解为乳酸的同时生成ATP, 一般可维持1~3 min的肌肉活动, 这两种途径是从事短时间、剧烈运动时肌肉的主要供能方式。有氧氧化途径是在氧充足的条件下, 肌糖原或脂肪彻底氧化分解为H2O和CO2, 生成大量ATP, 可以维持较长时间持续运动[10]。运动医学研究表明, 低强度运动时, 骨骼肌ATP含量几乎不变, 中等强度运动至力竭时, ATP含量略有下降, 当最大强度运动至力竭时, ATP含量最多下降30%~40%; 在运动引起磷酸肌酸大量消耗前, ADP含量改变不大[19], 表明多数情况下骨骼肌通过各种供能途径可基本维持ATP和ADP含量的平衡。当ATP的利用率超过合成能力时, 首先由磷酸肌酸途径发挥缓冲作用, 磷酸肌酸含量下降, 伴随肌酸含量升高, ATP变化很小。当磷酸肌酸耗尽后, 进一步能量消耗导致ATP下降, ADP含量升高, 此时腺苷酸激酶被激活, 催化反应2 ADP← → ATP+AMP, AMP含量升高后进一步通过腺苷酸脱氨酶作用, 生成IMP和NH3(AMP+H2O← → IMP+NH3), 而IMP的进一步分解则是较缓慢的过程[20], 因此肌组织IMP升高提示ADP和AMP曾有一过性升高, 反映了ATP合成与利用之间的失平衡。研究表明, 休息或低强度运动时骨骼肌IMP含量很低, 而中高强度运动时IMP含量增加[21], 因此, 有学者提出肌组织IMP升高可以作为能量缺乏的标志[9]。以往有学者研究了功能运动时咬肌能量代谢产物含量的变化, 发现最大咬合时, 咬肌磷酸肌酸含量下降, ATP水平无明显变化, pH改变很少, 其代谢变化程度不如四肢肌明显[22]; 持续咬合至疲劳时, 咬肌磷酸肌酸含量下降, pH略降低, ATP无显著改变[23]。
咬合异常时, 机体通过神经反馈对咀嚼肌的收缩活动进行相应调整, 以减少咬合创伤和行使咀嚼功能, 从而产生异常的运动型。但关于咬合干扰后咬肌相关能量代谢产物含量变化的研究较少。本实验结果表明, 咬合干扰3 d时, 双侧咬肌ATP含量显著升高, ADP、IMP、肌酸、磷酸肌酸等含量均无显著变化, 增加的ATP来源尚不清楚, 可能源于肌组织能量代谢过程ATP合成增加, 也可能来源于神经末梢或血液成分释放ATP增多[24, 25]。以往研究报道, 功能运动时正常状态咬肌ATP含量基本保持稳定[22, 23], 但在过度收缩致咀嚼肌疼痛病理模型中咬肌受机械刺激释放的ATP较对照组显著增多[26]。ATP既是肌组织重要的直接供能物质, 同时又是重要的神经活性物质, 可以通过激活ATP受体引起外周神经末梢去极化反应, 产生外周神经敏感化[27], 可能成为咬合干扰诱发咀嚼肌疼痛的代谢因素之一。研究已发现咬合干扰后外周三叉神经ATP受体P2X3、P2X4表达上调, 且与咬合干扰致咬肌机械痛敏有关[7, 28], 而咬肌ATP含量增加与其受体表达上调之间是否存在因果关系值得进一步研究。咬合干扰7 d时, 双侧咬肌IMP、肌酸含量显著升高, 磷酸肌酸含量显著下降, ADP、ATP含量没有改变。IMP升高表明ATP的消耗速率超过了合成速率; 磷酸肌酸含量下降, 同时肌酸含量升高, 表明肌组织启动了磷酸肌酸途径来合成ATP, 以维持ATP稳态, 这些能量代谢产物变化提示咬合干扰7 d时咬肌可能存在异常功能活动, 出现能量代谢紊乱。前期研究表明该时间点也是咬合干扰致咬肌机械痛敏最显著时间点[3], 此时的咀嚼肌功能紊乱可能是疼痛的促进因素, 也可能是疼痛导致的伴随症状。咬合干扰10、14 d时, 双侧咬肌磷酸肌酸含量持续下降, 而ATP、ADP、IMP、肌酸等含量均无显著改变, 推测此时磷酸肌酸含量下降可能与咬合干扰致肌纤维构成比例改变有关。Muller等[29]报道咬合干扰后大鼠双侧咬肌肌纤维构筑改变, 以有氧代谢为特征的耐疲劳的慢肌纤维比例增加, 而以往研究表明快肌纤维磷酸肌酸含量较慢肌纤维高15%~20%[9]。咬合干扰致咀嚼肌肌纤维构筑改变可能为肌肉对新运动型的适应和代偿, 但从能量代谢角度分析, 磷酸肌酸含量下降意味着能量储备下降, 咀嚼肌行使功能时更易出现能量缺乏, 对功能运动的耐受能力降低。咬合干扰后各时间点双侧咬肌乳酸和pH水平均无显著改变。乳酸为肌糖原无氧酵解途径的终产物, 乳酸含量没有改变提示本咬合干扰模型咬肌糖酵解总体水平没有显著变化。有学者研究咬肌咬合运动的代谢变化特点, 发现咬肌能量代谢周转率高, 氧化磷酸化活性高[23], 提示咬肌能量代谢过程可能以有氧氧化途径为主。咬合干扰各时间点pH水平均没有改变, 推测可能0.4 mm咬合干扰程度相对较弱, 不足以改变肌组织总体酸碱度水平。有学者报道咬肌在最大咬合及持续咬合状态下其pH变化都不大[22, 23], 提示咬肌酸碱平衡稳态不容易被破坏。
本研究发现咬肌能量代谢产物随咬合干扰不同时间出现不同的变化, 揭示了咬合干扰对咀嚼肌能量代谢产物的影响。咬合干扰3 d咬肌ATP含量出现一过性升高, 是否参与诱发咬合干扰致咀嚼肌疼痛值得继续深入研究; 咬合干扰7 d咬肌磷酸肌酸含量下降, 肌酸和IMP含量升高, 提示咬合干扰可致咀嚼肌能量代谢紊乱; 咬合干扰10 d后咬肌磷酸肌酸含量持续下降, 可能与咬合干扰致咀嚼肌肌纤维构筑改变有关。研究咬合干扰后咀嚼肌的代谢变化, 有助于深入理解咬合干扰致咀嚼肌疼痛的外周机制, 为寻找新的临床治疗方法提供思路。
(志谢:本研究高效液相色谱分析实验在北京大学医药卫生分析中心完成, 在此感谢黄宁华老师等在该部分实验中给予的指导和帮助。)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|