目的 比较丝线结扎和涂抹牙龈卟啉单胞菌诱导小鼠牙周炎模型的牙槽骨骨吸收程度、激活破骨细胞及去除诱因后成骨的过程。方法 48只C57BL6小鼠随机分配,采用分口设计,根据涂抹2%(质量分数)羧甲基纤维素(carboxymethylcellulose, CMC)或109个菌落形成单位(colony-forming units, CFU)的牙龈卟啉单胞菌以及是否丝线结扎分为4组( n= 24),分别为对照组(右上第二磨牙单纯涂抹CMC)、丝线结扎组(围绕左上第二磨牙结扎9-0丝线)、涂菌组(右上第二磨牙单纯涂抹牙龈卟啉单胞菌)和丝线结扎+涂菌组(结扎左上第二磨牙并涂抹牙龈卟啉单胞菌),测量釉牙骨质界至牙槽骨嵴顶(cementoenamel junction to the alveolar bone crest,CEJ-ABC)的距离,监测牙槽骨的吸收。48只C57BL6小鼠设计和分组同上,牙槽骨骨面的破骨细胞采用抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色并计数。36只C57BL6小鼠随机分配,其中30只小鼠在左侧上颌第二磨牙结扎9-0丝线,观察3周,有12只小鼠在丝线结扎1周后拆除丝线,继续观察2周,分别在丝线结扎1、2、3周以及丝线拆除1周和2周共5个时间点( n=6)各处死6只小鼠,检测CEJ-ABC距离;未行丝线结扎的小鼠CEJ-ABC距离( n=6)为基线水平。采用单因素方差分析(ANOVA)法对所有数据进行统计学分析。结果 丝线结扎组的小鼠牙周炎,在3、6、9和12周后的CEJ-ABC距离分别为(0.16±0.04) mm、(0.16±0.02) mm、(0.18±0.03) mm、(0.17±0.02) mm,与对照组[(0.09±0.03) mm、(0.10±0.01) mm、(0.12±0.04) mm、(0.12±0.01) mm]和涂菌组[(0.09±0.03) mm、(0.12±0.01) mm、(0.12±0.02) mm、(0.10±0.01) mm]相比差异有统计学意义( P<0.05)。与对照组[(0.09±0.03) mm]相比,丝线结扎组第3周的CEJ-ABC距离为(0.16±0.04) mm,比涂菌组[(0.09±0.03) mm]诱导的牙槽骨骨吸收更迅速,丝线结扎和涂抹牙龈卟啉单胞菌结合并未进一步增加牙槽骨的吸收破坏。在丝线结扎1 d后,牙槽骨表面的破骨细胞即被激活,与对照组[(2±2)个]相比在第3天达到高峰[(12±4)个, P<0.01]。丝线结扎诱导的小鼠牙周炎,在丝线去除2周后CEJ-ABC距离为(0.07±0.02) mm,与去除丝线前[(0.13±0.01) mm]相比显著降低,提示有显著的牙槽骨再生( P<0.01)。结论 丝线结扎术是一种迅速且有效的诱导小鼠牙周炎牙槽骨骨吸收的方式,其诱导的破骨细胞活化在丝线结扎后24 h内发生,3 d达到高峰,去除实验性牙周炎的诱导因素即去除结扎的丝线有助于牙槽骨骨再生。
Objective: To compare the extent and time course of alveolar bone loss and osteoclast activation in two murine models of periodontal disease: molar ligation and Porphyromonas gingivalis ( P. gingivalis) oral inoculation.Methods: A split-mouth design was applied to two groups of mice (C57BL6, 6-8 weeks old, n=24 in both groups), resulting in four treatment groups: (1) Control group: unliga-ted upper right 2nd molars receiving CMC only, (2)Ligature group: ligation of a 9-0 suture around the upper left 2nd molar, (3) P. gingivalis group: unligated upper right 2nd molar receiving P. gingivalis challenge only, (4)Ligature + P.gingivalis group: ligation of the upper left 2nd molar in combination with oral inoculation with 109 colony-forming units(CFU) P. gingivalis. Alveolar bone loss was measured as the cementoenamel junction and alveolar bone crest (CEJ-ABC) distance. In the study, 48 C57BL6 mice were designed and treated as described above, and osteoclasts were counted on histological sections following tartrate-resistant acid phosphatase (TRAP) staining and counts were normalized to alveolar bone surface distance. Then 36 C57BL6 mice were investigated, of which 30 were ligated a 9-0 silk ligature around the 2nd molar in the left maxillary quadrant and 6 were not ligated. After ligation for 1 week, the ligatures in 12 mice were taken off for either 1 week or 2 weeks. The CEJ-ABC distance of the 6 mice without ligation was baseline. The CEJ-ABC distances were measured and analyzed. The data were analyzed with one-way ANOVA.Results: Molar ligation induced marked alveolar bone loss after 3, 6, 9 and 12 weeks [(0.16±0.04) mm, (0.16±0.02) mm, (0.18±0.03) mm, (0.17±0.02) mm], vs. corresponding controls [(0.09±0.03)mm,(0.10±0.01)mm,(0.12±0.04)mm,(0.12±0.01)mm] and P. gingivalis group [(0.09±0.03)mm、(0.12±0.01)mm,(0.12±0.02)mm,(0.10±0.01)mm], P<0.05. Combined treatment with molar ligation and P. gingivalis did not further increase the CEJ-ABC distance. Evidence for osteoclast activation was found one day after molar ligation, and TRAP-positive cell numbers peaked on day 3 (12±4 vs. control 2±2, P<0.01). After taking off ligature following ligation for 2 weeks, it showed significantly regrowth of alveolar bone compared with that before removal of the ligature on day 7 [(0.07±0.02)mm vs. (0.13±0.01)mm, P<0.01].Conclusion: Molar ligation is a rapid and effective way to induce periodontal bone loss in mice. Osteoclast activation occurs within 24 hours of ligature placement, and the extent of bone loss well exceeds that of the P.gingivalis-induced bone loss. Removing ligature after periodontal disease might help bone regeneration by regrowth of the alveolar bone.
牙周组织疾病是牙龈组织的局部慢性炎症, 可导致牙槽骨骨吸收和牙列支持结构的破坏[1]。牙周疾病由积聚在牙龈缝隙内或周围的口腔微生物始动, 然而, 大部分的组织损伤是由宿主反应本身导致, 疾病的严重程度取决于特定的菌斑微生物和宿主的免疫状态[2]。研究发现, 在慢性牙周疾病的牙周袋中3种革兰氏阴性菌[伴放线放线杆菌、福赛斯类杆菌和牙龈卟啉单胞菌(Porphyromonas gingivalis, P. gingivalis)]检测升高[3]。牙龈卟啉单胞菌是慢性牙周炎致病菌的一种, 而伴放线放线杆菌往往在局限性侵袭性牙周炎中发现, 这些微生物具有毒性因子, 可提高它们的传染性, 并使得微生物易于繁殖和聚集在牙周膜[4]。
牙周炎是菌斑微生物的直接细胞毒性、蛋白的溶解和宿主的免疫反应间接作用的后果[4]。细菌抗原与炎症细胞的相互作用导致白细胞介素1(interleukin 1, IL-1)和肿瘤坏死因子α (tumor necrosis factor, TNF-α )等细胞因子的分泌[5, 6]。研究证实, 这些因子可刺激骨吸收, 不同蛋白酶的产生也同时促进骨吸收和支持组织的损失[5, 6]。细菌的致病因素也影响到多种类型的细胞, 这些细胞参与骨的再生[5, 6]。
鼠类的牙龈解剖结构与人类类似, 研究者们建立了不同的动物模型(如猴、狗、猫、鼠)诱导牙周疾病[7]。不同的方法已被广泛用来评估小鼠牙周炎模型牙槽骨骨吸收, 包括形态学检查、放射学检查、组织形态计量学和微型电脑断层分析[8]。多种多样的实验方法用于诱导牙周疾病的动物模型, 包括口腔应用牙周致病菌、丝线结扎、饮食和牙龈注射脂多糖等, 所有方法均可导致不同程度的牙槽骨破坏[9]。
在牙齿的龈沟周围结扎丝线是一种众所周知的诱导牙周疾病的方法, 与口腔涂牙龈卟啉单胞菌相比, 丝线结扎模型近年来越来越多应用于小鼠, 而目前系统性分析比较丝线结扎和口腔涂抹牙龈卟啉单胞菌诱导牙槽骨骨吸收效率的研究较少, 本研究旨在分析比较两种方法诱导的小鼠牙周炎炎症过程和程度, 并观察去除引起小鼠牙周炎炎症的诱因后牙槽骨的骨再生情况。
本实验共用132只清洁级C57BL6小鼠(6周龄), 48只小鼠用于检测釉牙骨质界至牙槽骨嵴顶(cementoenamel junction to the alveolar bone crest, CEJ-ABC)的距离, 48只小鼠用于检测破骨细胞数目, 36只小鼠用于检测牙槽骨骨再生。小鼠统一由标准实验室饲喂, 所有动物采用吸入二氧化碳和颈椎脱位处死。
1.2.1 丝线结扎和口腔涂抹牙龈卟啉单胞菌 牙龈卟啉单胞菌(A7436)在37 ℃厌氧环境中培养, 菌落集成单位(colony-forming units, CFU)采用分光光度计进行测定。48只C57BL6小鼠随机分配, 采用分口设计, 根据涂抹2%(质量分数)羧甲基纤维素(carboxymethyl cellulose , CMC)或109个 CFU牙龈卟啉单胞菌以及是否丝线结扎分为4组(n=24), 分别为对照组(右上第二磨牙单纯涂抹CMC)、丝线结扎组(围绕左上第二磨牙结扎9-0丝线)、涂菌组(右上第二磨牙单纯涂抹牙龈卟啉单胞菌)和丝线结扎+涂菌组(结扎左上第二磨牙并涂抹牙龈卟啉单胞菌)。丝线结扎小鼠经腹腔注射氯胺酮(100 mg/kg)及甲苯噻嗪(5 mg/kg)麻醉, 在显微镜下操作完成。每周检查一次丝线, 失去丝线的小鼠进行标记并重新结扎, 所有小鼠共观察12周, 分别在3、6、9和12周各处死12只小鼠, 测量CEJ-ABC距离。
1.2.2 牙槽骨骨吸收的测量 将小鼠牙槽骨反复用水和3%(体积分数)双氧水清洗, 经1%(质量分数)亚甲蓝(Sigma-Aldrich公司, 美国)染色45 s, 37 ℃烤箱干燥。在显微镜下测量小鼠上颌3个磨牙颊侧7个位点的CEJ-ABC距离, 每个位点重复测量3次取平均值。
1.2.3 丝线结扎和口腔涂抹牙龈卟啉单胞菌后牙龈组织的破骨细胞分化 48只C57BL6小鼠随机分配, 采用分口设计, 根据涂抹CMC或109个CFU牙龈卟啉单胞菌以及是否丝线结扎分为4组(n=24), 分别为对照组、丝线结扎组、涂菌组和丝线结扎+涂菌组。分别在1、3、7和14 d各处死12只小鼠。小鼠处死后即刻心脏灌注4%(体积分数)多聚甲醛, 上颌用4%(体积分数)多聚甲醛固定, 5%(体积分数) 甲酸脱钙7~10 d, 30%(质量分数)蔗糖磷酸盐缓冲液中浸泡7 d。采用MICROM HM550低温恒温切片机(Walldorf, 德国MICROM国际有限公司)制备10 μ m厚牙切片, -20 ℃冰柜储存。破骨细胞采用抗酒石酸酸性磷酸酶(tartrate-resistant acidic phosphatase, TRAP)染色, 对小鼠上颌磨牙颊侧根牙槽骨表面的破骨细胞进行计数。
1.2.4 结扎丝线拆除后的骨再生 36只小鼠随机分配, 其中30 只C57BL6小鼠在左侧上颌第二磨牙结扎9-0丝线, 观察3周, 其中12只小鼠在丝线结扎1周后拆除丝线, 继续观察2周。分别在丝线结扎1、2、3周以及丝线拆除1周和2周共5个时间点(n=6)各处死6只小鼠, 检测CEJ-ABC距离; 未行丝线结扎的小鼠CEJ-ABC距离(n=6)为基线水平。
采用SPSS 20.0软件进行分析, 计量资料的描述采用均数± 标准差表示。多组间比较的组别因素分别为CEJ-ABC距离和破骨细胞数, 采用单因素方差分析, 多重比较采用方差分析法, 所有的检验均为双侧检验, P< 0.05为差异具有统计学意义。
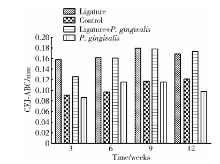
丝线结扎组的小鼠牙周炎, 在3、6、9和12周后的CEJ-ABC距离分别为(0.16± 0.04) mm、(0.16± 0.02) mm、(0.18± 0.03) mm、(0.17± 0.02) mm, 与对照组相比差异有统计学意义(P< 0.05)。整个12周内, 丝线结扎组诱导的小鼠牙周炎的CEJ-ABC距离比涂菌组显著增高(P< 0.05, 图1)。实验3周后, 丝线结扎组CEJ-ABC距离[(0.16± 0.04) mm]比丝线结扎+涂菌组[(0.12± 0.01)mm]高25%(P> 0.05); 在6, 9, 12周丝线结扎+涂菌组的CEJ-ABC距离并未显示高于丝线结扎组, 两组之间差异无统计学意义(P> 0.05)。涂菌组的CEJ-ABC距离仅在实验6周有骨吸收高峰, 与对照组相比差异有统计学意义(P< 0.05), 图2显示对照组和涂菌组小鼠CEJ-ABC距离。
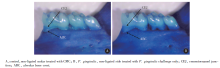
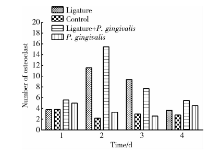
丝线结扎组[(12± 4)个]和丝线结扎+涂菌组[(15± 2)个]的第二磨牙周围牙槽骨表面的破骨细胞数量在第3天达到高峰, 均显著高于对照组[(2± 2)个]和涂菌组[(3± 2)个, P< 0.05, 图3]。实验第3天, 丝线结扎+涂菌组的破骨细胞比丝线结扎组高33.79%, 差异无统计学意义。图4显示了对照组和丝线结扎+涂菌组小鼠上颌第二磨牙颊根表面TRAP染色的破骨细胞。
本研究进行了长达12周的动物实验, 比较丝线结扎和/或口腔涂抹牙龈卟啉单胞菌诱导牙周疾病的模型, 观察牙槽骨骨吸收及破骨细胞分化的程度。实验包括4组:对照组、丝线结扎组、涂菌组和丝线结扎+涂菌组, 分别在3, 6, 9, 12周测量并比较各组CEJ-ABC的距离作为牙槽骨丧失的指标。最早在实验第3周, 丝线结扎组和丝线结扎+涂菌组已观察到显著的牙槽骨丧失(P< 0.05)。涂菌组的骨吸收高峰出现在实验6周后, 这与Baker等[10]牙槽骨骨吸收的实验结果相吻合。在小鼠牙龈龈沟内的结扎丝线可促进菌斑生物膜的形成, 利于小鼠口腔内的内源细菌的堆积。此外, 丝线在龈沟内存在的机械性作用可能使龈嵴变平从而造成微循环紊乱, 因此, 本研究认为丝线类似于人类牙周疾病中的牙结石, 发挥机械刺激作用[11]。本研究结果证实, 围绕小鼠磨牙进行丝线结扎可迅速诱导小鼠快速的牙槽骨丧失, 可作为快速诱导牙周炎动物模型实验方法的一种。
在整个实验12周内, 丝线结扎组和丝线结扎+涂菌组的CEJ-ABC距离均比对照组显著增高(P< 0.05), 证实丝线结扎和丝线结扎加口腔涂抹牙龈卟啉单胞菌均可诱导小鼠牙周炎症, 从而导致牙槽骨骨吸收。本研究实验结果提示, 丝线结扎+涂菌组的CEJ-ABC距离并未显著性高于丝线结扎组, 表明牙龈卟啉单胞菌并未呈现出增加丝线结扎导致的牙槽骨骨吸收的程度。
 | 图5 结扎丝线拆除后的牙槽骨骨再生Figure 5 Alveolar bone loss initiated by molar ligation and the bone regeneration after removal of ligature |
牙槽骨骨吸收是牙周疾病的一个重要特征, 骨吸收是由破骨细胞前体细胞分化、破骨细胞成熟以及骨的有机和无机成分的降解引发的一系列过程。本研究比较了丝线结扎、口腔涂抹牙龈卟啉单胞菌与结扎加涂菌诱导牙周炎进展过程中的炎症程度以及破骨细胞分化。丝线结扎组和结扎+涂菌组第3天破骨细胞分化达高峰, 与雪貂、狗、猴子和人类试验观察的结果相一致[12]。丝线结扎组比涂菌组的破骨细胞数显著增多, 提示丝线结扎比牙龈卟啉单胞菌更快速地诱导牙周组织炎症反应及牙槽骨破骨细胞分化, 这一实验数据与显微镜下测量的CEJ-ABC距离提示的牙槽骨骨吸收相一致。丝线结扎+涂菌组的破骨细胞比单纯丝线结扎诱导的破骨细胞增多34%, 意味着结扎丝线加牙龈卟啉单胞菌在急性炎症期对破骨细胞分化具有更大的影响, 牙龈卟啉单胞菌增强了结扎在第二磨牙周围丝线的功能。这些数据表明, 结扎丝线或结扎丝线加牙龈卟啉单胞菌相结合的方式与单纯涂抹牙龈卟啉单胞菌相比, 是一种更快速、有效构建牙周炎症模型的方法。
牙周疾病导致的牙周组织结构破坏的再生研究经体内和体外实验广泛进行。骨组织通过破骨细胞和成骨细胞的不断相互作用维持平衡状态[13]。本实验评估了丝线结扎引起的牙周疾病模型的再生潜力, 去除结扎的丝线1或2周, 可观察到CEJ-ABC的距离显著降低, 这表明, 尽管炎症进展迅速, 磨牙丝线结扎引起的牙周骨吸收是一种可逆的现象。
综上所述, 丝线结扎与涂抹牙龈卟啉单胞菌相比, 可更快速地诱发小鼠牙周炎炎症, 导致更强的牙槽骨骨吸收以及破骨细胞的激活, 去除结扎的丝线有利于破坏的牙槽骨再生。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|