目的 评价浓缩生长因子(concentrated growth factors, CGFs)在下颌磨牙Ⅱ度根分叉病变再生治疗中的作用。方法 纳入需进行手术的15例牙周炎患者,20颗下颌磨牙,31个下颌磨牙Ⅱ度根分叉病变,随机分为2组,试验组采用CGFs+植骨术进行治疗,对照组采用单纯植骨术进行治疗。在术前和术后1年时分别对患牙进行临床检查,并拍摄锥束CT(cone beam computed tomography, CBCT)。比较试验组和对照组手术前后临床和CBCT数据的变化。结果 基线时两组的探诊深度、垂直附着丧失和水平附着丧失差异均无统计学意义( P>0.05):探诊深度分别为试验组(7.36±2.32) mm,对照组(7.53±2.06) mm;垂直附着丧失分别为试验组(8.69±1.65) mm,对照组(8.81±1.53) mm;水平附着丧失分别为试验组(5.24±2.01) mm,对照组(5.35±2.14) mm。术后1年时,两组临床指标均有显著改善( P<0.001),其中试验组垂直附着获得为(2.78±1.66) mm,垂直附着丧失较基线时有显著改善( P<0.001);水平附着获得为(2.10±1.89) mm,水平附着丧失较基线时有显著改善( P<0.001)。对照组垂直附着获得为(1.73±1.87) mm,垂直附着丧失较基线时有显著改善( P<0.001);水平附着获得为(1.28±1.97) mm,水平附着丧失较基线时有显著改善( P<0.001)。试验组垂直和水平附着获得显著高于对照组( P<0.001)。基线时两组CBCT显示的垂直骨丧失和水平骨丧失差异均无统计学意义( P>0.05):垂直骨丧失分别为试验组(5.08±2.17) mm,对照组(5.84±2.65) mm;水平骨丧失分别为试验组(5.85±2.13) mm,对照组(6.01±2.27) mm。术后1年时,CBCT显示,两组垂直骨缺损和水平骨缺损较基线时均有显著改善( P<0.001),其中试验组垂直骨缺损减少(2.20±1.98) mm,水平骨缺损减少(2.51±2.18) mm,垂直和水平向骨吸收程度均较基线时有显著改善( P<0.001)。对照组垂直骨缺损减少(1.89±2.15) mm,水平骨缺损减少(1.30±2.47) mm,垂直和水平向骨吸收程度也较基线时有显著改善( P<0.001)。试验组垂直和水平向骨吸收改善程度显著高于对照组( P<0.001)。结论 CGFs可以促进植骨术在下颌磨牙Ⅱ度根分叉病变中的治疗效果。
Objective: Concentrated growth factors (CGF), a new generation of platelet concentrate products, appears to have more abundant growth factors because of its special centrifugation process. However, there are few studies supporting this. This study was designed to evaluate the effect of CGFs in the treatment of Ⅱ° furcations of mandibular molars.Methods: In the present study, thirty-one Ⅱ° furcation involvements in twenty mandiblular molars were included and randomly divided into two groups. The furcation involvements in the experimental group were treated with bone graft therapy combined with CGFs, and the furcation involvements in the control group were treated with bone graft therapy alone. The clinical examination and cone beam computed tomography (CBCT) were performed at baseline and 1 year post-surgery for the two groups. The changes of clinical and CBCT data at baseline and 1 year post-surgery were compared between the experimental group and the control group.Results: At baseline, there were no significant differences between the two groups in the probing depth (PD), vertical clinical attachment loss (CAL-V) and horizontal clinical attachment loss (CAL-H): PD (7.36±2.32) mm (the experimental group) vs. (7.53±2.06) mm (the control group); CAL-V (8.69±1.65) mm (the experimental group) vs. (8.81±1.53) mm (the control group); CAL-H (5.24±2.01) mm (the experimental group) vs. (5.35±2.14) mm (the control group). At the end of 1 year post-surgery, the clinical parameters of both groups were significantly improved ( P<0.001). For the experimental group, the average vertical attachment gain was (2.78±1.66) mm, and the vertical attachment loss was improved significantly compared with the baseline ( P<0.001); the average horizontal attachment gain was (2.10±1.89) mm, and the horizontal attachment loss were improved significantly compared with the baseline ( P<0.001). Furthermore, the improvement degree of the experimental group was significantly higher than that of the control group ( P<0.001). At baseline, there were no statistical differences in the vertical bone loss (BL-V) or horizontal bone loss (BL-H) between the two groups ( P>0.05): BL-V (5.08±2.17) mm (the experimental group) vs. (5.84±2.65) mm (the control group); BL-H (5.85±2.13) mm (the experimental group) vs. (6.01±2.27) mm (the control group). At 1 year post-surgery, both groups showed significant radiographic bone gain at vertical and horizontal directions compared with baseline ( P<0.001). For the experimental group, the average vertical radiographic bone gain was (2.20±1.98) mm, the horizontal radiographic bone gain was (2.51±2.18) mm, the vertical and horizontal radiographic bone loss were both significantly reduced compared with the baseline ( P<0.001). For the control group, the average vertical radiographic bone gain was (1.89±2.15) mm, the horizontal radiographic bone gain was (1.30±2.47) mm, the vertical and horizontal radiographic bone losses were both significantly reduced compared with the baseline ( P<0.001). And the experimental group showed significantly higher bone gain at vertical and horizontal directions compared with the control group ( P<0.001).Conclusion: Within the limitation of the present study, CGFs showed positive role in the treatment of Ⅱ° furcation involvements of mandibular molars.
根分叉病变是导致磨牙早失的重要原因之一, 也是牙周治疗的重点和难点之一。研究证实, 有根分叉病变的多根牙较单根牙的附着丧失更广泛, 其对非手术牙周治疗的反应也更差[1]。如何获得根分叉病变的完全关闭一直是学者们研究的热点, 目前, 根分叉病变最有效的再生治疗方法是植骨术与引导性组织再生术(guided tissue regeneration, GTR)的结合[2]。
GTR可以促进根分叉病变在水平方向和垂直方向的附着获得, 通过不同的机械性屏障膜的使用, 可以将根分叉病变的完全治愈率提高至67%[3]。然而, GTR的治疗效果仍然受到了根分叉区域再生环境和再生潜力的影响, 因此, 其疗效并不完全具备可预测性。
组织再生是细胞、支架、信号分子三者联合作用的结果, 作为信号分子, 生长因子控制着组织修复过程中每一阶段的发生和发展[4, 5]。研究者们不断地寻找和检测能够有效促进牙周组织再生的生长因子, 目前研究最为广泛的生长因子有血小板衍化生长因子、转化生长因子β 1、胰岛素样生长因子-1、成纤维细胞生长因子等[6, 7, 8, 9]。对于上述单一生长因子的应用研究已取得初步进展, 但对于多生长因子的研究仅局限于两种生长因子的配伍。然而, 外源性生长因子的体外重组过程费时费力、造价昂贵, 其安全性仍在研究之中, 尚无法用于临床, 且无法模拟内源性生长因子间复杂的相互作用和网络关系, 没有任何一种单一的外源性生长因子可以有效地介导组织修复的所有方面。
血小板是内源性生长因子的主要来源[10], 研究者们不断尝试将血小板的衍生物用于临床, 利用其中的生长因子达到促进组织再生的目的。2000年, de Obarrio等[11]将血小板的浓缩物— — 富血小板血浆(platelet-rich plasma, PRP)与脱矿冻干骨联合应用治疗牙周骨袋, 取得了较好的疗效。然而, 随着PRP在牙周组织再生中的研究深入, 研究者们逐渐发现了PRP的局限性。PRP的作用原理是利用外源性的凝血酶和氯化钙启动血凝过程的最后一个阶段和快速的纤维蛋白聚集, 这一过程是一种即刻反应, 在血小板激活和纤维蛋白胶凝过程中, 短时间内大量释放出来的血小板因子, 其作用非常局限[12]。
浓缩生长因子(concentrated growth factors, CGFs)是新一代的自体生长因子提取物, 它的制备通过变速离心分离静脉全血获得, 完全来源于自体, 不需要添加任何外源性凝血酶或抗凝剂。从理论上讲, 由于采取了梯度密度离心的方法, CGFs中生长因子的种类和含量应较PRP更加丰富。除此之外, CGFs还获得了红细胞浓缩物的红色部分和血小板以及白细胞, 并含有CD34阳性细胞, 这意味着CGFs有可能最大限度地发挥全血的促再生作用[13]。可以认为, CGFs极有可能是一个具有增强型纤维蛋白凝块及生长因子和细胞因子的升级版PRP。
CGFs的研究刚刚起步, 目前尚未见到CGFs在根分叉病变再生治疗中的报道, 本研究的目的是评价CGFs在下颌磨牙Ⅱ 度根分叉病变再生治疗中的作用。
研究开始前已获得北京大学口腔医院伦理委员会的批准(PKUSSIRB-201523075)。本研究的纳入标准为:年龄在20~60岁的慢性牙周炎患者; 经基础治疗的下颌磨牙, 牙周袋深度≥ 5 mm、水平探诊深度≥ 3 mm, 需行牙周手术者; 放射学显示根分叉区有透影区; 患者知情同意。排除标准为:患牙牙髓活力异常或已接受牙髓治疗者; 妊娠期和哺乳期妇女; 有严重全身疾病者; 根分叉区牙体组织龋坏/缺损/劈裂; 其他手术非适应证。
纳入15例慢性牙周炎患者, 共20颗下颌磨牙, 颊舌侧共31个根分叉病变。
纳入的15名患者中, 5名患者每人有2颗下颌磨牙纳入研究, 对于这5名患者, 采取随机分口设计, 将2颗磨牙随机分入两组进行治疗; 其他10名患者, 每人有1颗下颌磨牙纳入研究, 直接进行随机分组。试验组采用CGFs+植骨术进行治疗, 对照组进行单纯植骨术。两组的根分叉病变分布情况如下:试验组纳入下颌磨牙10颗, 颊舌侧根分叉病损共16个(9个颊侧根分叉病损, 7个舌侧根分叉病损); 对照组纳入下颌磨牙10颗, 颊舌侧根分叉病损共15个(8个颊侧根分叉病损, 7个舌侧根分叉病损)。
在术前和术后1年时分别对根分叉病变进行临床检查, 检查指标如下:(1)探诊深度(probing pocket depth, PPD):牙周袋袋底-龈缘的距离; (2)牙龈退缩(gingival recession, REC):龈缘-釉牙骨质界(cementoenamel junction, CEJ)的距离; (3)垂直附着丧失(vertical clinical attachment loss, CAL-V):袋底-釉牙骨质界的距离; (4)根分叉病变分度, 采取Hamp’ s分度法(1975)[14]:0度:根分叉未探及; Ⅰ 度:可探及根分叉, 根分叉区水平向缺损≤ 3 mm; Ⅱ 度:根分叉区水平向缺损> 3 mm, 但未贯通; Ⅲ 度:根分叉水平向缺损贯通。(5)根分叉水平附着丧失(horizontal clinical attachment loss, CAL-H):根分叉区水平探入最深点至根分叉开口的距离。检查工具:UNC-15牙周探针、Naber探针。所有的临床检查均由同一名有经验的医师(检查者1)完成。研究开始前进行检查者自身一致性的检验。
在术前和术后1年时拍摄患牙的锥束CT(cone beam computed tomography, CBCT)。使用3D Accui-tomo 60, XYZ Slice View Tomograph CBCT(日本森田公司)对下颌磨牙区域在74~90 kV、5.0~8.0 mA、像素0.125 mm× 0.125 mm× 0.125 mm的条件下进行扫描获得原始数据, 扫描时间17.5 s, 选择层厚 0.5 mm 进行断层数据重建, 获得CBCT图像。图像由CBCT自带软件i-Dixel-3DX进行测量, 精确至0.01 mm。所有测量均由同一名有经验的放射学医师(检查者2)在暗室内的同一台显示器上(Walnut公司, 美国)完成, 屏幕分辨率为1 280像素× 1 024像素, 两次读片时间间隔1周, 研究开始前进行检查者自身一致性的检验。
CBCT标志点的确定:(1)根分叉处CEJ:在X平面将垂直标志线移至根分叉中央处, 在Y平面上寻找釉质的最根方点; (2)根分叉开口:在X平面将垂直标志线移至根分叉中央处, 在Y平面上寻找颊侧(或舌侧)根分叉处的转折点; (3)根分叉处骨袋底:在Y平面上, 根分叉中央附近的断面上寻找垂直向牙槽骨的最根方点; (4)根分叉处骨嵴顶:在X平面将垂直标志线移至根分叉中央处, 在Y平面上寻找牙槽骨最外缘、最高处; (5)根分叉水平骨缺损最深处:在Y平面上根分叉中央附近的断层上寻找水平向牙槽骨缺损的最深点。
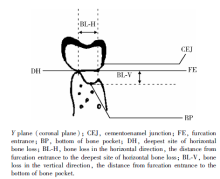
根据上述参照点, 术前和术后1年时CBCT测量参数如下:(1)垂直骨丧失(bone loss in the vertical direction, BL-V):以根分叉开口为参考点, 根分叉区骨吸收最根方至根分叉开口的垂直距离。(2)水平骨丧失(bone loss in the horizontal direction, BL-H):在根分叉开口水平上, 水平骨缺损最深处至分叉口的水平距离(图1)。
用2支无菌采血管(奥地利格瑞纳公司)采集每位牙周炎患者肘静脉血共18 mL, 立即将其放入 Medifuge CGFs专用离心机(Silfradent公司, 意大利)中, 离心过程如下:30 s加速、2 700 r/min× 2 min、2 400 r/min× 4 min、2 700 r/min× 2 min、3 000 r/min× 3 min、36 s减速、停止。离心后全血分离成3层:上层为血清、中层为网罗了大量血小板和生长因子的纤维蛋白凝胶(即CGFs), 下层为红细胞层。将上层血清倒出, 1份CGFs和红细胞层置于无菌容器内, 剪碎至1~2 mm大小, 与骨粉混合后置于搅拌器中混合均匀, 用于手术, 另1份CGFs用专用工具压制成膜状, 用于手术(图2)。
试验组采取CGFs +植骨术进行治疗, 植入材料为多孔样牛骨矿物质(bovine porous bone mineral, BPBM, 盖氏公司, 瑞士)+CGFs; 对照组采取单纯植骨术进行治疗, 仅植入Bio-Oss骨粉。手术过程如下:术区翻全厚瓣后彻底清创, 试验组植入Bio-Oss骨粉与CGFs的混合物, 置入CGFs膜, 瓣复位, 4-0不可吸收线缝合; 对照组植入Bio-Oss骨粉后直接进行瓣复位和缝合, 压迫止血。
 | 图3 试验组4号病例的术前、术中和术后临床照片Figure 3 Baseline, in surgery and 1 year post-surgery of the patient 4 of the experimental group |
试验组4号病例的术前、术中、术后临床照片见图3, CBCT表现见图4、5。
术后两组患者均给予阿莫西林克拉维酸钾0.458 g 口服, 每12小时1次, 口服7 d, 并给予0.12%(体积分数)氯己定含漱液含漱4周。
术后1周时复查, 拆线。术后前3个月每个月随访1次, 之后每3个月随访1次, 直至术后1年。给予患者口腔卫生指导和必要的口腔清洁措施。
采用SPSS 11.5软件包对所得数据进行分析。用Cohen’ s kappa进行2名检查者的自身一致性检验, kappa值在0.81~0.92时, 认为高度一致。用配对t检验比较试验组和对照组各自手术前后临床数据和CBCT数据的变化, 用独立样本t检验比较两组数据变化间的差别。P< 0.05时认为差异有统计学意义。
检查者1 Cohen’ s kappa值为0.901, 检查者2 Cohen’ s kappa值为0.885, kappa值均在高度一致范围(0.81~0.92), 说明两名检查者各自的自身一致性均较好。
基线时与术后1年时两组的临床指标见表1。基线时两组纳入的根分叉病变均为Ⅱ 度根分叉病变。两组基线时的探诊深度、垂直附着丧失和水平附着丧失差异均无统计学意义(P> 0.05)。术后1年时两组临床指标均有显著改善(P< 0.001), 试验组垂直附着获得和水平附着获得分别为(2.78± 1.66) mm和(2.10± 1.89) mm, 改善程度显著高于对照组(P< 0.001)。
| 表1 试验组与对照组基线时和术后1年时的临床指标 Table 1 Clinical measurements of experimental and control group at baseline and 1 year post-surgery |
基线时与术后1年时两组的CBCT测量指标见表2。基线时两组的垂直骨丧失、水平骨丧失均无统计学差异(P> 0.05)。术后1年时, 试验组垂直向骨缺损和水平向骨缺损较基线时和对照组均有显著改善(P< 0.001), 分别改善(2.20± 1.98) mm和(2.51± 2.18) mm。
| 表2 试验组与对照组基线时和术后1年时的CBCT指标 Table 2 CBCT data of experimental and control group at baseline and 1 year post-surgery |
本研究比较了CGFs+植骨术和单纯植骨术治疗下颌磨牙Ⅱ 度根分叉病变的效果, 结果表明, CGFs+植骨术和单纯植骨术均能促进下颌磨牙根分叉病变的再生, 但CGFs+植骨术的临床和放射学效果均显著优于单纯植骨术。
本研究结果提示, CGFs可以促进植骨术在下颌磨牙Ⅱ 度根分叉病变中的再生效果, 其作用机制可能与CGFs中的促再生成分有关。
CGFs制备采取的是变速离心法, 这使得大量的生长因子沉积到纤维蛋白层和红细胞凝块的上部。Rodella等[13]的研究证实, CGFs中的转化生长因子β -1和血管内皮生长因子在纤维蛋白层和红细胞层中大量存在。已有大量研究证实了生长因子在牙周组织再生中的促细胞生长、分化作用[15, 16, 17]。同时, 与PRP的快速释放模式不同, CGFs中生长因子的释放是缓慢的, 强大的纤维蛋白凝胶中网罗了大量的生长因子, 其释放过程与天然的血凝块相似, 因此, CGFs延长了生长因子作用的时间, 这有助于生长因子协同发挥作用。
纤维蛋白是CGFs中的主要组分, 本研究将纤维蛋白部分剪碎, 并与骨粉混合使用。众所周知, 牙周组织再生过程中, 纤维蛋白凝块的黏附和成熟对于结缔组织附着的形成是非常重要的[18]。CGFs不仅促进了伤口的稳定性, 同时为细胞因子和细胞迁移提供了支架。Rodella等[13]观察到由粗细不等的纤维蛋白原丝组成纤维蛋白的网状结构, 其间陷入了大量的血小板, 这种三维环境对组织再生过程中细胞间的相互作用和蛋白间的相互作用至关重要。
CGFs中另一个可能的有利成分是干细胞。Rodella等[13]证实, CGFs的纤维蛋白层中有CD34阳性细胞存在, 他们发现CD34阳性细胞更多地存在于纤维蛋白层, 越来愈多的证据证实了CD34阳性细胞在血管新生和形成中的作用。
此外, 本研究用CGFs膜完全覆盖缺损, 不仅能为组织愈合提供空间, 而且其内富含的大量生长因子和纤维蛋白成分可以促进软组织的愈合。
有研究报道CGFs显著促进了犬牙周膜干细胞的体外增殖和分化[19], 这些发现可以部分地解释本研究的结果。
本研究的局限性在于样本量和观察时间均有限, 同时, 因病例数量所限, 无法完全采取分口设计。我们需要更大的样本量和更长的观察时间来评价CGFs在根分叉病变乃至整个牙周组织再生中的作用, 同时, 也需要更多的体外研究来分析其作用机制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|