目的 以人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVECs)为模型细胞,研究纯钛表面的形貌因素对种植体周围成血管效应的可能影响。方法 构建不同结构形貌的纯钛表面,包括光滑表面、纳米结构表面、微米结构表面以及微米/纳米复合结构表面,检测不同形貌纯钛表面对HUVECs的黏附和增殖能力,检测血管内皮生长因子(vascular endothelial growth factor, VEGF)的分泌能力和HUVECs内钙离子(calcium,Ca2+)的浓度。结果 不同形貌纯钛材料在扫描电子显微镜下分别具有光滑表面、纳米结构表面、纳米结构表面和微米/纳米复合结构表面。扫描电子显微镜和细胞骨架染色结果显示,在不同形貌纯钛表面孵育24 h后,光滑表面结构组的细胞数目从(18±4)个/视野增加到(42±6)个/视野,纳米结构表面组的细胞数目从(28±6)个/视野增加到(52±10)个/视野,微米结构表面组的细胞数目从(20±4)个/视野增加到(21±6)个/视野,微米/纳米复合结构组表面的细胞数目从(16±4)个/视野增加到(18±6)个/视野,微米结构表面组和微米/纳米复合结构表面组黏附和增殖的细胞数目显著少于光滑表面结构组和纳米结构表面组( P<0.05)。酶联免疫吸附定量研究显示,HUVECs在光滑结构表面、纳米结构表面、微米结构表面以及微米/纳米复合结构表面VEGF分泌量分别为(690±35) ng/L、(560±20) ng/L、(474±43) ng/L、(517±29) ng/L,与光滑结构表面相比,HUVECs在微米结构表面和微米/纳米复合结构表面分泌的VEGF量显著减少( P<0.05)。Ca2+免疫荧光探针检测结果显示,HUVECs细胞内Ca2+在微米结构表面和微米/纳米复合结构表面的表达显著高于在光滑结构表面和纳米结构表面。结论 HUVECs在微米结构表面和微米/纳米复合结构表面的功能受影响可能与在这些表面HUVECs内钙浓度的增加相关,因此,种植体表面的形貌因素可能通过影响内皮细胞的功能,对种植体周围的成血管效应造成影响。
Objective: To study the role of different scale structure of Ti implants on the biological behaviors of human umbilical vein endothelial cell (HUVECs) and to reveal the role of material surface topographical features on peri-implant angiogenesis.Methods: Titanium(Ti) discs with different surface structures (Ti discs with smooth surface, Ti discs with nano scale structure, Ti discs with micro scale structure and Ti discs with micro/nano scale structure, named as SM-Ti, Nano-Ti, Micro-Ti and Micro/nano-Ti, respectively) were prepared and their surface topographical features were confirmed via scanning electron microscopy (SEM) observation. HUVECs were cultured on these Ti discs. Biological outcomes of HUVECs on different surfaces were carried out, including cell adhesive capacity, proliferation, vascular endothelial growth factor (VEGF) production and intracellular expression of Ca2+.Results: The results of SEM images and immunofluorescence double staining of rhodamine-phalloidin and DAPI showed that compared with the SM-Ti and Nano-Ti group, the adhesive capacity and proliferation behavior of HUVECs on the surfaces of Micro-Ti and Micro/nano-Ti was decreased. The results of culturing HUVECs on different groups of Ti discs after 24 hours showed that the cells number grew from (18±4) to (42±6)/ vision on SM-Ti, (28±6) to (52±10)/vision on Nano-Ti, (20±4) to (21±6)/vision on Micro-Ti and (16±4) to (18±6)/vision on Micro/nano-Ti. Moreover, compared with the adhesion and proliferation of HUVECs on SM-Ti group and Nano-Ti, the adhesion and proliferation of HUVECs on Micro-Ti group and Micro/nano-Ti group was significantly reduced ( P<0.05).The results of enzyme-linked immunosorbent assay (ELISA) showed that the VEGF productions of SM-Ti, Nano-Ti, Micro-Ti and Micro/nano-Ti were (690±35) ng/L, (560±20) ng/L, (474±43) ng/L and (517±29) ng/L, respectively. Moreover, compared with the VEGF production of HUVECs on SM-Ti group, the VEGF production of HUVECs on Micro-Ti group and Micro/nano-Ti group was significantly reduced ( P<0.05). The results of Ca2+ ion detection showed that the Ca2+expression of HUVECs on Micro-Ti and Micro/nano-Ti was significantly higher than that on the surface of SM-Ti and Nano-Ti. These results implied that the over expressed Ca2+ might contributed to the impaired biological function of HUVECs on Micro-Ti and Micro/nano-Ti.Conclusion: Different topographical features on titanium influenced the biological behaviors of the HUVECs, which may illustrate how topographical features of Ti implant affect peri-implant angiogenesis. These results also suggest that the biological behaviors of HUVECs might be relative to the changed expression of intracellular Ca2+.
血管新生(angiogenesis)是指在原有毛细血管的基础上形成新生血管的过程, 其最主要的作用在于为机体创伤修复过程带来所需的细胞、氧气和养分以及带走代谢废物, 并在创伤修复的免疫应答过程中起到重要作用, 因此, 新生血管的生成对于创伤后组织重建具有重要的影响[1]。纯钛种植体因其良好的生物相容性、耐腐蚀性、优秀的机械性能及较低的弹性模量[2]等特性, 在临床上得到了广泛的运用。纯钛种植体植入后骨结合形成的过程也可以看作是一个创伤愈合的过程, 该过程不仅包括成骨活性细胞分泌胞外基质并矿化沉积形成新骨, 也与创伤愈合前期新生毛细血管床的形成以及后续的血管网络改建有着密切的联系。
在现有研究中, 如何优化并促进种植体周围新骨形成是研究者们关注的热点[3, 4]。钛基表面拓扑结构被认为是影响种植体周围新骨形成最主要因素之一[5], 目前形成的共识是在钛基表面拓扑结构中(包括光滑表面、纳米结构表面、微米结构表面以及微米/纳米复合结构表面), 具有微米以及微米/纳米复合结构的表面形貌的钛基种植体最有利于种植体周围新骨的形成[3], 但是, 钛基表面的不同尺度形貌因素对种植体周围新生血管形成过程的影响目前尚无相关研究。本研究旨在探究不同形貌的纯钛表面对人脐静脉内皮细胞(human umbilical vein endo-thelial cell, HUVECs)生物行为的影响, 以初步阐明种植体骨结合的另一重要组成部分— — 血管新生过程与种植体表面形貌因素间的关系。
4种不同形貌纯钛表面按文献[6]方法制备, 根据其微观形貌分为:光滑结构表面组(Smooth-Ti, SM-Ti, )、纳米结构表面组(Nano-Ti)、微米结构表面组(Micro-Ti)以及微米/纳米复合结构表面组(Micro/nano-Ti)。
形貌确认:使用扫描电子显微镜(S 3000N, HITACHI公司, 日本)观察不同组间钛片的微观结构(参数:high voltage:15.0 kV, working distance:5.0 mm, Horizontal field width: 2.98), 以确认钛片表面不同尺度的形貌, 每组随机选取3片钛片(1 cm× 1 cm), 进行喷金120 s处理。
用于细胞学实验的钛片消毒方法:各组钛片分别用丙酮、无水乙醇和蒸馏水超声下清洗, 氮气吹干后用γ 射线消毒。
本研究使用的HUVECs购于美国ScienCell公司, 并使用该细胞专用培养基进行培养。先将原代细胞扩增后, 每2~3天换取新鲜培养液, 培养至密度达培养瓶面积80%~90%, 使用0.05%(体积分数)胰蛋白酶将细胞消化, 以1 ∶ 3的比例扩增子代, 培养条件为37 ℃、5%(体积分数)CO2培养箱, 选取第3至5代细胞进行实验操作。
扫描电子显微镜下观察细胞形貌:将钛片放置于48孔细胞培养板内, 选取第3代HUVECs, 以5× 104个/mL的密度接种于1 cm× 1 cm钛片上, 每孔加入1 mL细胞混悬液, 使其浸没过钛片, 放置于37 ℃、5%CO2培养箱内孵育24 h。细胞孵育至相应时间点后, 利用移液器吸取培养液, 弃去培养液, 以室温无菌PBS冲洗3次。洗去未附着细胞后, 加入4%(体积分数)多聚甲醛溶液浸没过钛片表面, 放置于4 ℃冰箱内固定1 h; 吸取固定液后废弃, 换入0.18 mmol/L蔗糖溶液, 浸没过钛片表面, 放置于4 ℃冰箱内1 h; 再次吸取蔗糖溶液后废弃, 室温下在梯度乙醇(30%, 50%, 75%, 90%, 100%)下脱水各10 min, 最后无水乙醇脱水2次, 各10 min; 在室温环境下自然阴干; CO2临界点干燥后喷金120 s处理, 于扫描电子显微镜下进行观察(参数同前)。
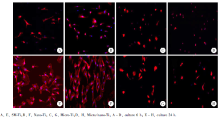
细胞骨架染色并观察:HUVECs接种至不同形貌表面钛片上6 h及24 h, 利用移液器吸取培养液, 弃去培养液, 以室温无菌磷酸盐缓冲溶液反复冲洗3次, 洗去未附着细胞后, 加入4%多聚甲醛溶液浸没过钛片表面, 放置于4 ℃冰箱内固定1 h; 吸取固定液后废弃, 以室温无菌PBS反复冲洗3次, 洗净固定液, 用罗丹明标记鬼笔环肽(TRITC-鬼笔环肽)(50 g/L, Sigma公司, 美国)避光染色45 min, 吸取染色液后废弃, 以室温PBS反复冲洗3次; 使用4, 6-二氨基-2-苯基吲哚(4, 6-diamidino-2-phenylindole dihydrochloride, DAPI, Sigma公司, 美国)进行细胞核避光染色10 min, 吸取染色液后废弃, 以室温磷酸盐缓冲溶液反复冲洗3次; 以80%(磷酸盐缓冲溶液稀释, 体积分数)丙三醇封片, 于激光共聚焦显微镜(CARL ZEISS, JENA公司, 德国)下观察, 每组随机选取5个视野进行定量细胞计数。
选取第3代HUVECs以2× 105个/mL密度接种于不同表面形貌钛片(直径:3 cm)上, 每孔加2 mL培养基。培养3 d后, 收集上清液, 按照血管内皮生长因子(vascular endothelial growth factor, VEGF)酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测试剂盒的操作说明进行上清液中VEGF浓度的检测。
本实验利用Ca2+免疫荧光探针检测于不同表面形貌培养24 h后的血管内皮细胞中Ca2+的表达情况, 在激光共聚焦显微镜下观察。将1 cm× 1 cm钛片放置于48孔细胞培养板内, 选取第4代HUVECs, 以5× 104个/mL之密度接种于钛片上, 每孔加入1 mL 细胞混悬液, 使其浸没过钛片, 放置于37 ℃、5%CO2培养箱内孵育12 h, 待时间点到, 按试剂盒(Fluo-3 AM, 碧云天生物技术研究所, 中国)操作, 避光染色, 充分洗脱染色液, 避免背景染色干扰, 于激光共聚焦显微镜(CARL ZEISS, JENA公司, 德国)下观察。
采用IBM SPSS 19.0软件对定量结果进行统计学分析, 定量数据均采用均数± 标准差表示。多组数据之间的比较采用单因素方差分析(One-way ANOVA), 并采用LSD法进行两两比较, P< 0.05为差异有统计学意义。
扫描电子显微镜下结果如图1所示, 光滑表面结构组电子显微镜下显示为镜面状表面形貌, 纳米结构表面组电子显微镜下显示为纳米级别的突起, 微米结构表面组电子显微镜下显示为微米级别的火山口样凹坑状结构, 微米/纳米复合结构组在电子显微镜下可见在凹坑状表面基础上增加纳米尺度突起, 组成多重复合粗糙尺度。
图2结果表明, HUVECs在不同形貌钛片上培养24 h后总体观察, 相对粗糙的钛基表面(微米结构表面组和微米/纳米复合结构组)与相对光滑的钛基表面(光滑表面结构组和纳米结构表面组)相比较, 在相对粗糙的钛基表面(微米结构表面组和微米/纳米复合结构组)HUVECs的形态完整性差, 细胞突触伸展范围局限, 细胞数量少; 各组间相比较, 微米与微米/纳米复合结构组相比, 微米/纳米复合结构组的细胞铺展范围比微米组的细胞铺展范围大; 纳米结构表面组与光滑结构表面组相比较, 纳米结构表面组的细胞铺展范围比光滑结构表面组的细胞铺展范围大。
通过比较6 h及24 h两个时间点在不同形貌钛片上的细胞数目可以发现(图3), 相对粗糙的钛基表面(微米结构表面组和微米/纳米复合结构组)细胞增殖的数量明显少于相对光滑的表面(光滑表面结构组和纳米结构表面组), 同时观察细胞核及细胞骨架, 发现在相对光滑的光滑表面结构组和纳米结构表面组, 细胞形态呈多角形排列且较相对粗糙的微米结构表面组和微米/纳米复合结构组显示出更为明显的细胞骨架结构。各组间相比较, 微米/纳米复合结构组与微米结构组相比, 两组间细胞核形态及细胞骨架排列没有明显差异; 纳米结构组与光滑组相比, 两组间细胞核形态及细胞骨架排列没有明显差异。在不同形貌纯钛表面孵育24 h后, 光滑表面结构组的细胞数目从(18± 4)个/视野增加到(42± 6)个/视野, 纳米结构表面组的细胞数目从(28± 6)个/视野增加到(52± 10)个/视野, 微米结构表面组的细胞数目从(20± 4)个/视野增加到(21± 6)个/视野, 微米/纳米复合结构组表面的细胞数目从(16± 4)个/视野增加到(18± 6)个/视野。微米结构表面和微米/纳米复合结构表面组黏附和增殖的细胞数目显著少于光滑表面组和纳米结构表面组(P< 0.05), 微米结构表面和微米/纳米复合结构表面组黏附和增殖的细胞数目间差异没有统计学意义, 光滑表面和纳米结构表面组黏附和增殖的细胞数目间差异没有统计学意义。结合扫描电子显微镜的结果可知, 微米结构表面对HUVECs的黏附和增殖影响大, 而纳米结构的表面形貌对HUVECs的铺展更加有利。
HUVECs在不同形貌钛表面VEGF分泌量分别为(690± 35) ng/L、(560± 20) ng/L、(474± 43) ng/L、(517± 29) ng/L。与光滑表面相比, HUVECs在纳米结构表面、微米结构表面和微米/纳米复合结构表面分泌的VEGF量显著减少(P< 0.05)。微米结构表面和微米/纳米复合结构表面孵育的HUVECs分泌的VEGF量也少于纳米结构表面HUVECs的VEGF的分泌量, 但该差异没有统计学意义。
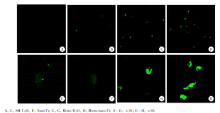
实验结果表明(图4), 相对粗糙的钛基表面(微米结构表面组和微米/纳米复合结构组)与相对光滑的钛基表面(光滑表面结构组和纳米结构表面组)相比, 前者的荧光表达量较高, 提示前者细胞内Ca2+内流增加; 微米/纳米复合结构组与微米结构表面组相比, 微米/纳米复合结构组孵育的细胞内表达荧光量较高; 纳米结构表面组与光滑表面结构组相比, 差异没有统计学意义, 上述研究结果提示微米级别表面形貌对HUVECs Ca2+内流的影响较为显著。
 | 图3 人脐静脉内皮细胞培养于不同形貌的钛基表面的激光共聚焦显微镜观察结果Figure 3 Morphology of human umbilical vein endothelial cell human umbilical vein endothelial cell on different Ti groups (confocal observation) |
本研究中涉及到的纯钛表面包括光滑表面、纳米结构表面、微米结构表面和微米/纳米复合结构表面, 代表了目前为止国内外研究中出现过的所有典型的纯钛表面类型(图1)。本文的研究结果显示, 这4种类型表面对血管内皮细胞的生物学行为分别有着不同的影响, 其中与光滑表面相比, 具有纳米结构的表面对HUVECs的黏附和铺展有一定的促进作用, 而具有微米结构以及微米/纳米复合结构的表面反而并不利于HUVECs的黏附和铺展, 对HUVECs的增殖行为也有一定的抑制作用(图2、3), 上述研究结果提示在特殊尺度范围下对血管内皮的生物学行为的调控是可以实现的。以往相关研究指出, 血管内皮细胞在10~100 nm表面结构下对其黏附及增殖等生物学效应有所提高[7], 本实验结果和其一致, 纳米表面可以在一定程度上改善血管内皮细胞的黏附和增殖行为。
VEGF作为血管生成因子起到促进血管新生的作用, 不同纯钛表面形貌对HUVECs分泌的VEGF的能力分别产生了不同的影响。与光滑表面相比较, 具有纳米结构的表面以及具有微米结构和微米/纳米复合结构的表面并不利于HUVECs分泌VEGF(图4), 上述研究结果提示粗化的纯钛表面对HUVECs的功能有所影响, 在单纯的微米结构表面, 这种影响最为明显, 而在微米/纳米复合结构表面, 纳米结构的存在可能会改善微米结构所引起的HUVECs功能抑制。
细胞内Ca2+作为重要的第二信使, 广泛参与细胞中的运动、分泌、代谢和分化等多种细胞生理功能活动的调节, 可以调节多种酶(包括磷酸酯酶和激酶)的活性, 并可维持细胞骨架的完整和稳定[8]。本研究中(图3), 在微米结构和微米/纳米复合结构表面HUVECs的形态发生了明显的改变, 推测可能与HUVECs胞内Ca2+含量的改变有关, 因此, 本研究进一步对HUVECs的细胞内钙的相对表达量进行了检测, 而实验结果也证实在微米结构和微米/纳米复合结构表面细胞内Ca2+荧光表达量高于光滑表面和纳米结构表面。正常情况下, 细胞内Ca2+浓度是细胞外的1/10 000左右, Ca2+的这种浓度分布对维持细胞的正常功能十分重要。如果细胞内游离Ca2+增多, 线粒体负荷过重, 氧化磷酸化过程及能量会发生障碍。另外, 目前认为细胞内线粒体钙离子稳态失衡所导致的线粒体功能损伤是内皮细胞损伤的主要机制之一[9, 10]。综上所述, 本研究中, 微米结构和微米/纳米复合结构表面可能对HUVECs的功能造成一定程度的应激损伤, 而这种影响可能与细胞内Ca2+内流增加相关。在相对光滑结构表面和纳米结构表面, 其形貌因素对HUVECs的功能影响较小, 因此在这两种表面, 不仅细胞的增殖有相对优势, 细胞骨架的形成也相对完整, 相应的, 细胞内Ca2+内流作为细胞损伤的指标, 其表达也相对较低, 这一现象也是对上述结论的佐证。
目前临床运用的钛基种植体表面多为微米级别形貌, 研究指出在此一级别的形貌对成骨作用有明显促进作用[11]。多个研究也显示微米/纳米复合结构表面有利于新骨形成[12, 13]。现有的部分国内外研究报道认为, 粗糙表面在促进成骨分化的同时, 也能改善内皮细胞的功能, 理想情况下, 促进成骨的同时又能促进成血管作用是最利于组织愈合过程的。本文的研究结果显示不同粗化程度的纯钛表面对内皮细胞的功能的影响是不一样的, 微米级别的纯钛表面反而对内皮细胞的功能有一定的抑制作用。另外, 体内成血管作用是一个非常复杂的过程, 可能需要构建更为合理的研究模型才能更真实反映体内情况。
本研究在于探究不同形貌的钛片表面对于HUVECs 功能的影响, 并对可能存在的机制进行研究, 结果显示形貌因素可以作为一种重要的调节因子, 参与对HUVECs黏附、增殖以及VEGF分泌等生物学行为的调节, 并且该调节行为可能与HUVECs胞内的Ca2+内流增加表达改变相关。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|