目的 构建可缓释骨形态发生蛋白-2(bone morphogenetic protein-2, BMP-2)的仿生磷酸钙(biomimetic calcium phosphate,BioCaP)共沉淀三维支架(BMP-2-coprecipitated biomimetic calcium phosphate,BMP-2-BioCaP),检测其理化特性,探究其对人脂肪间充质干细胞(human adipose-derived stem cells, hASCs)体内外成骨分化的影响,最终构建以hASCs和BMP-2-BioCaP为基础的新型组织工程化骨。方法 构建BMP-2-BioCaP三维缓释支架,扫描电子显微镜观察表面形貌,体外检测其缓释能力。将BMP-2-BioCaP颗粒分别浸泡于增殖培养基(proliferation medium, PM)与成骨诱导培养基(osteogenic medium,OM)中,每2天提取上清液用于hASCs的体外培养。CCK-8实验检测各组hASCs的体外增殖能力,诱导7 d及14 d后进行碱性磷酸酶(alkaline phosphatase, ALP)染色及活性定量检测,14 d及21 d进行茜素红染色及矿化沉积定量分析,4 d及14 d检测成骨相关基因的表达情况。体内实验使用6只裸鼠,于其背部正中做皮肤切口,向两侧共分离出4个皮下植入腔,分别植入:(1)单纯BioCaP支架,(2)BioCaP支架+hASCs,(3)BMP-2-BioCaP缓释支架,(4)BMP-2-BioCaP缓释支架+hASCs(实验组)。植入4周后取材,标本制成组织学切片进行HE染色观察。结果 BioCaP表面由不规则晶体组成三维立体多孔结构,孔直径约为5~10 μm,加入BMP-2后,不影响BioCaP原有的立体结构。缓释曲线结果显示,蛋白质在前2天释放速度较快,随后释放速度放缓并于5 d后趋于平稳,之后每天释放量较稳定,至第21天仍有少量释放,累积释放量达20%。CCK-8结果显示,BMP-2-BioCaP缓释支架不会影响hASCs的早期增殖。诱导7 d与14 d后,OM+BMP-2-BioCaP组ALP染色及活性定量检测均显著高于其他组( P<0.01)。诱导21 d后,OM+BMP-2-BioCaP组矿化结节染色及钙沉积定量检测均高于其他组( P<0.01)。诱导4 d时OM+BMP-2-BioCaP组的Runt相关转录因子2基因(Runt-related transcription factor 2, RUNX2)与 ALP基因表达水平较对照组显著升高( P<0.01),诱导14 d时 RUNX2、 ALP、骨桥蛋白(osteopontin, OPN)和骨钙素(osteocalcin, OC)基因表达量均显著高于其他组( P<0.01)。HE染色分析可见,实验组和BMP-2-BioCaP缓释支架组中,细胞外基质呈强嗜酸性,出现类似骨陷窝的结构,并可见包含其中的类骨细胞。与BMP-2-BioCaP缓释支架组相比,实验组的细胞外基质嗜酸性更强,类骨组织的面积更大,结构更加典型,其他组未见矿化基质和类骨组织形成。结论 BMP-2-BioCaP支架能够实现BMP-2的良好缓释,并能显著促进hASCs的体内外成骨分化,以hASCs和BMP-2-BioCaP为基础构建的新型组织工程化骨具有潜在的应用前景。
Objective: To construct a novel biomimetic calcium phosphate (BioCaP) scaffold loaded with bone morphogenetic protein-2 (BMP-2), and to investigate its role in the osteogenesis of human adipose-derived stem cells (hASCs) in vitro and in vivo.Methods: The BioCaP scaffold coprecipitated with BMP-2 (BMP-2-BioCaP) was constructed in this study. Field emission scanning electron microscopy (SEM) was used to analyze the morphology of the surfaces. The release kinetics was measured to evaluate the slow-release characteristics in vitro. BMP-2-BioCaP was immersed in proliferation medium (PM) or osteogenic medium (OM), respectively. The supernatants were collected and used to culture hASCs in vitro. Cell numbers were determined using the cell-counting kit-8 (CCK-8) to assess the cell proliferation. After 7 and 14 days, alkaline phosphatase (ALP) staining and quantification were performed to test the activity of ALP. After 14 and 21 days, the calcification deposition was determined by alizarin red S (ARS) staining and quantification. The expressions of the osteoblast-related genes were tested on day 4 and day 14. In the in vivo study, 6 nude mice were used and implanted subcutaneously into the back of the nude mice for 4 groups: (1) BioCaP scaffold only, (2) BioCaP scaffold+hASCs, (3) BMP-2-BioCaP scaffold, (4) BMP-2-BioCaP scaffold+hASCs (test group). After 4 weeks of implantation, hematoxylin-eosin (HE) staining was performed to evaluate the in vivo osteogenesis of hASCs.Results: SEM observations showed that BioCaP and BMP-2-BioCaP scaffold were entirely composed of straight, plate-like and sharp-edged crystal units, and the length of the crystal units varied between 5 and 10 μm. Release kinetics analysis demonstrated that BMP-2 incorporated with BioCaP could be released at certain concentration and last for more than 21 days, and the accumulative protein release could reach 20%. CCK-8 assays showed that cell proliferation was not significantly affected by BMP-2-BioCaP. ALP activity was higher by the induction of OM+BMP-2-BioCaP than of the other groups ( P<0.01). More mineralization deposition and more expressions of osteoblast-related genes such as Runt-related transcription factor 2 ( RUNX2), ALP, osteopontin ( OPN) and osteocalcin ( OC) were determined in the OM+BMP-2-BioCaP group at different time points ( P<0.01). HE staining showed that, in the test group and BMP-2-BioCaP scaffold group, the extracellular matrix (ECM) with eosinophilic staining were observed around hASCs, and newly-formed bone-like tissues could be found in ECM around the scaffold materials. Moreover, compared with the BMP-2-BioCaP scaffold group, more bone-like tissues could be observed in ECM with typical structure of bone tissue in the test groups. No obvious positive results were found in the other groups.Conclusion: BMP-2-BioCaP scaffold could achieve slow-release of BMP-2 and promote the osteogenic differentiation of hASCs in vitro and in vivo. The novel tissue-engineered bone composed of hASCs and BMP-2-BioCaPis promising for the repair of bone defect.
口腔颌面部的骨组织缺损是口腔科医师经常要面对的难题, 造成骨组织缺损的原因很多, 如先天发育异常、炎症、肿瘤、外伤等[1, 2]。目前治疗骨组织缺损的方法主要为自体骨移植、异体骨移植和异种移植[1, 3, 4], 但是在临床实际应用中, 由于自体骨的缺乏、异体骨移植导致的免疫排斥反应等各种因素, 使这些方法的应用受到了很大限制[5, 6], 骨组织工程技术的出现为解决这一难题提供了前景广阔的新选择。近年来, 骨组织工程技术已经成为骨再生领域的研究热点[7]。
经典的组织工程化骨系统由3个要素构成:有成骨潜能的种子细胞、成骨向诱导因子和三维支架材料[8]。人脂肪间充质干细胞(human adipose-derived stem cells, hASCs)具有来源广泛、供应量充足、采集简单、供区副作用小、患者易接受等优点[9, 10, 11], 是骨组织工程理想的种子细胞来源。本课题组之前的多项研究已经证实了hASCs具有良好的体内外成骨分化潜能, 是一种很有应用前景的种子细胞[10, 12, 13]。骨形态发生蛋白-2 (bone morphogenetic protein-2, BMP-2), 是一组属于转化生长因子β (transforming growth factor-beta, TGF-β )超家族的二聚体蛋白质[14]。体外和体内实验均已证实BMP-2在诱导异位成骨、修复骨缺损等方面具有非常显著的作用[15, 16]。本课题组的研究证实, BMP-2能够显著促进hASCs的体内外成骨分化[17], 但BMP-2的实际应用仍存在诸多问题, 如有效剂量高、潜在副作用大、临床应用成本高等[16, 18], 因此, 需要探索更加安全、高效的应用方式。
支架材料作为骨组织工程中的重要组成部分, 可以作为BMP-2等成骨诱导因子的良好载体, 为种子细胞的附着、增殖和成骨分化提供有利的微环境[8]。目前临床上广泛应用的支架材料为人工合成磷酸钙[19, 20, 21]。磷酸钙在化学组成上与天然骨骼相似, 来源广泛, 具有良好的生物相容性[22], 但临床使用的磷酸钙支架合成工艺复杂, 只有在高温下(> 600 ℃)烧结制取才能保证良好的机械强度以维持成骨空间, 同时, 大部分的磷酸钙支架材料只能实现BMP-2的表面吸附, 导致初期BMP-2大量释放, 末期BMP-2浓度不足, 影响最终的成骨效果, 为了弥补这一缺陷, 需配合使用更大剂量的BMP-2, 从而大大增加了应用成本。
仿生溶液(simulated body fluid, SBF)技术的应用有效地解决了上述问题。SBF技术实现了在近生理条件下制取磷酸钙, 该磷酸钙具有良好的机械力学强度和生物相容性, 便于临床操作, 维持骨缺损区成骨空间能力强[7]。本课题组之前的研究中, 首次利用SBF技术制备出一种新型三维仿生钙磷颗粒(biomimetic calcium phosphate, BioCaP)[23], 其最重要的特性是提供了一种新型的双重药物/蛋白质携带缓释系统, 蛋白质携带量大, 释放浓度稳定, 显著提高了所携带因子的骨诱导效能, 具有明显促进异位骨生成的作用, 但是, 这种缓释支架材料对于种子细胞生物学行为的影响, 尤其是细胞的体内外成骨分化的影响如何, 尚有待进一步研究。
针对以上问题, 本研究将探索构建具有BMP-2缓释能力的BioCaP三维支架(BMP-2-BioCaP), 检测其理化特性及缓释能力, 检测BMP-2-BioCaP缓释支架对hASCs体外成骨分化的作用, 并进一步评价BMP-2-BioCaP缓释支架与hASCs组成的新型组织工程化骨的体内成骨能力, 为其未来的临床应用提供实验数据和理论基础。
本实验采用的细胞均购自美国Sciencell公司, 3株来源于不同人的原代hASCs(P0), 货号7510, 传代培养至P2后冻存于液氮之中。
研究所用的试剂除特殊说明者均购自美国Sigma公司。DMEM培养基、胎牛血清(fetal bovine serum, FBS)、100× 细胞培养用抗生素购自美国Gibco公司, 细胞培养皿、滤器等耗材购自美国Corning公司, BMP-2购自英国Peprotech公司, RNA逆转录试剂盒(PrimeScriptTM RT Reagent Kit)购自日本TAKARA公司, BCA蛋白定量试剂盒(Pierce BCA protein assay kit)购自Thermo Scientific公司, RNA提取试剂(Trizol reagents)购自美国Invitrogen公司, 碱性磷酸酶(alkaline phosphatase, ALP)定量试剂盒与ALP染色试剂盒采购自北京康为世纪公司, RIPA裂解缓冲液购自北京普利莱公司, CCK-8试剂盒(cell counting kit-8, CCK-8)购自东仁化学科技(上海)有限公司, 牛血清白蛋白(bovine serum albumin, BSA)购自美国Amresco公司, Sybr green [FastStart Universal SYBR Green Master (ROX)]购自Roche公司, 裸鼠购自北京大学医学部实验动物科学部。
参照本课题组之前的研究成果[24], BioCaP的制作方法为:在无菌条件下, 配置磷酸钙(CaP)溶液(最终浓度为:200 mmol/L HCl、20 mmol/L CaCl2· 2H2O、680 mmol/L Na2HPO4), 使用TRIS将溶液pH值升高至7.3, 此时形成CaP悬浊液, 将此悬浊液在37 ℃水浴过夜, 形成CaP沉淀, 弃去上清液, 将沉淀置于50 mL离心管内, 经中性磷酸盐缓冲液(phosphate buffered saline, PBS)离心清洗8次。使用真空过滤器(0.22 μ m pore, Corning, NY, USA)抽真空压缩沉淀物, 自然风干, 研磨沉淀物, 将颗粒直径控制在0.25~0.50 mm之间, 形成BioCaP颗粒。BMP-2-BioCaP的制作方法是在制作BioCaP的基础上, 将BMP-2加入至CaP悬浊液中实现共沉淀, 余步骤与BioCaP制作方法相同, 每100 mg BMP-2-BioCaP颗粒中的BMP-2含量为1 μ g。
应用变色硅胶将制作好的BioCaP与BMP-2-BioCaP颗粒进行干燥, 待颗粒完全干燥后, 于扫描电子显微镜(FESEM, S-4800, HITACHI, Japan)下观察BioCaP与BMP-2-BioCaP颗粒的表面形态。
参照课题组以往的研究结果[23, 24], 应用BSA代替BMP-2, 制备载有等浓度BSA的BioCaP颗粒, 置于48孔板内, 加入500 μ L PBS, 以单纯BioCaP颗粒作为对照组。将孔板置于37 ℃恒温摇床中, 转速60 r/min, 分别于第1、2、3、5、9、14、21天提取上清液, 通过BCA蛋白定量试剂盒测定BSA浓度, 获得蛋白质缓释速度并绘制缓释曲线, 实验重复3次。
hASCs在增殖培养基(proliferation medium, PM)中, 置于含5%(体积分数)二氧化碳、95%(体积分数)氧气的37 ℃恒温培养箱中培养。增殖培养基的成分为DMEM+10%(质量分数)FBS+1%(质量分数)抗生素, 每2天更换1次培养基, 细胞生长至70%~80%融合状态后进行传代培养, 本实验使用的是P5代的hASCs。成骨诱导培养基(osteogenic medium, OM)成分为DMEM+10%(质量分数)FBS+1%(质量分数)抗生素+10 nmol/L地塞米松+10 mmol/L β -甘油磷酸钠+0.05 g/L维生素C。为模拟体内环境, 将BioCaP与BMP-2-BioCaP颗粒分别浸泡于PM与OM培养基中, 每2天提取培养基上清液, 更换hASCs培养基。实验分组为:(1)PM+BioCaP, (2)PM+BMP-2-BioCaP, (3)OM+BioCaP, (4)OM+BMP-2-BioCaP(实验组)。本研究观察并评价BMP-2-BioCaP对hASCs体外增殖和成骨分化的影响。
1.6.1 细胞增殖实验 hASCs以5× 103个/孔的密度接种于96孔板中, 在培养第1、2、4、5、6、7、9、12天, 依照CCK-8试剂盒说明书进行细胞增殖情况的测定[450 nm处光密度值(D)], 绘制各组的细胞增殖曲线, 实验重复3次。
1.6.2 ALP染色 hASCs以105个/孔的密度接种于6孔板中, 在培养至第7天与第14天时用95%(体积分数)乙醇溶液室温下固定10 min, 依照ALP染色试剂盒说明进行ALP染色, 实验重复3次。
1.6.3 ALP活性定量分析 hASCs以105个/孔的密度接种于6孔板中, 在培养至第7天与第14天时, 通过RIPA裂解液提取细胞总蛋白, 采用BCA蛋白定量试剂盒测定总蛋白含量, 采用ALP定量试剂盒定量检测ALP。用ALP定量结果除以总蛋白含量来代表ALP活性, 实验重复3次。
1.6.4 茜素红矿化结节染色及定量 hASCs以105个/孔的密度接种于6孔板中, 在培养第14天及第21天, 用95%乙醇溶液室温下固定细胞30 min, 加入0.5%(质量分数)茜素红染液(pH=4), 室温放置1 h, 蒸馏水冲洗3遍, 弃去冲洗蒸馏水, 进行大体及镜下染色情况拍照。加入100 nmol/L十六烷基吡啶溶解与钙螯合的茜素红染液, 室温放置1 h, 测定562 nm的光密度值(D), 实验重复3次。
1.6.5 实时荧光定量PCR检测成骨相关基因的表达 hASCs以105个/孔的密度接种于6孔板中, 在培养第4天与第14天时, 利用RNA提取试剂提取细胞总RNA, 逆转录合成cDNA, 实时荧光定量PCR检测成骨相关基因的表达, 相关引物序列见表1。数据分析采用Δ Δ Ct法, 以β -actin为内参照, 实验重复3次。
| 表1 实验中所用的引物序列 Table 1 The sequences of primers used in experiments |
本研究经北京大学生物医学伦理委员会审查批准(批准号:LA2014233)。细胞支架复合体的构建方法参照文献[14], 取BioCaP或BMP-2-BioCaP颗粒40 mg, 置于1.5 mL细胞冻存管中, 加入PM 1 mL对颗粒进行预湿润, 1 100 r/min离心5 min, 弃去上清液。将未经成骨诱导的hASCs制备成106个细胞/mL的细胞悬液, 每个冻存管中加入1 mL该悬液, 旋紧管盖, 水平放置于37 ℃恒温摇床中摇动1 h, 使细胞均匀吸附于支架材料上, 然后1 100 r/min离心5 min, 弃去上清液, 收集细胞支架复合体。无细胞的支架组置于1.5 mL细胞冻存管中, 加PM 1 mL, 其他操作同实验组。
手术操作在SPF级动物手术室中进行。取BALB/C nu/nu裸鼠6只, 1%(质量分数)戊巴比妥钠麻醉后, 消毒背部皮肤, 于背部中线处做一个20 mm切口, 分别向背部两侧各分离出2个皮下植入腔, 4个植入腔中分别植入:(1)单纯BioCaP支架, (2)BioCaP支架+hASCs, (3)BMP-2-BioCaP缓释支架, (4)BMP-2-BioCaP缓释支架+hASCs(实验组)。
于植入后第4周取材, 组织标本经过常规固定、脱钙、石蜡包埋, 制作成组织学切片, 进行HE染色分析。应用Image J(1.50i)对HE染色切片进行矿化组织半定量分析, 具体方法为:应用普通光学显微镜在高倍镜下(× 200)随机抽取5个不同视野, 应用Image J计算矿化组织面积占整个视野面积的百分率, 计算各组数据平均值及标准差。
采用SPSS 22.0统计软件进行统计分析。CCK-8测定、细胞ALP活性定量、矿化沉积定量、实时荧光定量PCR结果及矿化组织半定量分析均采用单因素方差分析(ANOVA), P< 0.05为差异有统计学意义。方差齐性时, 两两比较采用Bonferroni法, 组间数据方差不齐时, 两两比较采用秩和检验; 采用Bonferroni法调整校验水平, 调整后, P< 0.01为差异有统计学意义。
扫描电子显微镜结果显示, BioCaP支架表现为不规则晶体组成的三维立体多孔结构, 晶体直径约5~10 μ m(图1A、B)。加入BMP-2后, 表面形貌与BioCaP类似, 但晶体直径略有增大, 约5~15 μ m(图1C、D)。
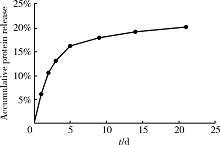
载有同等浓度BSA的BioCaP颗粒, 前2天的释放速度较快, 速度约为每天3%~4%, 随后BSA的释放速度放缓, 并于5 d后趋于平稳, 此时累积释放量约为16%, 之后每天的释放量较稳定, 约为每天0.25%, 至第21天仍有少量释放, 累积释放量达20%(图2)。
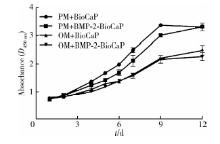
在培养第1、2、4、5、6、7、9、12天时, 获得各时间点的各组细胞增殖情况并绘制增殖曲线(图3)。PM组细胞增殖速度大于OM组, PM+BMP-2-BioCaP组的hASCs增殖速度小于PM+BioCaP组, 实验组与OM+BioCaP组间差异无统计学意义。
诱导7 d与14 d后, 实验组和OM+BioCaP组的ALP染色均呈阳性(图4), 且实验组在这两个时间点的ALP染色均最深, PM组未见阳性结果。
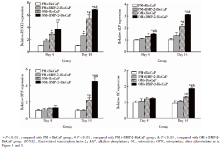
诱导7 d及14 d后, 实验组和OM+BioCaP组的ALP活性较高(图5), 显著高于PM组(P< 0.01), 实验组的ALP活性最高, 与其他3组差异有统计学意义(P< 0.01)。
由图6和图7可见, 诱导14 d和21 d后, 实验组和OM+BioCaP组的茜素红矿化染色均可见矿化结节的生成, 实验组在这两个时间点的茜素红染色均最深, PM组未见明显阳性结果。定量检测钙沉积量, 实验组和OM+BioCaP组显著高于PM组(P< 0.01), 诱导21 d时, 实验组的钙沉积量最高, 与其他3组的差异有统计学意义(P< 0.01)。
 | 图4 诱导第7天及第14天的碱性磷酸酶染色结果(× 40)Figure 4 Alkaline phosphatase staining of hASCs cultured with different media at day 7 and 14 (× 40) |
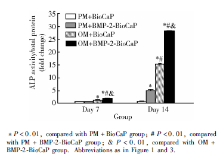 | 图5 诱导第7天和第14天的碱性磷酸酶定量检测结果Figure 5 Relative activities of alkaline phosphatase for hASCs cultured with different media at day 7 and 14 |
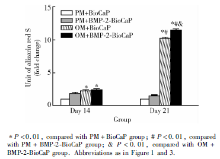 | 图6 诱导第14天和第21天的钙沉积定量结果Figure 6 Quantitative detection of calcification deposition of hASCs cultured with different media at day 14 and 21 |
诱导4 d后, 各成骨相关基因的PM组间差异无统计学意义(P< 0.01), 实验组的Runt相关转录因子2基因(Runt-related transcription factor 2, RUNX2)与ALP基因表达水平显著高于PM组(P< 0.01)。诱导14 d后, 各成骨相关基因的PM组间差异仍无统计学意义(P< 0.01), 实验组RUNX2、ALP、骨桥蛋白(osteopontin, OPN)和骨钙素(osteocalcin, OC)基因的表达均为最高, 与其他3组的差异有统计学意义(P< 0.01, 图8)。
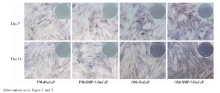
组织学切片HE染色后可见BioCaP支架经脱钙处理后大部分溶解, 细胞及新生组织围绕支架分布(图9)。
在实验组和BMP-2-BioCaP缓释支架组, 可见支架材料周围的细胞数量明显减少, 细胞外基质中出现了强嗜酸性的新生组织, 呈较为规则的板层状排列, 新生组织中出现类似骨陷窝的结构, 并可见包含其中的类骨细胞(图9)。与BMP-2-BioCaP缓释支架组相比, 实验组中细胞外基质嗜酸性更强, 类骨组织面积更大, 结构更加典型。矿化组织半定量分析结果中, 实验组的矿化比例最高, 且与其他3组的差异均有统计学意义(P< 0.01, 图10)。
在其他两对照组中, 可见细胞数量多, 排列紧密, 呈现出纤维结缔组织的组织学表现, 细胞外基质呈弱酸性, 无强嗜酸性的类骨组织形成(图9)。
BMP-2是目前广泛应用的最重要的成骨诱导生长因子之一, 能够显著促进hASCs的体外和体内成骨分化[17], 但是, BMP-2的促进成骨作用具有高度的浓度敏感性, 高剂量BMP-2会引起局部破骨细胞活跃[25], 低剂量BMP-2促进成骨的作用有限, 只有特定浓度范围内的BMP-2才能发挥良好的促进成骨作用[13], 因此, 要充分发挥BMP-2的促成骨作用, 寻找具有良好的药物可控缓释功能的载体便尤为重要。聚乳酸-羟基乙酸共聚物、羟基磷灰石等多种支架材料都被作为载体材料进行了尝试[26, 27], 但是都未能很好地实现BMP-2的高效加载和特定浓度下的长效缓释。
人工合成磷酸钙具有良好的生物相容性和骨引导性, 被作为骨替代物广泛用于临床[7]。近年来, 将人工合成磷酸钙与不同的生物活性成分相结合而构成的药物缓释系统成为新的研究热点[28]。本课题组之前的研究中, 首次制备出BioCaP颗粒并将BMP-2加载于BioCaP的表层和内部, 成功构建出BMP-2-BioCaP缓释体系, 并证实了该缓释体系能有效发挥BMP-2的骨诱导效能, 具有明显促进异位骨生成的作用[23]。在此基础上, 我们设想进一步将BMP-2-BioCaP与具有良好成骨向分化能力的hASCs相结合构建新型组织工程化骨, 使3组分之间发挥更高效的协同作用, 相互促进, 实现1+1+1> 3的效果。本研究即以此为目标进行了初步的体外和体内实验。
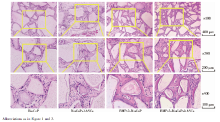 | 图9 BioCaP与BMP-2-BioCaP支架+hASCs植入裸鼠体内4周后的组织切片HE染色Figure 9 HE staining of BioCaP and BMP-2-BioCaP scaffold+hASCs at 4-week after in vivo implantation |
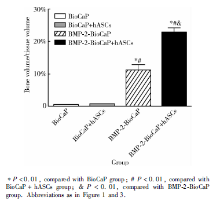 | 图10 BioCaP与BMP-2-BioCaP支架+hASCs植入裸鼠体内4周后的组织切片矿化组织半定量分析Figure 10 Semi-quantitative analysis of HE staining of BioCaP and BMP-2-BioCaP scaffold+hASCs at 4-week after in vivo implantation |
本研究参照课题组以往报道[24], 制作了BMP-2-BioCaP缓释颗粒, 并监测了其体外缓释能力, 结果与之前研究相似。通过CCK-8实验检测BMP-2-BioCaP对hASCs体外增殖的影响, 研究结果显示, hASCs的早期增殖并未受到显著影响, 形态学观察也未发现明显的细胞形态等生物学性质的改变, 而后通过对hASCs体外成骨分化过程中各个时间点的全面检测, 包括成骨分化早期指标RUNX2基因的表达, 成骨分化中期指标ALP基因、蛋白ALP及大体染色的情况, 成骨中晚期特异性指标OPN及OC基因的表达, 以及成骨晚期指标矿化物沉积的定性和定量分析等, 结果显示, 经过BMP-2-BioCaP的体外诱导, 各个时期的成骨分化指标均出现显著升高, 提示BMP-2-BioCaP能够有效促进hASCs的体外成骨分化。
HE染色显示, BMP-2-BioCaP与hASCs共同构建的组织工程化骨能够实现良好的异位成骨效果, 4周时即可见类似骨组织的生成。虽然单纯BMP-2-BioCaP组也可见有部分类骨组织的形成, 但是与之相比, 实验组的细胞外基质嗜酸性更强, 类骨组织面积更大, 矿化组织半定量分析中也显示, 实验组的矿化面占组织的面积最大, 与单纯BMP-2-BioCaP组相比差异有统计学意义。这提示hASCs在体内成骨过程中发挥了重要作用, 包括分泌大量细胞外基质、促进细胞外基质矿化和引导新生类骨组织形成等, 与以往文献报道类似[10]。
根据以往文献报道, 钙镁硅混合支架[29]、透明质酸支架材料[30]与聚乳酸-羟基乙酸共聚物[31]都被作为BMP-2的缓释载体进行了尝试, 但是仍然存在着诸多问题, 如BMP-2加载量过高, Dai等[29]在2011年所报道的钙镁硅混合支架中, 当每个支架材料上加载BMP-2达到20 μ g时, 才可以达到良好的异位成骨效果。而部分支架材料蛋白质加载效率虽高, 几乎可达到100%[7], 但由于生长因子只在表面吸附, 导致缓释时间不够持久。Bhakta等[30]在2013年所报道透明质酸支架中, 缓释第3天时, BMP-2累积缓释量已变达到60%, Qu等[31]报道聚乳酸-羟基乙酸共聚物支架单纯加载BMP-2后, 第3天的累积缓释量也达到50%, 这些问题限制了以上支架材料将来的临床转化应用。
本研究中构建的BioCaP三维支架弥补了上述缺陷, 通过仿生溶液法制作的双重缓释体系, 提高了蛋白质加载效率, 通过改善支架材料的构成比例, 蛋白质加载率可达到90%[32]。本实验也证实, 细胞支架复合体中的BMP-2含量仅为400 ng, 远远低于以往文献报道中BMP-2的应用浓度, 而且释放量稳定, 在至第21天仍有少量释放, 累积释放量达20%。本研究的结果显示, 该浓度下的BMP-2同样能够有效促进hASCs的体内外成骨分化, 这有赖于BMP-2与BioCaP结合牢固, 加载效率高, 缓释浓度稳定, 缓释过程时间长, 从而能够更好地发挥促进成骨作用。这种高效加载和缓释模式将有效避免高剂量应用BMP-2所带来的潜在副作用, 大大降低临床应用成本。
本研究还发现, 体外实验中BMP-2只有在OM中才能有效发挥其促成骨作用, 与课题组之前的报道相似[10], 同时, 本研究hASCs在植入体内前并没有经过体外成骨诱导, 缩短了体外培养时间, 降低了细胞污染和生物学行为变化等带来的风险, 最大程度上保证了细胞的活性, 更贴近临床实际应用。当然, 本研究仍存在局限性, 例如只参照以往的研究结果选取了单一的BMP-2加载浓度, 体内实验观察时间点相对单一等, 今后仍需更加深入的研究。此外, 进一步利用此创新性的具有双重药物加载缓释模式的BioCaP, 将其他药物或因子[如辛伐他汀(simvastatin, SIM)等]加载于BioCaP支架表面及内部, 研究其对hASCs成骨分化的作用, 也将成为本课题组下一步的研究重点。
综上所述, 通过对体外成骨分化过程中几个关键时间点的对比研究以及体内异位成骨的研究, 本研究发现BMP-2-BioCaP支架能够实现BMP-2的良好缓释, 并能显著促进hASCs的体内外成骨分化, 以hASCs和BMP-2-BioCaP为基础共同构建的新型组织工程化骨具有潜在的应用前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|