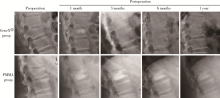
目的 回顾性分析骨质疏松椎体压缩骨折患者在行经皮椎体后凸成形术(percutaneous kyphoplasty, PKP)中使用聚甲基丙烯酸甲酯(polymethylmethacrylate, PMMA)与GeneX®骨水泥的治疗结果差异,为PKP手术椎体填充材料的选择提供参考。方法 回顾性分析2012年6月至2013年6月北京大学第三医院收治的89例骨质疏松椎体压缩骨折患者,于术后1个月、3个月、6个月、1年行问卷、X线片及CT检查随访,通过椎体高度恢复率、椎体Cobb角恢复率、计算机软件辅助CT数据分析、视觉模拟评分(visual analogue scale, VAS)减少情况、Oswestry评分以及并发症评估患者术后恢复情况。结果采用SPSS 18.0统计软件分析。结果 两组间椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率在术后3个月、6个月、1年差异有统计学意义( P<0.05),GeneX®组的椎体高度、Cobb角、椎体体积丢失多于PMMA组。PMMA组发生骨水泥渗漏者3例,邻近椎体再骨折1例,GeneX®组发生骨水泥渗漏2例,均无神经症状,均无致死性并发症。结论 GeneX®骨水泥对于患者术后疼痛的缓解效果与PMMA相当,作为椎体成形材料近期维持椎体高度良好,可以迅速提高椎体的强度和刚度,且其并发症少,但术后中、远期对椎体高度的维持并不十分满意,故骨质疏松压缩骨折患者可使用GeneX®骨水泥作为椎体填充材料,而对于术前椎体压缩程度重且伴有严重骨质疏松患者,可使用PMMA骨水泥作为椎体填充材料,并应避免术后早期负重,更佳的生物可替代材料仍然需要进一步寻找和研究。
Objective: To analyze the outcomes of patients with osteoporotic vertebral compression fractures treated with polymethylmethacrylate (PMMA) and GeneX® bone cement in percutaneous kyphoplasty and to provide guidance in selecting the vertebral filling material for this procedure.Methods: In this study, 86 patients with osteoporotic vertebral compression fractures treated at Peking University Third Hospital between June 2012 and June 2013 were retrospectively analyzed. The patients were followed-up with questionnaires and X-ray and CT examinations after 1 month, 3 months, 6 months, and 1 year. Postoperative conditions, including recovery rate of vertebral height, recovery rate of vertebral Cobb angle, CT data, reductions in visual analogue scale (VAS) and Oswestry scores, and postoperative complications, were evaluated. The results were analyzed using SPSS 18.0.Results: According to the rank sum test, there were significant differences in the recovery rate of vertebral height, vertebral Cobb angle and vertebral volume between the two groups after 3 months, 6 months, and 1 year ( P<0.05). The GeneX® group had greater losses in vertebral height, Cobb angle and volume than did the PMMA group. The PMMA group had 3 cases of cement leakage and 1 case of an adjacent vertebral fracture after percutaneous kyphoplasty. The GeneX® group had 2 cases of cement leakage.Conclusion: GeneX® bone cement is similar to PMMA in terms of postoperative pain relief. As the filling material in percuta-neous kyphoplasty, it is effective at maintaining vertebral height, quickly improves strength and stiffness of the vertebral body and has fewer complications. However, it is not satisfactory in maintaining long-term postoperative vertebral height. GeneX® bone cement can be used as the filling material for patients with osteoporotic vertebral compression fractures in percutaneous kyphoplasty. Patients with severe osteoporosis and vertebral compression should be treated with standardized osteoporosis treatment and should try to avoid early postoperative walking exercises. Sustained vertebral filling materials, such as PMMA, are more suitable for such patients. Research into better biodegradable materials is still needed.
随着社会老龄人口的增加, 骨质疏松症患者逐年增多。骨质疏松导致椎体力学强度降低, 易发生椎体压缩骨折, 对患者健康危害很大。经皮椎体后凸成形术(percutaneous kyphoplasty, PKP)通过球囊扩张恢复椎体高度, 向压缩椎体注入骨水泥使椎体复位, 矫正脊柱后凸畸形, 该技术为骨质疏松性椎体压缩骨折的治疗提供了全新的选择, 并获得了较好的临床效果[1]。
目前临床常用的骨水泥为聚甲基丙烯酸甲酯(polymethylmethacrylate, PMMA), 其具有良好的可塑性和椎体成形能力, 但这类骨水泥材料在聚合过程中易产热, 并有可能分解产生具有毒性的甲基丙烯酸酯(methylmethacrylate)单体, 且此类骨水泥的生物学相容性较差。鉴于PMMA有着诸多局限性, 寻找理想的椎体填充材料一直是研究的热点, 一些研究者开始应用可吸收骨水泥替代PMMA材料。
在能被生物体吸收并参与到骨质代谢的可吸收材料中, 可注射型磷酸钙(calcium phosphate cement, CPC)和硫酸钙(calcium sulfate cement, CSC)应用较早[2, 3], 但由于CSC或CPC骨水泥脆性较大、抗压能力不足, 一般只能用于非负重区骨的修复, 限制了其临床应用的范围。
GeneX® 可注射人工骨是一种新型椎体填充材料, 其主要成分是磷酸钙和硫酸钙, 经过特殊极化处理后有一定吸附聚集分子、蛋白质的作用, 可诱导骨形成, 北京大学第三医院已开始应用GeneX® 骨水泥治疗骨质疏松性椎体压缩骨折。本课题组通过与中国科学院自动化研究所合作, 利用计算机辅助分析CT技术, 精确地反映术后椎体中骨水泥的形态、体积及椎体体积的变化, 回顾性分析PMMA与GeneX® 骨水泥应用于PKP手术治疗骨质疏松性椎体压缩骨折患者的治疗结果差异, 旨在解答以下几个问题:(1)可吸收骨水泥因为较少热效应, 手术后局部的止痛效果如何; (2)可吸收骨水泥因为要逐渐被吸收, 在此过程中椎体高度丢失情况如何; 与PMMA相比, 是否会存在较多的丢失; (3)在可吸收骨水泥的吸收过程中, 新骨是否会形成及其形成机制如何; (4)在并发症方面, 两者之间是否存在差异。
回顾性分析2012年6月至2013年6月北京大学第三医院收治的89例骨质疏松性椎体压缩骨折患者的临床资料。
设定纳入标准:(1)T7~L5单节段骨质疏松椎体压缩骨折, (2)胸、腰部存在由于椎体压缩骨折引起的中、重度疼痛, (3)骨密度T值≤ -2.5个标准差(stander deviation, SD)。排除标准:(1)病理性椎体骨折, (2)合并神经损伤症状。
89例患者中共有86例患者符合纳入标准, 其中男性28例, 女性58例, 年龄46~88岁, 平均67.1岁。AO骨折分型均为A1型, 46例使用PMMA骨水泥治疗归入PMMA组, 40例使用GeneX® 骨水泥治疗归入GeneX® 组。86例骨质疏松性椎体压缩骨折患者中, 79例获得1年以上随访。
据两组患者的基线数据显示, 两组在性别、年龄、病程、视觉模拟评分(visual analogue scale, VAS)、Oswestry评分、椎体压缩率、椎体体积、椎体Cobb角、骨水泥灌注量等方面差异无统计学意义(表1)。
| 表1 PMMA组与GeneX® 组患者基线数据 Table 1 Baseline data of the PMMA and GeneX® groups |
所有手术由同一手术医师操作完成, 记录骨水泥的扩张压力及注入体积。使用可扩张通道微创系统为美敦力-枢法模· 丹历(Medtronic Sofamor Danek)产品, PMMA骨水泥为意大利Tecres SPA公司产品, GeneX® 为英国百赛公司可注射人工骨。
随访方式:患者来院行问卷调查并收集影像学资料。
随访内容:(1)基本信息:性别、年龄、病程; (2)术前:VAS评分、Oswestry评分、椎体压缩率、椎体体积、椎体Cobb角; (3)术中:骨水泥种类、灌注量; (4)术后1个月、3个月、6个月、1年:VAS评分、Oswestry评分、椎体高度恢复率、椎体体积恢复率、椎体Cobb角恢复率; (5)其他:并发症。
在脊柱侧位X线片中测量伤椎的高度和Cobb角, 其中伤椎椎体前缘和后缘的高度取两者的平均值作为椎体的平均高度。本课题组与中国科学院自动化研究所合作, 其“ 模式识别国家重点实验室” 提供软件支持, 椎体体积与骨水泥体积通过计算机软件分析CT数据得出。软件的基本工作思路为:对
图片的目标区域二值化后进行连通域检测, 并比较所有连通域的面积, 将其中面积最大者(即椎体)的轮廓标记出来, 其面积即为椎体面积, 对这一轮廓包含的区域进行腐蚀, 即得到去除了骨骼边缘的图像, 对此图像再次进行连通域检测, 得到椎体内部所有发亮部分, 即骨水泥区域, 其面积即为骨水泥面积。通过近似微积分, 每两帧之间分割为100份, 按柱体计算体积得出椎体体积与骨水泥体积(图1)。具体计算公式为:设第一帧面积为S1, 第二帧面积为S2, S1< S2, 厚度为depth,
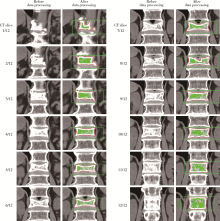 | 图1 在CT序列中, 红色描记椎体边缘, 绿色描记骨水泥区域, 得出相应面积Figure 1 In the CT sequence, red outlines and marks the vertebral edge, and green outlines and marks the cement area |
结合常用的评估方法[4, 5], 本课题组使用了以下方法:椎体压缩率=术前椎体高度/估算的原椎体高度(估算的原椎体高度为病椎相邻上、下椎体高度的平均值)。椎体高度恢复率=(术后椎体高度-术前椎体高度)/(估算的原椎体高度-术前椎体高度)。最终通过椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率、VAS减少情况、Oswestry评分以及并发症评估患者术后恢复情况。
采用SPSS 18.0统计软件进行统计学处理与分析, 计量资料(如年龄、病程、功能评分)采用秩和检验, 计数资料(如性别)采用卡方检验。比较PMMA组与GeneX® 组在患者年龄、性别、病程、VAS评分、Oswestry评分、椎体压缩率、椎体体积、椎体Cobb角、骨水泥灌注量、以及术后1、3、6、12个月的椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率、VAS减少情况、Oswestry评分减少情况是否存在差异, P< 0.05为差异有统计学意义。
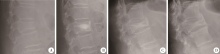
Mann-Whitney U非参数检验显示(表2):PMMA组与GeneX® 组相比, VAS评分减少与Oswestry评分减少在术后1个月、3个月、6个月、1年的差异均无统计学意义(P> 0.05), 椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率在术后1个月的差异无统计学意义(P> 0.05), 而在术后3个月、6个月、1年的差异有统计学意义(P< 0.05), GeneX® 组的椎体高度、Cobb角、椎体体积丢失明显多于PMMA组。PMMA组患者发生骨水泥渗漏者3例, 邻近椎体再骨折1例, GeneX® 组发生骨水泥渗漏2例, 均无神经症状, 均无致死性并发症(图2)。
| 表2 PMMA组与GeneX® 组术后效果评价 Table 2 Postoperative evaluation of the PMMA and GeneX® groups |
本研究中使用的新型骨水泥为GeneX® 可注射人工骨, 其主要成分是磷酸钙和硫酸钙的混合物, 最初的设计目的即为将两种材料的优缺点进行互补, 使之为椎体提供稳固支撑的同时, 能在合适的时间被机体吸收并被正常骨取代。本研究选取GeneX® 骨水泥与PMMA骨水泥进行回顾性分析, 以探寻GeneX® 骨水泥是否为PKP手术中更好的椎体填充材料。
骨质疏松性椎体压缩骨折的疼痛来源主要是局部的机械力学不稳定和化学刺激, 而PKP具有明确的镇痛效果, 考虑其止痛机制主要为:注入的椎体填充材料即刻加强了椎体的强度, 帮助椎体承担部分轴向应力, 减少对神经的刺激及压迫, 随着椎体填充材料固化完成, 伤椎可即刻恢复其力学功能, 改善了脊柱局部的稳定性, 减少了伤椎骨折产生的微动摩擦[6, 7], 起到止痛的效果。同时, PMMA骨水泥在聚合时释放出大量的热量可使周围组织变性坏死, 伤椎周围组织内的感觉神经末梢不同程度的破坏使患者对疼痛的敏感性降低或者消失, 起到止痛的效果[8]。再者, PMMA骨水泥单体具有化学毒性, 可对周围组织的感觉神经末梢造成一定损害, 达到止痛效果[9]。
本研究中, PMMA组与GeneX® 组相比, VAS评分减少值在术后1个月、3个月、6个月和1年的差异均无统计学意义(P> 0.05), 说明GeneX® 骨水泥同PMMA类似, 能够术后即刻强化压缩性骨折椎体[10], 并且这种强化效果能在体内长期持续, 维持椎体局部的机械稳定, 从而减轻疼痛, 故本研究认为GeneX® 骨水泥在相对安全的同时也有良好的疼痛缓解效果。需要特别注意的是, 本研究的数据显示, 术后早期两组患者的疼痛缓解程度没有明显差异, 且VAS评分减少分别达到了6.1± 1.6(PMMA组)和5.8± 1.9(GeneX® 组), 两组均有明显的止痛效果, 虽然GeneX® 骨水泥无聚合产热特性以及化学毒性, 但止痛效果仍然与PMMA类似, 说明骨水泥提供的单纯机械力学稳定足以解决患者的疼痛问题, 这也为我们寻找新的替代材料提供了基础, 新的替代材料能否达到椎体局部机械力学稳定是缓解椎体压缩骨折疼痛的重要因素。
与疼痛的缓解类似, 能否维持椎体的高度也是评估术后效果的重要指标。Niu等[11]在应用硫酸钙治疗腰椎退变性疾病的患者时, 骨融合效果明显弱于自体髂骨和自体椎板减压骨, 硫酸钙降解吸收速度过快、对骨骼的支撑作用过早消失可能是导致骨融合失败的原因。有研究选取磷酸钙与硫酸钙混合帮助改善硫酸钙骨水泥降解速率的问题[12, 13], 经研究证实, 混入磷酸钙对硫酸钙的酸碱度、固化时间、温度影响较小, 而随着硫酸钙比例的升高, 混合物的抗压强度下降, 降解速率上升[14]。那么, 使用GeneX® 骨水泥的患者术后是否出现注入材料降解过快、椎体强度下降、高度再丢失是我们仍然需要关注的问题。
在本组的回顾性分析中, PMMA组与GeneX® 组患者术后1个月在椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率的差异无统计学意义(P> 0.05), 故在术后短期内, GeneX® 骨水泥可达到与PMMA相当的椎体恢复程度。但在术后3个月、6个月、1年, 椎体高度恢复率、椎体Cobb角恢复率、椎体体积恢复率两组的差异有统计学意义(P< 0.05), GeneX® 组中的部分患者在术后1~3个月出现骨水泥吸收、椎体的再塌陷(图3)。分析其原因, GeneX® 可注射人工骨在设计之初的目的即为保持硫酸钙诱导骨形成作用的同时延长其在体内吸收降解的时间, 以匹配新骨的再生, 但老年骨质疏松患者, 尤其是绝经后女性, 正常的骨吸收和骨形成之间的平衡已被破坏, 骨形成远落后于前者, 而且骨质疏松症具有已形成的骨质疏松结构不可逆转、经过正规治疗也不可能完全恢复的疾病特点, 因此对于严重骨质疏松患者, 术后早期虽恢复了椎体高度, 但在下地活动椎体承重且骨水泥吸收椎体逐渐失去支撑后, 由于骨再生能力较弱, 不可避免地出现了椎体高度的再丢失, 尤其对于术前椎体压缩严重的患者, 椎体的塌陷更加明显。故对于术前椎体压缩程度重且有严重骨质疏松患者, 应配合规范的骨质疏松治疗并尽量避免术后早期下地负重, 支撑作用更加持久的椎体填充材料更适用于此类患者。
GeneX® 骨水泥在术后初期对压缩骨折椎体强化的机制与PMMA相同, 主要为材料填充作用, 注入的骨水泥填充骨缺损区域后即刻凝固并与松质骨相互接触融合, 帮助传递和承载施加在骨折椎体上的应力。临床实验结果证实, 磷酸钙与硫酸钙的复合骨填充材料能够明显促进新骨形成[15], 同时也有研究发现, 磷酸钙和硫酸钙的复合材料物理性能优良, 在人体内固化时间和降解速度满意, 并有促进成骨作用, 能够有效促进骨折缺损区新骨形成, 增加新生骨量[16], 所以在术后中期, 随着材料降解、新骨形成, GeneX® 骨水泥不仅起到填充椎体骨缺损的作用, 同时会促进成骨, 并与周围骨小梁形成骨性结合, 因而可以进一步增强椎体的力学性能。与PMMA相比, GeneX® 骨水泥在体内通过不同的机制强化骨质疏松椎体, 强度是逐渐增加的, 而PMMA则无此性能。
本回顾性研究也发现, 术后6个月时的CT图像提示, 使用GeneX® 骨水泥作为填充材料的部分患者骨小梁结构与骨质疏松椎体的骨小梁有明显差别, 更加优化、致密(图4A、B), GeneX® 骨水泥在诱导新骨形成方面具有优势; 而PMMA组仅可见不吸收的PMMA骨水泥, 部分患者甚至较术前骨质疏松程度增加, 主要表现为骨小梁数量减少、厚度变薄、空隙增大、结构欠佳。不可降解的硬质固体结构, 与骨质自身的代谢重建相矛盾, 异物反应的存在, 使骨水泥与骨界面的骨质结构被吸收从而导致骨强度降低, 甚至出现明显骨缺损区域(图4C~E)。
PKP手术的并发症主要有骨水泥渗漏、相邻椎体骨折、肺动脉栓塞以及其他, 其中最常见的并发症为骨水泥渗漏, 达到8.4%~10.0%[17, 18, 19]。
本研究中PMMA组发生骨水泥渗漏3例, GeneX® 组发生骨水泥渗漏2例, 均未引起神经症状, 本研究的骨水泥渗漏率(5.8%)低于报道水平, 均无神经症状, 均无致死性并发症, 分析其原因, 首先, 骨水泥渗漏的发生可能与骨折压缩程度较重(压缩程度达到2/3)、球囊撑开后形成裂隙有关, 研究共识认为压缩椎体存在裂隙或椎体后壁不完整是骨水泥发生渗漏的重要原因; 其次, GeneX® 骨水泥具有可吸收特性, 无聚合产热特性及化学毒性, 故少量渗漏不易造成神经损害。
相邻椎体骨折也是PKP手术相关并发症之一, 但发生原因目前尚无定论。有报道认为骨折与椎体刚度和强度的增强有关[20], 但骨折并不都发生于相邻椎体, 故也存在相反意见[21], 而患者术后是否使用了恰当的康复指导及抗骨质疏松治疗被认为也与再骨折的发生有关[22, 23]。本研究中PMMA组出现邻近椎体再骨折1例, GeneX® 组未出现, GeneX® 组的邻椎骨折发生率相对更低, 考虑可能与PMMA骨水泥比GeneX® 硬度大、不易降解有关。强度过大的椎体导致临近椎体局部生物力学改变, 承受了更多的应力, 致相邻椎体骨折。
本研究也有一定的局限性, 首先为回顾性研究, 缺乏随机对照试验的证据支持; 椎体填充材料的选择可能带有医生和患者的主观因素, 而不是随机选择; 样本量还不够大, 且是单中心研究; 病例随访有几例失访, 可能会对随访结果造成影响。
综上所述, PKP是治疗骨质疏松性椎体压缩骨折有效的手段。GeneX® 骨水泥在术后疼痛缓解方面与PMMA相当, 作为椎体成形材料近期维持椎体高度作用良好, 且并发症少, 具有促进生物成骨作用, 远期可达到生物性强化椎体的作用, 但与PMMA相比术后中、远期(3个月、6个月、1年)维持椎体高度方面并不十分满意, 部分患者出现了椎体高度丢失, 故骨质疏松性椎体压缩骨折患者可使用GeneX® 骨水泥作为椎体填充材料, 而对于术前椎体压缩程度重且伴有严重骨质疏松患者, 可使用PMMA骨水泥作为椎体填充材料, 并应避免术后早期负重, 更佳的生物可替代材料仍然需要进一步寻找和研究。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|