目的 探讨靶向 B7-H3基因沉默对人恶性血液病细胞株在裸鼠体内成瘤和转移的影响及机制。方法 应用实时荧光定量PCR(real-time quantitative polymerase chain reaction,qPCR)和流式细胞术(flow cytometry,FCM)检测13株恶性血液病细胞中B7-H3分子的表达水平,筛选高表达的U937、Maver和Z138细胞。分别利用慢病毒转染技术靶向敲减 B7-H3,建立稳定低表达细胞株,应用qPCR和FCM验证基因沉默效果。将U937、Maver和Z138各自分为空白对照组(non-infected control group,CON)、靶向 B7-H3敲减组( B7-H3 knockdown group,KD)和阴性无关序列对照组(negative nontargeted control infected group,NC),将以上9组分别构建裸鼠皮下移植瘤模型,比较肿瘤生长和转移情况,免疫组织化学(immunohistochemistry,IHC)染色检测Ki-67表达,蛋白质免疫印迹法(Western blot)检测基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)水平。结果 筛选B7-H3分子高表达的U937、Maver和Z138细胞进行靶向敲减 B7-H3,成功建立稳定低表达细胞株。U937、Maver和Z138细胞各自的KD组与NC组比较,观察终点的平均肿瘤生长抑制率分别为61.83%( F=43.78, P<0.05)、59.12%( F=36.51, P<0.05)和67.37%( F=40.29, P<0.05),而各自NC组与CON组相比,肿瘤体积增长趋势差异无统计学意义( P>0.05)。在所有移植瘤裸鼠模型中肝转移最常见,KD组裸鼠的远处转移较相应NC组明显降低。3种细胞各自KD组的Ki-67指数均较相应NC组显著下降(U937移植瘤:40.3%±5.2% vs. 79.1%±6.3%, q=30.31, P<0.05;Maver移植瘤:35.2%±6.4% vs. 69.6%±5.1%, q=24.82, P<0.05;Z138移植瘤:38.4%±7.1% vs. 75.7%±4.8%, q=28.07, P<0.05), 而NC组与CON组Ki-67表达差异无统计学意义( P>0.05)。3种细胞各自KD组肿瘤组织的MMP-2蛋白表达显著降低(U937移植瘤: q=14.59, P<0.05;Maver移植瘤: q=9.25, P<0.05;Z138移植瘤: q=11.04, P<0.05), NC组与CON组MMP-2表达差异无统计学意义( P>0.05)。结论 靶向 B7-H3基因沉默能够抑制人恶性血液病细胞在裸鼠体内的成瘤和转移能力,其机制可能与Ki-67和MMP-2的表达下调有关。
Objective: To investigate the effect and mechanism of targeted B7-H3 gene silencing on the tumorigenesis and metastasis of human hematological malignancy xenograft tumor in nude mice.Methods: Real-time fluorogentic quantitative PCR (qPCR) and flow cytometry (FCM) were used to detect the expression of B7-H3 in 13 strains of malignant hematologic cells. Then, U937, Maver and Z138 cells which expressed high level of B7-H3 were screened out. Targeted B7-H3 knockdown in U937, Ma-ver and Z138 was performed by lentivirus transduction and the effect of B7-H3 silencing in stable cell lines was tested by qPCR and FCM. Injecting the nine groups subcutaneously into the nude mice to establish xenograft models after dividing the U937, Maver and Z138 into non-infected control group (CON), B7-H3 knockdown group (KD) and negative non-targeted control infected group (NC),respectively, for detecting the tumorigenicity and metastasis in vivo. Furthermore, the expression of Ki-67 in xenograft tumors was detected by immunohistochemistry (IHC). The expression of metalloproteinase 2 (MMP-2) was detected by western blot.Results: The stable B7-H3 silencing cell lines of U937, Maver and Z138 were successfully established. Compared with the NC group, the KD groups of U937, Maver and Z138 had an obviously slower tumor growth. The average tumor inhibition rates at the end of observation period were 61.83% ( F=43.78, P<0.05), 59.12% ( F=36.51, P<0.05) and 67.37% ( F=40.29, P<0.05); there was no significant difference in tumor volume growth between the NC group and the CON group ( P>0.05). The liver distant metastasis of all the xenograft tumor models in nude mice was the most common and the rates of distant metastasis in KD groups were significantly lower than that of the corresponding NC groups. The Ki-67 indexes of the KD groups were significantly lower than those of the relative NC groups in three cell lines (U937: 40.3%±5.2% vs. 79.1%±6.3%, q=30.31, P<0.05, Maver: 35.2%±6.4% vs. 69.6%±5.1%, q=24.82, P<0.05; Z138: 38.4%±7.1% vs. 75.7%±4.8%, q=28.07, P<0.05); there was no significant difference in the expression of Ki-67 between the NC group and the CON group ( P>0.05). The expressions of MMP-2 were also significantly lower in the KD groups than in the NC groups (U937: q=14.59, P<0.05; Maver: q=9.25, P<0.05; Z138: q=11.04, P<0.05); there was no significant difference in the expression of MMP-2 between the NC group and the CON group ( P>0.05).Conclusion: Targeted B7-H3 gene silencing could inhibit the tumorigenesis and metastasis of human hematological malignancy xenograft tumor in nude mice. The mechanism may be related to the down-regulation of Ki-67 and MMP-2.
恶性血液病主要包括各类白血病、多发性骨髓瘤以及恶性淋巴瘤, 其总发病率居于恶性肿瘤的前十位, 并呈现城市高于农村、患者年轻化且逐年增长的趋势[1]。目前, 恶性血液病的治疗包括化学药物治疗(简称化疗)、放射治疗(简称放疗)、造血干细胞移植和免疫治疗等, 以化疗为主的综合疗法应用虽延长了部分患者的生存, 但由于疾病进展快、原发耐药和缓解后复发情况多见, 患者的长期生存仍不理想。近年来, 肿瘤免疫疗法取得了重大进展, 以程序性死亡受体1(programmed death 1, PD-1)和程序性死亡受体-配体1(programmed death-ligand 1, PD-L1)单抗为代表的一批靶向B7家族分子的新药在黑色素瘤、肾癌、肺癌和淋巴瘤的治疗方面显示出卓越的疗效[2], 成为研究的热点。
机体的抗肿瘤免疫主要由T细胞介导, 其中B7家族分子参与的第二信号(即协同刺激信号)起了关键作用。目前已发现了B7家族的10个分子[3], 而B7-H3作为2001年发现的新成员, 具有免疫调节和非免疫调节的双重作用, 既调节机体免疫细胞的正常功能, 又影响肿瘤细胞自身的增殖、凋亡、侵袭、耐药等生物学特性[4, 5], 越来越多的研究发现在包括恶性血液病在内的多种人类肿瘤组织中存在B7-H3的异常高表达, 并提示与肿瘤转移和不良临床预后密切相关[6, 7], 被认为是新的肿瘤标志物和潜在的治疗靶点。然而, B7-H3分子参与恶性血液病的肿瘤形成和转移及相关机制尚未明确, 相关体内研究甚少。
本研究通过检测13株恶性血液病细胞中B7-H3的表达, 筛选出高表达的急性单核细胞白血病U937细胞和套细胞淋巴瘤Maver、Z138细胞; 利用慢病毒转染技术进行靶向B7-H3敲减, 将稳定低表达细胞株注入裸鼠皮下构建移植瘤模型, 观察3种血液肿瘤细胞在裸鼠体内成瘤和转移能力的变化, 探讨B7-H3分子在恶性血液病肿瘤形成和转移中的作用及初步机制, 为恶性血液病的治疗提供新思路。
洛斯维· 帕克纪念研究所-1640培养基(Roswell Park memorial institute-1640, RPMI-1640)、Iscove氏改良的Dulbecco氏培养基(Iscove’ s modified Dulbecco medium, IMDM)购自美国Gibco公司, 胎牛血清购自美国HyClone公司。含靶向B7-H3 shRNA质粒由本课题组前期实验构建并留存[8]。脂质体转染试剂Lipofectamine 2000购自美国Invitrogen公司。RNA提取剂TRIzol购自美国Invitrogen公司, 逆转录试剂盒购自美国Thermo公司, 引物均由美国Invitrogen公司负责合成, SuperReal荧光定量预混试剂增强版购自北京天根生化科技有限公司。别藻蓝蛋白(allophycocyanin, APC)标记的B7-H3 单克隆抗体购自美国eBioscience公司, APC标记同型对照抗体购自美国BD公司。兔抗人Ki-67多克隆抗体、山羊抗兔二抗、免疫组织化学染色试剂盒二氨基联苯胺(diaminobenzidine, DAB)显色剂购自丹麦Dako公司。放射性免疫沉淀分析(radio immunoprecipitation assay, RIPA)裂解液购自北京康为世纪生物科技有限公司, 二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)凝胶配制试剂盒购自北京普利莱基因技术有限公司, 兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)单克隆抗体和兔抗人基质金属蛋白酶2(matrix me-talloproteinase 2, MMP-2)单克隆抗购自英国Abcam公司, IRDye 800CW共轭山羊抗兔二抗购自美国LI-COR公司。
人Burkitt淋巴瘤细胞株Raji和CA46、人套细胞淋巴瘤细胞株Maver和Z138、人T淋巴母细胞白血病/淋巴瘤细胞株Jurkat、Jurkat E6-1和Molt-4、人皮肤T细胞淋巴瘤细胞株Hut-78、人NK/T细胞淋巴瘤细胞株YTS、人慢性粒细胞白血病细胞株K562、人急性早幼粒细胞白血病细胞株HL-60、人急性单核细胞白血病细胞株U937均购于美国ATCC公司。人多发性骨髓瘤细胞株CZ1由上海长征医院惠赠。
Raji、Z138、Jurkat、Jurkat E6-1、Molt-4、K562、HL-60、U937和CZ1细胞采用含10%(体积分数)胎牛血清的RPMI-1640培养基(同时含100 mg/L青霉素和100 mg/L链霉素), CA46、Hut-78和YTS细胞采用含20%(体积分数)胎牛血清的RPMI-1640培养基(同时含100 mg/L青霉素和100 mg/L链霉素), Maver细胞采用含10%(体积分数)胎牛血清的IMDM培养基(同时含100 mg/L青霉素和100 mg/L链霉素), 均在37 ℃、5%(体积分数)CO2、饱和湿度孵箱中培养, 每3天换液并传代, 取对数生长期细胞进行实验。
雌性5~6周龄BALB/c裸鼠54只, 体重16~18 g, 无特定病原体级(specific pathogen free, SPF), 购自北京维通利华实验动物技术有限公司, 饲养于北京大学医学部实验动物科学部SPF级动物房, 每日给予食物、自由饮水、12 h光照。每3天更换垫料, 遵守无菌操作原则。本实验所有的实验动物关怀、实验设计及操作、实验动物的处理均通过了北京大学实验动物伦理委员会的批准。
1.4.1 定量PCR(quantitative polymerase chain reaction, qPCR)检测细胞株中B7-H3 mRNA表达 用TRIzol试剂分别提取13株恶性血液病细胞株总RNA, 按照Thermo逆转录试剂盒说明书将其反转录为cDNA。引物序列参考文献[9]设计, B7-H3:上游5'-CTCTGCCTTCTCACCTCTTTG-3', 下游5'-CCTTGAGGGAGGAACTTTATC-3', 扩增片段长度为134 bp; β -actin引物序列:上游5'-TGACGTGGACATCCGCAAAG-3', 下游5'-CTGGAAGGTGGACAGCGAGG-3', 扩增片段长度为205 bp。采用20 μ L qPCR反应体系, 循环条件为:95 ℃ 15 min; 95 ℃ 10 s, 58 ℃ 20 s, 72 ℃ 30 s, 共40个循环。每株细胞设置4个复孔, 实验重复3次。应用iQ5软件分析数据, 2-Δ Δ Ct法计算B7-H3 mRNA的相对表达。
1.4.2 流式细胞术(flow cytometry, FCM)检测细胞株中B7-H3膜蛋白表达 分别收获13株恶性血液病的对数期细胞, 经0.22 μ m滤网过滤后用预冷的PBS洗涤2次, 调整细胞浓度为1× 106/mL, 各取100 μ L单细胞悬液分别加入5 μ L B7-H3单克隆抗体和相应同型对照抗体, 室温避光孵育30 min。鞘液洗涤2次后上机检测, 应用CellQuest Pro软件分析数据。相同条件下实验重复3次。
1.4.3 靶向B7-H3沉默建立稳定低表达细胞株及基因沉默效果检测 靶向人B7-H3(基因编号: 80381)短发夹RNA(short hairpin RNA, shRNA)序列设计为:5'-TCGTGTGCTGGAGAAAGATCAAACAGAGC-3', 无关阴性序列设计为5'-GCACTACCAGAGCTAACTCAGATAGTACT-3'[9]。用本实验室留存的滴度为5× 109 TU/mL的病毒液[8]感染对数生长期高表达B7-H3分子的U937、Maver和Z138 细胞, 48 h后分别在含250 mg/L(U937)和200 mg/L(Maver、Z138)嘌呤霉素的培养基中用有限稀释法筛选出稳定转染株, 分别用qPCR和FCM检测B7-H3基因沉默的效果。按照是否转染及转染的病毒不同将3株细胞各分成3组:未转染的肿瘤细胞对照组(non-infected control group, CON), 转染阴性无关序列对照组(negative nontargeted control infected group, NC), 转染靶向B7-H3 shRNA的基因敲减组(B7-H3 knockdown group, KD), 共9组。
1.4.4 裸鼠成瘤及转移情况 将54只BALB/c裸鼠随机分为9组, 分别为U937、Maver和Z138 细胞的CON组、NC组和KD组, 每组6只。取对数生长期的细胞制成单细胞悬液, 在无菌条件下用1 mL注射器分别在对应组裸鼠的右侧腋窝皮下注射U937(1× 107个细胞/只, 200 μ L)、Maver(2× 107个细胞/只, 200 μ L)和Z138(2× 107个细胞/只, 200 μ L)细胞, 建立裸鼠移植瘤模型。隔日观察肿瘤生长情况, 使用游标卡尺测量肿瘤的长径和短径。计算肿瘤体积V(mm3) =长× 宽2× 0.5, 并绘制肿瘤生长曲线。在观察终点(U937接种后第19天, Maver和Z138接种后第20天)拍照后断颈法处死裸鼠, 低温条件下完整取出移植瘤并称重。计算肿瘤生长抑制率=(1-处理组平均瘤重÷ 对照组平均瘤重)× 100%。解剖裸鼠, 观察肿瘤转移情况, 取出肿瘤转移部位并拍照记录。切取部分新鲜肿瘤及脏器组织置于4%(质量分数)多聚甲醛固定, 用于苏木精-伊红染色(hematoxylin-eosin staining, HE)和免疫组织化学(immunohistochemistry, IHC)染色, 另留部分肿瘤组织于液氮中保存, 以备Western blot实验使用。
1.4.5 HE染色和Ki-67 IHC染色 用4%(质量分数)多聚甲醛固定液氮保存组织24 h后, 行常规脱水、石蜡包埋、切片, 将制备的切片经脱蜡、水化后行HE染色。将肿瘤组织切片行IHC染色:脱蜡、水化后于3%(质量分数)H2O2中室温避光孵育25 min; 用1 mmol/L EDTA抗原修复缓冲液(pH 8.0)行抗原热修复; 以山羊抗体封闭10 min后滴加兔抗人Ki-67多克隆抗体(1 :500体积比稀释), 4 ℃孵育过夜, 加入二抗室温孵育50 min后用DBA显色。随机选取5个高倍镜视野(400× ), 计算阳性染色肿瘤细胞数占肿瘤细胞总数百分比的平均值, 即Ki-67指数。
1.4.6 蛋白质免疫印迹法(Western blot)检测MMP-2表达 用RIPA裂解液提取肿瘤组织总蛋白, BCA法定量后取35 μ g蛋白质上样, 10% (体积分数)SDS-PAGE电泳, 转至聚偏二氟乙烯膜后, 于5%(质量分数)脱脂奶粉室温封闭1 h, 分别加入兔抗人MMP-2一抗(1 :500, 74 000)和兔抗人GAPDH一抗(1 :5 000, 36 000), 4 ℃孵育过夜; 加入山羊抗兔800CW二抗(1 :10 000)室温孵育1 h, 应用美国LI-COR公司 Odyssey双色红外激光成像系统采集图像, ImageJ软件分析条带灰度, 计算目的条带与GAPDH灰度值之比。
实验数据用均数± 标准差表示, 采用SPSS 20.0软件, 3组间总的比较采用方差分析, 两组间相互比较采用SNK检验(q检验), 分类变量采用卡方检验, P< 0.05表示差异具有统计学意义。
2.1 13株人恶性血液病细胞B7-H3表达情况
分别应用qPCR和FCM检测13株恶性血液病细胞株中B7-H3 mRNA和膜蛋白的表达, 可见B7-H3 mRNA在除CZ1外的12株人恶性血液病细胞中广泛表达, 而蛋白质仅在人恶性血液病U937、Maver和Z138细胞表面高表达(图1)。选取U937、Maver和Z138用于后续基因敲减和体内实验。
分别应用qPCR和FCM验证基因沉默效果(图2), qPCR结果显示:U937、Maver和Z138细胞的KD组与相应NC组比较B7-H3 mRNA的表达明显降低(U937:F=76.24, P< 0.05; Maver:F=90.31, P< 0.05; Z138:F=85.37, P< 0.05), 而NC组与CON组相比差异无统计学意义(P> 0.05)。
FCM结果显示:3种细胞的KD组与相应NC组相比, B7-H3蛋白表达分别降低了95.50%(U937:F=134.66, P< 0.05), 86.85%(Maver:F=97.63, P< 0.05)和61.83%(Z138:F=78.96, P< 0.05), 差异有统计学意义。而NC组与CON组相比差异无统计学意义(P> 0.05)。
成瘤实验显示:U937、Maver和Z138移植瘤KD组与相应NC组相比, 肿瘤体积增长明显减慢(P< 0.05), 而NC组与CON组相比, 肿瘤体积增长趋势差异无统计学意义(P> 0.05)。在各组移植瘤模型的观察终点:U937组平均肿瘤生长抑制率为61.83%(F=43.78, P< 0.05), Maver和Z138平均肿瘤生长抑制率分别为59.12%(F=36.51, P< 0.05)和67.37%(F=40.29, P< 0.05, 图3)。
解剖证实, 所有移植瘤模型中, 除KD组外, 均发现远处转移, 其中以肝转移最为常见, U937裸鼠模型的NC组和CON组的转移均为2/6; Maver和Z138组模型的NC组和CON组亦发现肝转移(表1)。此外, U937模型的NC组有1只脾转移, Maver模型的CON组有1只眼眶转移, 而脑、肺、肾等部位未见肿瘤转移灶(图4)。
| 表1 裸鼠移植瘤的肝转移情况 Table 1 Liver metastasis of xenograft tumors in nude mice |
肿瘤组织Ki-67 IHC染色结果显示:KD组肿瘤组织Ki-67的表达水平较各自的NC组均明显降低(图5)。U937移植瘤3组间Ki-67表达差异有统计学意义(F=78.49, P< 0.05), KD组Ki-67指数为40.3%± 5.2%(与NC组的79.1%± 6.3%相比, q=30.31, P< 0.05); Maver移植瘤3组间Ki-67表达差异有统计学意义(F=66.21, P< 0.05), KD组Ki-67指数为35.2%± 6.4%(与NC组的69.6%± 5.1%相比, q=24.82, P< 0.05); Z138移植瘤3组间Ki-67表达差异有统计学意义(F=70.37, P< 0.05), KD组Ki-67指为38.4%± 7.1%(与NC组的75.7%± 4.8%相比, q=28.07, P< 0.05)。
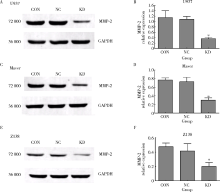
应用Western blot检测肿瘤组织MMP-2蛋白表达改变, 结果显示:U937移植瘤3组间MMP-2差异有统计学意义(F=55.86, P< 0.05), KD组与相应NC组比较MMP-2蛋白表达水平显著降低(q=14.59, P< 0.05), 而NC组与CON组MMP-2表达差异无统计学意义(q=1.13, P> 0.05)。Maver移植瘤3组间MMP-2差异有统计学意义(F=31.71, P< 0.05), KD组与相应NC组比较MMP-2蛋白表达水平显著降低(q=9.25, P< 0.05), 而NC组与CON组MMP-2表达差异无统计学意义(q=0.21, P> 0.05)。Z138移植瘤3组间MMP-2表达差异有统计学意义(F=47.27, P< 0.05), KD组与相应NC组比较MMP-2蛋白表达水平显著降低(q=11.04, P< 0.05), 而NC组与CON组MMP-2表达差异无统计学意义(q=0.31, P> 0.05, 图6)。
B7-H3分子是一种Ⅰ 型跨膜蛋白, 表达在活化的淋巴细胞, 树突状细胞, 肝、肺和前列腺等组织以及包括恶性血液病在内的多种肿瘤组织中[10]。Hu等[11]用FCM检测33例急性淋巴细胞白血病患者肿瘤细胞, B7-H3的阳性率为48.5%。近期研究发现B7-H3与多种肿瘤的临床预后密切相关[12, 13, 14, 15]。靶向B7-H3分子的多种单克隆抗体8H9、MJ18和MGA271等在临床试验中显示了良好的安全和有效性[16, 17, 18]。近年来, B7-H3分子在肿瘤发生发展中的作用及机制探讨已经成为临床研究的热点[19]。
本实验检测了13株人恶性血液病细胞中B7-H3分子的表达, 发现B7-H3 mRNA与其膜蛋白在不同细胞表达水平不平行, 这可能与MicroRNA-29和MicroRNA-187等参与的转录后调控机制有关[20, 21], 提示通过基因沉默抑制B7-H3表达可能是治疗恶性血液病的潜在方法。我们选取B7-H3高表达株, 设计并合成了特异性沉默B7-H3基因的shRNA, 转入肿瘤细胞, 通过shRNA对同源mRNA的降解, 实现了靶向B7-H3基因沉默, 并成功构建了稳定低表达细胞株。
既往的B7-H3对恶性血液病的研究多集中在体外细胞水平, 而鲜有对体内研究的报道。本实验以BALB/c裸鼠为研究对象, 成功建立恶性血液病移植瘤裸鼠模型以研究B7-H3靶向沉默对恶性血液病细胞体内成瘤和转移能力的改变, 结果显示, B7-H3基因沉默后移植瘤生长明显减慢, 提示B7-H3基因能够促进血液肿瘤的体内成瘤能力。Liu等[22]用人乳腺癌细胞B7-H3基因敲减株和对照株分别构建移植瘤裸鼠模型, 发现B7-H3基因敲减组肿瘤生长速率明显降低, 结果与本实验相近。Tekle 等[5]和Zhao等[9]分别将黑色素瘤和胰腺癌细胞的B7-H3基因敲减, 细胞的增殖能力明显减弱, 且荷瘤裸鼠的生存时间显著延长, 这些研究均提示B7-H3分子可能在体内发挥促瘤作用。Ki-67抗原是一种与细胞增殖相关的核蛋白, 其表达水平反映了细胞的增殖活性, 与恶性肿瘤的发展和预后高度相关[23]。本实验发现敲减B7-H3基因后Ki-67表达水平明显降低, 提示B7-H3分子可能通过增强Ki-67的表达, 进而促进恶性血液病肿瘤细胞增殖。
急性单核细胞白血病和套细胞淋巴瘤在临床上具有高度侵袭性, 成为疾病预后较差的重要原因。近期研究发现, 在黑色素瘤、骨肉瘤和非小细胞肺癌等多种实体瘤中, B7-H3分子的高表达能促进肿瘤的侵袭和转移[24, 25, 26]。本课题组前期通过体外微孔滤膜培养小室及双室联合培养系统(Transwell 试验)发现, 靶向B7-H3基因沉默后Maver和Z138细胞穿过基质胶的侵袭能力明显受到抑制, 提示B7-H3分子参与了套细胞淋巴瘤肿瘤细胞体外侵袭[8]。我们发现B7-H3基因敲减后肿瘤的转移能力有降低趋势, 但统计检验尚不能认为组间存在转移差异, 造成统计结果与实际观察情况不一致的原因可能是样本量不足造成的, 拟后续开展大样本量动物实验完善研究。Dai等[27]发现敲减胃腺癌细胞B7-H3基因可以显著抑制肿瘤在裸鼠体内的肝和腹腔转移, 结果与本实验相近。MMPs是一类Zn2+依赖的胞外蛋白水解酶, 被认为是评价肿瘤侵袭力的重要指标[28]。MMP-2是MMPs家族的一员, 可降解Ⅳ 型胶原蛋白, 与肿瘤的转移密切相关。本课题组前期体外实验发现B7-H3基因沉默后的Maver和Z138细胞MMP-2 mRNA表达水平显著降低[8]。在此基础上, 本实验敲减组肿瘤组织中MMP-2的蛋白表达明显降低, 提示B7-H3可能通过促进基质金属蛋白酶MMP-2表达增强了恶性血液病肿瘤细胞的体内侵袭能力。
综上所述, 本实验选取B7-H3表达水平较高的U937、Maver和Z138细胞, 建立稳定低表达B7-H3的细胞株。通过分别构建裸鼠皮下移植瘤模型, 证明了靶向B7-H3基因沉默能够通过下调Ki-67、MMP-2的表达水平从而抑制恶性血液病细胞的体内成瘤和转移能力, 为B7-H3分子在恶性血液病的靶向治疗提供了新的证据。
(本文编辑:刘淑萍)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|