目的 对比光、磁两种探针示踪显示脑组织间隙(interstitial space, ISS)内分子扩散与团流运动的结果,研究脑组织液(interstitial fluid, ISF)在ISS内的分区引流特征。方法 36只 SD大鼠随机分为荧光检查组(18只)和磁示踪组(18只),每组再随机分为尾状核(caudate nucleus, Cn)、丘脑(thalamus, T)和黑质(substantia nigra, Sn)3个亚组,每亚组6只。荧光检查组:参考脑立体定位图谱,选取冠状位苍白球为中心层面,以Cn、T和Sn为靶点进行穿刺定位,分别导入2 μL 10 mmol/L荧光黄(lucifer yellow,LY)于相应脑区的中心位置,于Cn 3 h、T 2 h和Sn 1 h对大鼠用4%(体积分数)多聚甲醛进行心脏灌注固定后,将取出的鼠脑置于脑切片模具中,沿视交叉向后切片,以进针位点所在的冠状切片为中心层面,计为1片,前取3片,后取2片,每片厚约1 mm,共6片待检测,应用激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)对离体切片进行采集,测量离体切片LY扩散的面积;磁示踪组大鼠也以Cn、T和Sn为靶点进行穿刺定位导入2 μL 10 mmol/L钆喷酸葡胺(gadolinium-diethylene triamine pentaacetic acidm,Gd-DTPA), 应用磁共振(magnetic resonance imaging,MRI)动态监测示踪剂在大鼠脑内的扩散,并利用Radiant软件测量Gd-DTPA的扩散面积。结果 LY与Gd-DTPA在Cn、T和Sn的ISS内扩散区域各不相同,Cn亚组LY与Gd-DTPA导入3 h后,比较1~6层LY与Gd-DTPA扩散面积为:(10.95±4.27) mm2 vs. (8.33±2.25) mm2、(18.16±4.74) mm2 vs. (16.42±2.88) mm2、(24.57±3.65) mm2 vs. (20.75±2.29) mm2、(34.81±3.32) mm2 vs. (28.88±1.51) mm2、(30.53±3.12) mm2 vs. (20.92±2.75) mm2、(12.15±4.92) mm2 vs. (10.00±1.89) mm2,对其在每层两组间扩散面积进行 t检验,扩散面积差异均无统计学意义( t=0.940, P=0.400; t=0.546, P=0.614; t=1.534, P=0.200; t=2.809, P=0.480; t=2.693, P=0.055; t=0.707, P=0.518);T亚组中LY与Gd-DTPA导入2 h后,比较1~6层LY与Gd-DTPA扩散面积为: (5.56±4.61) mm2 vs. (3.33±2.25) mm2、(16.21±3.36) mm2 vs. (11.42±2.88) mm2、(19.00±5.21) mm2 vs. (15.75±2.29) mm2、(25.32±5.49) mm2 vs. (22.33±3.25) mm2、(17.34±5.31) mm2 vs. (15.92±2.75) mm2、(7.67±6.19) mm2 vs. (5.00±1.89) mm2,对其在每层两组间扩散面积进行 t检验,差异均无统计学意义( t=0.753, P=0.493; t=1.875, P=0.134; t=0.990, P=0.378; t=0.810, P=0.464; t=0.413, P=0.701; t=0.716, P=0.514);Sn亚组LY与Gd-DTPA导入1 h后,比较1~6层LY与Gd-DTPA扩散面积为:(6.78±4.56) mm2 vs. (4.75±2.00) mm2、(12.65±5.04) mm2 vs. (10.44±1.13) mm2、(19.51±6.54) mm2 vs. (17.55±0.30) mm2、(28.72±5.45) mm2 vs. (24.48±1.32) mm2、(21.34±4.42) mm2 vs. (17.72±0.25) mm2、(13.00±5.46) mm2 vs. (12.00±2.88) mm2,对其在每层间扩散面积进行 t检验,扩散面面积的差异均无统计学意义( t=0.705, P=0.519; t=0.743, P=0.499; t=0.517, P=0.656; t=1.310, P=0.260; t=1.416, P=0.292; t=0.281, P=0.793),但LY扩散面积略大于Gd-DTPA。结论 荧光法证实了磁示踪法发现的ISF在ISS内的分区引流特征,并且可为磁示踪法提供离体验证的技术与方法。荧光ISS成像法具有更高的对比度和分辨率,得到了更加精细的ISF引流分区区域。
Objective: Compare the results of molecular diffusion and mass flow in the interstitial space(ISS) displayed by using optical and magnetic probes and study partitioned drainage of the brain interstitial fluid (ISF).Methods: In the study, 36 male SD rats were randomly divided into fluorescent inspection group (18), magnetic tracer group (18). Then they were divided equally into caudate nucleus (Cn), thalamus (T) and substantia nigra (Sn) subgroup, 6 rats in each subgroup. Referencing the brain stereotaxic atlas, the coronal globus pallidus as center level, Cn, T or Sn were acted as puncture positioning target. A 10 μL microsyringe was stereotaxically positioned and the lucifer yellow (LY) solution of 2 μL 10 mmol/L was infused into centric position. The coronary slices undergo cardiac perfusion and fix respectively in time point Cn 3 h, T 2 h and Sn 1 h. The rat brain was placed in rat stainless steel brain matrices and cut backward along visual intersection. The injection point of coronal slice as the center level, take 3 slices in front of the center level and 2 slices behind of it. 1 mm for each slice and 6 slices in total. Then slices were detected by laser scanning confocal microscope (LSCM). Simultaneous, in the same coordinate brain regions of another three groups, a gadolinium-diethylene triamine pentaacetic acidm (Gd-DTPA) solution of 2 μL 10 mmol/L was infused into different injection and detected by MRI tracer-based method. Then the Radiant can be used to measure distribution area of Gd-DTPA.Results: LY and Gd-DTPA have different distribution regions in Cn, T and Sn. After LY and Gd-DTPA were introduced into the Cn subgroup 3 h, compare the 1 to 6 levels distribution area of LY and Gd-DTPA as follows: (10.95±4.27) mm2 vs. (8.33±2.25) mm2, (18.16±4.74) mm2 vs. (16.42±2.88) mm2, (24.57±3.65) mm2 vs. (20.75±2.29) mm2, (34.81±3.32) mm2 vs. (28.88±1.51) mm2, (30.53±3.12) mm2 vs. (20.92±2.75) mm2, (12.15±4.92) mm2 vs. (10.00±1.89) mm2. The statistical analysis of every level was made by T test, and the difference of the distribution area between the two tracers were not statistically significant ( t=0.940, P=0.400; t=0.546, P=0.614; t=1.534, P=0.200; t=2.809, P=0.480; t=2.693, P=0.055; t=0.707, P=0.518); After LY and Gd-DTPA were introduced into the T subgroup 2 h, compare the 1-6 levels distribution area of LY and Gd-DTPA as follows: (5.56±4.61) mm2 vs. (3.33±2.25) mm2, (16.21±3.36) mm2 vs. (11.42±2.88) mm2, (19.00±5.21) mm2 vs. (15.75±2.29) mm2, (25.32±5.49) mm2 vs. (22.33±3.25) mm2, (17.34±5.31) mm2 vs. (15.92±2.75) mm2, (7.67±6.19) mm2 vs. (5.00±1.89) mm2. The statistical analysis of every level was made by T test, and the difference of the distribution area between the two tracers were not statistically significant ( t=0.753, P=0.493; t=1.875, P=0.134; t=0.990, P=0.378; t=0.810, P=0.464; t=0.413, P=0.701; t=0.716, P=0.514); After LY and Gd-DTPA were introduced into the Sn subgroup 1 h, compare the 1-6 levels distribution area of LY and Gd-DTPA as follows: (6.78±4.56) mm2 vs. (4.75±2.00) mm2, (12.65±5.04) mm2 vs. (10.44±1.13) mm2, (19.51±6.54) mm2 vs. (17.55±0.30) mm2, (28.72±5.45) mm2 vs. (24.48±1.32) mm2, (21.34±4.42) mm2 vs. (17.72±0.25) mm2, (13.00±5.46) mm2 vs. (12.00±2.88) mm2. The statistical analysis of every level was made by T test and the difference of the distribution area between the two tracers were not statistically significant ( t=0.705, P=0.519; t=0.743, P=0.499; t=0.517, P=0.656; t=1.310, P=0.260; t=1.416, P=0.292; t=0.281, P=0.793), but the distribution area of LY is slightly more than Gd-DTPA.Conclusion: LSCM imaging technology confirmed partitioned drainage of the brain ISF found by MRI tracer-based method and provided technology and method validation for MRI tracer-based method. LSCM imaging technology with higher contrast and resolution, therefore more sophisticated partitioned drainage of the brain interstitial fluid were got.
脑组织间隙(brain interstitial space, ISS)内物质运输是维系脑细胞生存微环境稳态的关键, 扩散和团流是物质在ISS内运动的基本形式。为了揭示ISS中分子转运的基本规律, 在本课题组既往的研究中[1], 以磁性示踪剂钆喷酸葡胺(gadolinium-diethylene triamine pentaacetic acidm, Gd-DTPA)作为分子探针, 对ISS内脑组织液(interstitial fluid, ISF)中的水分子进行特异性示踪标记, 利用磁共振成像(magnetic resonance imaging, MRI)动态实时监测ISS中水分子的扩散与团流运动, 并对脑卒中(stroke)与帕金森病(Parkinson’ s disease, PD)好发区的组织液流动规律进行了初步研究[2, 3], 结果发现ISF的流动呈现分区分布的特征, 并且在每个脑区内水分子扩散、流动的速度各不相同。为了进一步证实脑ISF流动的分区特征, 并对分区的机制进行深入研究, 本课题组前期筛选出了适合于脑ISS示踪荧光分子探针荧光黄(lucifer yellow, LY)[4, 5, 6, 7, 8], 并基于激光扫描共聚焦显微镜(laser scanning confocal microscope, LSCM)对生物样品进行定性、定量、定时和定位研究具有很大优越性的认识, 本研究通过LY和Gd-DTPA在尾状核(caudate nucleus, Cn)、丘脑(thalamus, T)和黑质(substantia nigra, Sn)脑区ISF的引流分区特征进一步研究和验证ISF引流分区特征, 并利用LSCM图像高对比度和高分辨率的特点, 对ISF引流分区区域划分出精标准, 提示以后脑局部给药治疗的研究设计都应考虑各自分区。
本实验严格遵守国家动物实验指南的要求, 研究开始前经过北京大学生物医学伦理委员会实验动物福利伦理分会审查批准(LA2012-016)。实验选用适龄雄性SD大鼠36只, 体重250~280 g, 随机分为荧光检查组(18只)和磁示踪组(18只), 每组再随机分为尾状核(caudate nucleus, Cn)、丘脑(thalamus, T)和黑质(substantia nigra, Sn)3个亚组, 各亚组每组6只。
制备SD大鼠复合麻醉剂(100 mL, 其中含 0.886 g 戊巴比妥、4.25 g水合氯醛、2.12 g硫酸镁、14.25 g 乙醇、35.15 g 1, 2-丙二醇)和人工脑脊液(100 mL, 其中含0.725 g 氯化钠、0.037 g 氯化钾、0.024 g 硫酸镁、0.0222 g 氯化钙、0.276 g 碳酸氢钠、 0.015 g 磷酸氢二钠和0.180 g 葡萄糖)备用; 用人工脑脊液稀释LY储备液(20 mmol/L)至10 mmol/L; 采用磁共振示踪剂Gd-DTPA 注射液(10 mmol/L, 北京北陆药业有限公司), 使用去离子水稀释。
SD大鼠经腹膜内注射复合麻醉剂 (3 mL/kg)麻醉后, 剔除脑部部分鼠毛, 裸露皮肤, 手术刀纵向切开皮肤, 将其固定在鼠脑立体定位仪上, plus90开颅钻在颅骨表面定位钻孔[9]。用10 μ L微量进样器向定位区域Cn、T和Sn注射2 μ L 10 mmol/L LY, 缓慢旋转打药, 打药时间5 min, 停针5 min, 退针, 观察是否有返留, 若返留严重, 应再次打药(表1)。
| 表1 大鼠脑注射部位立体定向坐标 Table 1 The injection sites on stereotactic coordinates of rat brain/mm |
选定了在MRI上各脑区Gd-DTPA最大扩散范围的时间节点[1], 固定大鼠, 喷洒酒精消毒, 沿腹中线剪开皮肤和肌肉组织, 避开血管, 剪开肋骨, 暴露整个心脏, 灌注约300 mL含有肝素钠(常州千红生化制药股份有限公司)的生理盐水(华润双鹤药业股份有限公司), 流出的血液变淡即停止, 滴瓶灌注约150 mL 4%(体积分数)多聚甲醛(北京索莱宝科技有限公司), 灌注过程约30 min, 大鼠肢体发白, 尾巴、四肢、头部抽搐颤抖为灌注成功。
分离除去后颈部肌肉, 暴露颅骨, 止血钳迅速分离脑表面的颅骨, 暴露脑组织。用眼科镊小心取出脑组织, 仔细分离脑膜。将取出的鼠脑置于脑切片模具中, 用犀牛牌剃须刀片沿视交叉向后切片, 以进针位点所在的冠状切片为中心层面, 计为1片, 前取3片, 后取2片, 每片厚约1 mm, 共6片待检测。脑片用圆形盖玻片(直径16 mm)覆盖, 小心转移到共聚焦皿(35 mm× 20 mm)上, 皿边缘滴少量人工脑脊液保湿。
LY采用405 nm波长的激光, 致密区图像采集用488 nm波长的激光。序列1检测器检测荧光信号设置接收波长为490~550 nm, 光镜采用633 nm波长的激光; 序列2开启透射光检测器(PMT Trans), 将扫描区域选定在最亮处。由于使用显微镜镜下成像只是整体的一部分, 不能看到样品的全貌, 同时单个视野不具有代表性, 所以采用拼图功能, 实现了微观到宏观的成像, 光镜辅助了荧光的定位, 拼图选择起点和终点时, 要让激光一部分压在样品上, 一部分打空, 这样可以实现最小面积扫描, 也是节省时间的一种方法。
在工作站中启动LAS AF软件, 点open打开LSCM上采集图像的源文件, 选择Quality, 用任意图形绘制框分别划出脑片的整体轮廓和荧光扩散的范围, Sum Processed Pixel Areas读取所选范围面积(图1)。
在Adobe photoshop CS5中新建宽度1 600像素、高度1 261像素、分辨率300像素/英寸(1英寸=2.54 cm)和颜色模式RGB模式, 在大鼠脑图谱中选择和采集到的脑片一致的层面[11], 粘贴到photoshop中, 同时将脑片图像粘贴进入, 调整大小和脑图谱正好相互对应, 利用魔法棒工具将各分区抠除, 记录示踪剂扩散到的脑区, 依此方法比较脑切片的各个层面, 最终得到示踪剂在整脑中的扩散区域。
使用SPSS 20.0软件进行分析。LY与Gd-DTPA在SD大鼠尾状核、丘脑和黑质ISS内每两层间扩布面积采用t检验(双侧检验), P< 0.05认为差异有统计学意义。
应用LSCM的Merging功能可以获取较大面积样本的整体图像, 图2显示的是将荧光分子探针LY导入尾状核区域3 h后检测的约为12 mm× 14 mm的脑切片图像。
 | 图2 脑切片的Merging图像Figure 2 The Merging image of brain sliceOverall fluorescence image of LY after introduced into Cn (objective × 5). The bar of single image (left) is 1 000 μ m. |
在Cn、T和Sn的ISS内示踪剂分布区域最大时间节点时, 荧光分子探针LY、磁性分子探针Gd-DTPA导入的层面在LSCM图像及MRI上呈现出示踪剂具有最大的扩散面积, 偏离注药层面周围局部脑组织示踪剂的扩散面积下降。示踪剂在3个脑区ISS内扩散区域各不相同, 其中Cn的ISS内扩散最为广泛, 而T和Sn中示踪分子的扩散主要在其解剖分区, 并未向其他区域扩散(图3)。Cn亚组LY与Gd-DTPA导入3 h后, 对其在每层间扩散面积进行t检验, 两种示踪剂在1~6层扩散面积差异无统计学意义(t=0.940, P=0.400; t=0.546, P=0.614; t=1.534, P=0.200; t=2.809, P=0.480; t=2.693, P=0.055; t=0.707, P=0.518); T亚组LY与Gd-DTPA导入2 h后, 对其在每层间扩散面积进行t检验, 两种示踪剂在1~6层扩散面积差异无统计学意义(t=0.753, P=0.493; t=1.875, P=0.134; t=0.990, P=0.378; t=0.810, P=0.464; t=0.413, P=0.701; t=0.716, P=0.514); Sn亚组LY与Gd-DTPA导入1 h后, 对其在每层间扩散面积进行t检验, 两种示踪剂在1~6层扩散面积的差异无统计学意义(t=0.705, P=0.519; t=0.743, P=0.499; t=0.517, P=0.656; t=1.310, P=0.260; t=1.416, P=0.292; t=0.281, P=0.793), 但LY扩散面积略大于Gd-DTPA。
通过将LSCM图像与大鼠脑图谱进行叠加可以得到分区的脑切片实物图, 图4显示将荧光分子探针LY导入尾状核区域3 h后脑切片实物图。
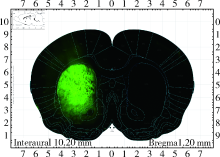 | 图4 LSCM图片和大鼠脑立体图谱的叠加图Figure 4 The overlay pictuire of LSCM image and the brain stereotaxic atlasLY diffusion regions in the coronal plane before bregma 1.20 mm. |
LSCM采集到尾状核区LY扩散广泛, 丘脑区和中脑黑质区只局限于其解剖分区。与核磁图像划分区域对比显示出, 荧光图像中示踪分子扩散的范围较核磁图像要大, 除核磁图像显示示踪分子扩散到的区域外, 荧光图像还显示出尾状核区域LY扩散到了伏核(核心部)、前连合(前部)、丘脑腹前核、丘脑腹后外侧核、丘脑前腹侧核、丘脑中央外侧核、丘脑外侧背核(背内侧部)和丘脑背外侧核(腹外侧核), 丘脑区域扩散到了海马CA1区、海马CA2区和海马CA3区, 黑质区域扩散到了下丘脑外侧区、中脑深核、内侧丘系和被盖中央束(表2)。
| 表2 LY和Gd-DTPA显示的SD大鼠脑ISF分区引流区域 Table 2 The partition drainage zone of SD rat brain ISF detected by LY and Gd-DTPA |
为了找到ISF引流具有分区特征的原因, 采集脑切片尾状核与丘脑区域5X拼图, 并采集到了相应区域边界范围的质密区(图5), 尾状核与丘脑区域5X拼图显示在LY扩散的边界都存在着明显的界限(图5 A、B中白色箭头表示), LSCM采集的脑组织质密区可以表示一种不均质, 阻碍了LY的扩散(图5 C、D中白色箭头表示)。
本研究利用LSCM和MRI对LY和Gd-DTPA两种示踪剂在SD大鼠脑部的定位和扩散面积进行了比较, 荧光ISS成像法证实MRI示踪法发现的ISF在ISS内的分区引流特征。在对示踪剂扩散的面积定量时发现LY扩散的面积要略大于Gd-DTPA。原因可能有两点, 首先LSCM采集的图像具有对比度高和分辨率高的特点, 而磁共振成像技术的分辨率为0.5 mm× 0.5 mm× 0.5 mm, 所以MRI示踪法采集的图像在靠近边界处Gd-DTPA的低信号就不容易被采集到; 其次LY的相对分子质量是521.57, Gd-DTPA相对分子质量是938.00, 虽然LY和Gd-DTPA示踪剂两者的相对分子质量在数量级上基本一致, 但Gd-DTPA却要比LY相对分子质量略大, 导致其扩散速率相对LY慢一些。在定量结果上会显示出LSCM成像技术采集到的LY扩散面积高于Gd-DTPA。既然LSCM图像能够显示出更加清晰的LY扩散边界信息, 因此将荧光图片与脑图谱进行了对比, 划分出了3个脑区更加精细的扩散范围, 这些结果既是对MRI示踪法结果的印证, 同时又是MRI示踪法研究ISS特性的发展。在此基础上进一步发现LY的分布被质密结构所包裹, 形成了一种互不联通的状态, 导致了引流分区, 这只是在宏观上提出的一种假说, 在微观水平还有很多ISS内的结构和细胞外基质的影响因素, 其证实需要更多后续的工作。尽管光、磁两种测量技术的原理不同, 但都显示出ISF的引流呈现分区特征, 说明分区特征是ISS内物质运输的基本特征。因此, 今后任何对脑局部给药治疗的研究设计都应考虑各自分区, 包括与分布和起始点有关的药物的分布区域。
LSCM方便SD大鼠脑切片的离体检测, 以及相关机制的研究, 它以激光作为光源, 激光器发出的激光通过照明针孔形成点光源, 经过透镜、分光镜形成平行光后, 再通过物镜聚焦在样品上, 并对样品内聚焦平面上的每一点进行扫描。样品被激光激发后的出射光波长比入射光长, 可通过分光镜, 经过透镜再次聚焦, 到达探测针孔处, 被后续的光电倍增管检测到, 并在显示器上成像, 得到所需的荧光图像, 而非聚焦光线被探测针孔光栏阻挡, 不能通过探测针孔, 因而不能在显示器上显出荧光信号。LSCM优势[8, 12, 13]在于激光单色性、方向性好, 能够逐点成线再成面聚焦扫描, 图像具有较高的对比度和分辨率, 同时设有检测孔光栏、光电倍增管的检测范围、物镜电子放大倍数(zoom), 以利于采集各种荧光信号; 有三维功能, 通过高度精确微量步进马达(zdriver)使物镜离开切片的新鲜表面, 聚焦在每一脑片的内部, 图像信息采集被控制在精确的平面内, 这样就不受脑片新鲜切面、器皿等外部因素的干扰; 拼图兼顾了宏观和微观采集; 还可对图像内的荧光强度和面积定量。脑ISS的结构及其内的基质是ISF呈现分区引流特征的基础, 通过离体条件下免疫染色等方法, 使用LSCM可以对神经元、胶质细胞、水通道蛋白AQP4、血管等信息进行采集, 并得到精确的定位和定量信息[14, 15, 16], 但其不足之处在于活体检测中即使使用双光子最深也只能观察1 mm的厚度, 无法在体实现全脑范围ISF分区引流的动态连续观察。
磁共振适合SD大鼠活体动态连续观察, 方便在体生理学或病理学观察, 其利用核磁共振原理, 依据所释放的能量在物质内部不同结构环境中不同的衰减, 通过外加梯度磁场检测所发射出的电磁波, 即可得知构成这一物体原子核的位置和种类, 据此可以绘制成物体内部的结构图像。磁共振成像具有出色的软组织分辨力、无创、任意角度成像等优点, 能显示SD大鼠脑的内部结构, 但其分辨率和对比度相对于光学成像较低, 参数拟合尚待进一步的开发, 处理流程比较复杂[17, 18]。
LSCM成像技术和MRI示踪法提供了离体和在体的脑部研究, 各有优势, LSCM成像技术证实了MRI示踪法发现的ISF流动最大分布的分区特征, LSCM成像技术为MRI示踪法提供离体验证的技术与方法。由于其较高的对比度和分辨率, 同时确定了脑区范围的精标准, 为今后研究各脑区各项特性奠定了基础。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|