目的 探讨重复异丙酚麻醉对新生大鼠海马细胞凋亡及远期学习记忆能力的影响。方法 清洁级SD大鼠45只,7 d龄,雄性,随机分为3组( n=15):对照组(C组)腹腔注射脂肪乳剂7.5 mL/kg,每天1次,连续7 d;反复注射异丙酚组(P1组)腹腔注射异丙酚75 mg/kg,每天1次,连续7 d;单次注射异丙酚组(P2组)腹腔注射脂肪乳剂7.5 mL/kg,每天1次,连续6 d,第7天注射异丙酚75 mg/kg。每组取5只大鼠,于苏醒后即刻抽取动脉血样行血气分析。异丙酚给药结束后2周时采用Morris水迷宫实验测试大鼠的学习记忆功能,之后处死大鼠,免疫组织化学法检测大鼠海马神经元特异性核蛋白(neuron-specific nucleoprotein,NeuN)的表达,Western blot检测大鼠海马组织中caspase-3的表达。结果 3组大鼠动脉血气指标差异无统计学意义。与C组相比,P1组大鼠第5天寻找平台潜伏期延长、寻找平台路径增长,第6天目标象限探索时间缩短、穿环次数减少( P<0.05);而P2组的寻找平台潜伏期、寻找平台路径长度、探索时间、穿环次数与C组相比差异无统计学意义。与C组相比,P1组大鼠海马组织内NeuN阳性细胞数量减少、caspase-3表达增强;P2组大鼠海马内NeuN阳性细胞数量、caspase-3的表达与C组相比差异无统计学意义。结论 重复异丙酚麻醉可降低新生大鼠的远期学习记忆能力,可能与其增加海马内的细胞凋亡有关,单次异丙酚麻醉对新生大鼠的海马细胞凋亡及远期学习记忆能力没有显著影响。
Objective: To investigate the influences of repeated propofol anesthesia on the hippocampal apoptosis and the long-term learning and memory abilities of neonatal rats.Methods: In the study, 45 male Sprague-Dawley rats, aged 7 days, were randomly divided into 3 group ( n=15 each): control group (C group) that received intralipid 7.5 mL/kg intraperitioneal (IP) once a day×7 days; group propofol 1 (P1) that received propofol 75 mg/kg IP once a day×7 days; group propofol 2 (P2) that received intralipid 7.5 mL/kg IP once a day×6 days+propofol 75 mg/kg IP on the 7th day. In each group, 5 animals were chosen and arterial blood samples were obtained immediately after the animals were fully awake for blood gas analysis. Learning and memory abilities were assessed using Morris water maze when the other rats were 4 weeks old. The animals were decapitated after the tests. The hippocampi were isolated for detection of neuron-specific nucleoprotein (NeuN) expression by immunohistochemistry method and the expression of caspase-3 using the Western blot.Results: There was no significant difference in the indexes of blood gas analysis among the 3 groups. Morris water maze test: compared with group C, the escape latency and the length of searching on the 5th day were significantly prolonged, and the searching time in target quadrant and platform crossing on the 6th day were significantly decreased in group P1 ( P<0.05) but not in group P2. Compared with group C, NeuN-positive neurons were decreased, and the expression of caspase-3 was increased in the rats of group P1 ( P<0.05) but not in group P2.Conclusion: Repeated propofol anesthesia may destroy long-term learning and memory abilities by inducing apoptosis of hippocampal neurons in neonatal rats, while single dose of propofol has no obvious effect on the hippocampal apoptosis and long-term learning and memory of neonatal rats.
随着儿科手术的广泛开展, 越来越多婴幼儿接触到各类麻醉药物。由于患儿的配合性差, 全身麻醉成为儿科手术中最常使用的麻醉方法[1]。既往研究认为, 随着全身麻醉药在体内的代谢消失, 大脑将恢复到和麻醉前相同的状态, 但已有研究报道, 全身性麻醉药(如氯胺酮、氧化亚氮、咪达唑仑、巴比妥钠和异氟烷等)单独使用或联合使用较长时间时, 会导致发育期大脑出现广泛的神经细胞变性, 并可能影响至成年, 最终影响远期的学习记忆能力[2, 3]。
异丙酚是现今临床最为常用的短效静脉麻醉药, 因其具有起效快、苏醒迅速、持续输注后无蓄积等特点, 被广泛用于麻醉诱导与维持、重症监护病房(intensive care unit, ICU)的镇静等方面。但是, 由于受到伦理学的限制, 异丙酚是否适合应用于新生儿和婴幼儿的全身麻醉, 尚缺乏大样本的临床研究。异丙酚对发育期的大脑是否产生神经毒性、对远期的学习记忆能力是否有影响, 目前尚无定论。本文拟探索重复异丙酚麻醉对新生大鼠海马细胞凋亡、海马神经元特异性核蛋白(neuron-specific nucleoprotein, NeuN)的表达及远期学习记忆能力的影响, 为异丙酚在新生儿和婴幼儿中的合理应用提供理论依据。
健康雄性SD大鼠45只, 7 d龄, 体重8~15 g, 由北京大学医学部实验动物科学部提供, 以随机数字表法随机分为3组(n=15)。
对照组(C组):腹腔注射脂肪乳剂(力能, 华瑞制药有限公司, 江苏)7.5 mL/kg, 每天1次, 连续7 d。
反复注射异丙酚组(P1组):腹腔注射异丙酚(异丙酚批号:P017269, AstraZeneca公司, 意大利)75 mg/kg, 每天1次, 连续7 d。
单次注射异丙酚组(P2组):腹腔注射脂肪乳剂7.5 mL/kg, 每天1次, 连续6 d, 第7天注射异丙酚75 mg/kg。
每次给药后立即将大鼠放置保温箱中, 同时将婴儿血氧饱和度探头贴于鼠腹部, 监测血氧饱和度SpO2。
第7天给药后, 每组随机取5只大鼠, 腹腔注射10%(体积分数)水合氯醛(3.5 mL/kg)麻醉, 开胸暴露心脏, 使用肝素化的注射器穿刺左心室, 取动脉血1 mL, 采用便携血气分析仪(OPTI公司, 美国)进行血气分析及测定血糖, 其余大鼠与母鼠同窝饲养, 自由进食、饮水, 7 d后断母乳饲养, 出生后7~28 d每天称体重。
异丙酚给药结束后2周, 即大鼠出生后4周, 采用Morris水迷宫试验进行认知功能测试。水迷宫由一圆形水池(直径110 cm、高50 cm)、图像采集系统和操作分析系统组成。水池被通过圆心的两条假想垂线划分为4个象限, 将一个直径10 cm的平台固定在一个象限, 平台在水面下1 cm, 盛水后加入墨汁混匀, 水温维持于22 ℃~25 ℃。
定位航行实验:分5 d进行, 每天每只大鼠训练4次, 每只大鼠随机从每个象限的中点面壁式入水1次, 每次间隔90 s, 图像采集系统及分析系统自动记录大鼠90 s内找到平台的时间和路径长度, 即逃逸潜伏期和寻找平台路径长度。以第5天的逃逸潜伏期和寻找平台路径长度反映其学习功能, 逃逸潜伏期和寻找平台路径长度越长, 学习功能越差。
空间探索实验:第6天时将平台撤除, 选定和平台区域相对的象限中点为入水点, 图像采集系统及分析系统自动记录大鼠90 s内在原平台所在象限探索时间和穿越平台次数以反映其记忆功能, 探索时间越长, 穿越平台次数越多, 记忆功能越好。整个测试期间, 保持实验室内灯光、物品摆放等室内环境一致以排除环境干扰。
水迷宫实验结束后, 每组取5只大鼠, 10%(体积分数)水合氯醛3.5 mL/kg腹腔注射麻醉, 经左心室灌注生理盐水100 mL, 再灌注4%(体积分数)多聚甲醛溶液150 mL, 断头处死取脑组织, 制成4 μ m 厚的切片。脑组织切片经60 ℃烤箱烤3~4 h后, 脱蜡、水化、磷酸盐缓冲液(phosphate buffered saline, PBS)冲洗; 滴加正常山羊血清封闭液孵育10 min, 加入鼠抗NeuN单克隆抗体(1 :1 000, Chemicon公司, 美国), 于4 ℃孵育过夜; PBS冲洗, 加人生物素标记的羊抗鼠IgG抗体(北京中杉金桥生物技术有限公司); PBS冲洗, 加入辣根酶标记的链酶卵白素, 常温孵育; PBS冲洗、二氨基联苯胺(diaminobenzidine, DAB)显色、苏木素复染、酒精分化、脱水, 中性树胶封片。采用Image-Pro Plus 6.0图像分析系统进行图像分析, 神经元胞核或胞质显示棕黄色为阳性, 不显色为阴性。每组10张切片, 在荧光显微镜下(× 200)相同区域选取10个非重叠的视野, 记数各视野的NeuN阳性细胞数, 以10个视野的平均值作为该片染色结果, 10张切片的平均值作为该组标本的最后结果。
水迷宫实验结束后, 每组取5只大鼠, 腹腔注射水合氯醛麻醉, 断头处死取脑组织, 分离得到海马组织, 采用Western blot方法检测caspase-3的表达。使用细胞裂解液提取海马组织蛋白, 用BCA(bicinchoninic acid)法进行蛋白含量测定。取50 μ g蛋白在10%(质量分数)聚丙烯酰胺凝胶(polyacrylamide gel electrophoresis, PAGE)上电泳, 后转移至硝酸纤维素滤膜, 5%(质量分数)脱脂奶37 ℃封闭1 h。加入兔抗鼠caspase-3抗体(1 :200, Santa Cruz公司, 美国), 于4 ℃孵育过夜; 加入荧光抗兔IgG抗体
(1 :1 000, LI-COR公司, 美国), 常温孵育l h, 在凝胶一次成像仪内曝光成像, 以β -actin为内参照。
采用SPSS 20.0统计软件进行分析, 血气分析、血糖、免疫组织化学染色、Western blot检测以及水迷宫的实验数据均以均数± 标准差(
所有大鼠在实验期间全部存活, 体重的组间差异无统计学意义。3组大鼠动脉血的pH值、PO2、PaCO2、HC
| 表1 3组大鼠血气分析的比较( |
与C组相比, P2组大鼠第5天的逃避潜伏期无明显变化, P1组大鼠的逃避潜伏期明显延长(P< 0.05), 寻找平台路径长度明显延长(P< 0.05)。第6天, P1组大鼠的目标象限探索时间、穿越平台次数明显少于C组(P< 0.05); P2组大鼠的目标象限探索时间、穿越平台次数与C组相比差异无统计学意义(表2)。
| 表2 各组远期学习记忆功能的比较( |
与C组相比, P1组大鼠海马CA1区、CA3区、齿状回NeuN阳性细胞数量明显减少(P< 0.05), P2组大鼠NeuN阳性细胞数量与C组相比差异无统计学意义(图1、2)。
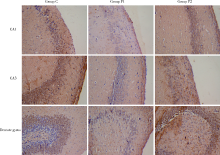 | 图1 免疫组织化学法检测海马组织中NeuN的表达 (× 200)Figure 1 NeuN expression in hippocampus detected by immunohistochemistry (× 200)NeuN, neuron-specific nucleoprotein. |
 | 图2 各组大鼠海马组织中NeuN阳性神经元的数量( |
采用Western blot法测定P1组大鼠海马组织caspase-3的表达量为0.56± 0.12, 与C组(0.21± 0.02)相比明显增加(P< 0.05); P2组大鼠海马组织caspase-3的表达量为0.35± 0.08, 与C组相比差异无统计学意义(图3)。
全身麻醉是儿科手术中最常使用的麻醉方法, 然而随着研究的深入, 人们发现全身麻醉药物具有神经毒性, 尤其是对处于有活力的发育改变时期的大脑, 麻醉药物的神经毒性更为明显[4, 5]。不同的物种中大脑的快速发育期不同, 在啮齿类动物, 突触发生在生后14 d内完成, 高峰出现在出生后7 d, 但在人类, 突触发生出现在妊娠中期, 并持续至2岁[6], 因此, 本实验选用出生7 d的大鼠作为研究对象。
除了麻醉药物以外, 麻醉中发生的低氧血症和酸中毒也是导致神经元退行性变的因素之一, 因此, 本研究对苏醒后的大鼠进行了动脉血气分析, 以排除低氧血症或酸碱失衡等内环境紊乱所致的神经元变性对实验结果的干扰, 结果表明, 各组大鼠麻醉期的动脉血pH值、PO2、PaCO2、HC
学习记忆能力是认知功能的重要组成部分, 而婴幼儿期处于中枢神经系统生长发育的高峰期, 涉及神经细胞的增殖、移行、分化, 突触形成, 回路重塑以及联想学习能力的建立[7]。目前, 用于检测海马依赖的学习记忆功能的检测方法主要包括跳台实验、避暗实验、穿梭箱实验、水迷宫实验等, 其中, Morris水迷宫实验具有结果稳定、重复性好的优点[8], 故成为目前国际上检测大鼠学习记忆功能最常使用的行为学方法。本研究中, 水迷宫定位航行实验的结果显示, P1组大鼠的逃避潜伏期时间、寻找平台路径长度均长于对照组, 提示发育期大鼠接受重复的异丙酚麻醉后, 学习能力显著降低; 空间探索实验的结果显示, 与对照组相比, P1组大鼠的目标象限探索时间、穿环次数明显减少, 表明重复的异丙酚麻醉可损害发育期大鼠海马依赖的空间参考记忆能力, 而P2组与C组相比水迷宫各项指标差异均无统计学意义, 提示单次异丙酚麻醉对新生大鼠的远期学习记忆能力无明显影响。
对于异丙酚对发育期大脑产生神经毒性的机制目前存在较多争议。异丙酚主要通过兴奋氨基丁酸受体、降低兴奋性突触传递产生麻醉作用, 其中γ -氨基丁酸A型(γ -aminobutyric acid-A, GABAA)受体是静脉麻醉药的重要作用靶点[9], 直接或间接地抑制N-甲基-D-天冬氨酸(N-methyl-Daspartate, NMDA)受体功能可能为麻醉作用最后的共同通路[10]。有研究表明, 脑发育高峰时期, 药物性阻断NMDA受体或/和过度激动GABAA受体会触发神经细胞凋亡[11], 因此, 本实验目的是探索异丙酚是否会使发育期脑组织神经细胞凋亡增加, 从而导致远期学习记忆能力下降。
细胞凋亡是清除发育过程中形成的非正常神经细胞的必需方式, 这保证了神经系统具有合理的结构, 但病理性的细胞凋亡则会导致神经网络结构的破坏。NeuN是一种可溶解的核蛋白, 它能特异地与神经元细胞核的抗原结合, 是神经系统特异性核调节分子[12]。NeuN正常表达于脑组织成熟的锥体神经元和颗粒性神经元中, 故常作为神经元存活的主要检测指标。caspase家族属于半胱氨酸基天冬氨酸基特异性蛋白酶, 其激活被认为是细胞凋亡的特征性标志之一。有研究表明, 大多数促凋亡信号是通过效应性蛋白酶caspase来诱发细胞凋亡的[13]。caspase-3为caspase家族的成员, 是所有细胞凋亡途径的最后效应子。本研究中, 出生7 d龄大鼠接受反复异丙酚麻醉, 成年后海马CAl区、CA3区和齿状回的NeuN阳性神经元减少, caspase-3表达增强, 与既往文献报道一致[14]。单次给予异丙酚后, NeuN阳性神经元数量、caspase-3表达与对照组无明显差异, 说明反复异丙酚麻醉可增加新生大鼠海马区细胞的凋亡, 而单次异丙酚麻醉则对海马区细胞凋亡无明显影响。
综上所述, 异丙酚反复麻醉可能通过抑制神经元存活的数量、降低NeuN的表达、增加细胞凋亡而损害大鼠成年后的学习记忆能力, 而单次异丙酚麻醉对学习记忆能力无明显影响, 但是, 本动物实验研究结果是否可以反映人体变化尚不明确, 其转化关系有待进一步研究, 另外, 异丙酚对发育期大脑的神经毒性是否存在剂量相关性, 尚待进一步研究。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|



