目的 生物活性玻璃(bioactive glass, BG)对人牙髓细胞(human dental pulp cells, hDPCs)的增殖及矿化有积极的作用,本研究目的是研究精氨酸-甘氨酸-天门冬氨酸-丝氨酸序列(Arg-Gly-Asp-Ser,RGDS)在BG对hDPCs的黏附、增殖及矿化作用中的影响。方法 用含不同质量浓度RGDS(12.5 mg/L、25.0 mg/L、50.0 mg/L、100.0 mg/L、200.0 mg/L)的BG浸提液培养hDPCs,对照组为不含RGDS的BG浸提液。采用细胞活性噻唑蓝(MTT)比色法于接种后4 h检测细胞黏附数量,于第1、3、5、7、9天测定细胞增殖,第14、28天对细胞进行茜素红染色检测矿化活性。结果 BG浸提液加RGDS组与单纯BG浸提液组相比,hDPCs黏附数目降低,呈RGDS浓度依赖性;BG浸提液加RGDS组的增殖活性早期低于单纯BG浸提液组,但后期两组之间差异无统计学意义;BG浸提液能够促进hDPCs的矿化,加入RGDS组的矿化活性与单纯BG浸提液组差异无统计学意义。结论 游离态RGDS不影响BG对hDPCs的增殖和矿化促进作用,但会与hDPCs结合进而影响hDPCs向培养皿底的黏附。
Objective: Positive effects of bioactive glass (BG) on proliferation, mineralization, and differentiation of human dental pulp cells (hDPCs) was already verified in various former studies. The Arg-Gly-Asp-Ser sequence (RGDS) was confirmed of affecting cell adhesion. Before further investigation, the objective of this study is to investigate whether RGDS can affect the effects of BG on the adhesion, proliferation and mineralization of hDPCs.Methods: hDPCs were harvested from third molars of 18-25-year-old individuals after informed consent. Enzyme digestion technique was used. The 4thto 6th ge-neration of hDPCs were used for all experiments.The cells of the experimental groups were cultured in Dulbecco minimum essential medium (DMEM) containing ionic dissolution products of BG and RGDS of seve-ral concentrations (12.5 mg/L, 25.0 mg/L, 50.0 mg/L, 100.0 mg/L, 200.0 mg/L). DMEM containing ionic dissolution products of BG without RGDS was used for cell culture as control group. Cell adhesion was tested 4 h after cell seeding by MTT assay. Cell proliferation was examined at 1, 3, 5, 7, and 9 d after cell seeding by MTT assay. Cell mineralization was investigated on days 14 and 28 by alizarin red staining. After being stained and dried, mineralized nodules were dissolved by cetylpyridinium chloride (CPC) for semi-quantitative test. Results were statistically analyzed by one way ANOVA, SPSS (version 19.0) and P<0.05 was considered to be significant.Results: Cell adhesion in BG group showed no difference from that in DMEM group. Compared with BG group, hDPCs in BG+RGDS groups suggested weaker cell adhesion.When the concentration of RGDS increased, the adhered cell number decreased. hDPCs cultured with BG and RGDS showed lower proliferation activity in the early stage, while no significant difference was observed after 3 d. BG group promoted the mineralization of hDPCs compared with positive control group, negative control group and RGDS group. No significant difference was observed between BG+RGDS group and BG group or between RGDS group and positive control group.Conclusion: BG promotes proliferation and mineralization without affecting cell adhesion of hDPCs. Unbounded RGDS inhibits cell adhesion, but has no influence on the positive effects of BG on the proliferation and mineralization of hDPCs.
细胞在支架上的迁移、黏附、生长、增殖以及分化过程, 可以通过细胞和支架表面的活性因子或多肽的相互作用来调控。生物活性多肽是涉及生物体内各种细胞功能的生物活性物质, 具有生物功能, 能够沟通细胞和器官间信息, 参与调节生长、发育、代谢等生命过程。借助短肽片段的形式传递生物信息被证明是有效调控干细胞命运的手段之一。
精氨酸-甘氨酸-天门冬氨酸序列(Arg-Gly-Asp, RGD), 是与牙矿化密切相关的牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)和牙本质基质蛋白1(dentin matrix protein 1, DMP-1)中一段共同的肽序列, RGD序列结合在材料表面时可促进细胞与材料黏附, 而游离在溶液中时可作为竞争对象阻止细胞与基质中的物质黏附[1]。为了提升RGD序列的黏附作用, 学者们将RGD序列修饰上不同的氨基酸或改变其空间构象, 结果表明在RGD序列的N端修饰残基不会影响其细胞黏附力[2], 而C端修饰[如修饰一个丝氨酸(Ser, S), 即Arg-Gly-Asp-Ser, RGDS]即能提高RGD序列的黏附能力[3]。
生物活性玻璃(bioactive glass, BG)因具有良好的生物相容性和生物诱导活性[4], 已被应用于骨、关节的再生。同时, 研究者不断改进生物活性玻璃的构建和制备的工艺, 以进一步提高其性能。近年来, 有研究发现新型纳米BG能促进人牙髓细胞(human dental pulp cells, hDPCs)的增殖[5]、分化、矿化及整合素β 1的表达[6], 在动物实验中还发现BG可诱导牙髓组织形成牙髓-牙本质复合体样结构[7], 从而显示出该新型纳米BG对牙髓细胞分化和牙髓再生具有良好的生物诱导作用。
BG虽然具有良好的生物相容性和生物诱导活性, 但是不能提供类似天然组织的生物信号, 无法提供胞外基质信息。如将天然牙本质中与牙矿化密切相关的DSPP和DMP-1的共同的肽序列RGDS复合于BG, 可能会增加对hDPCs成牙本质向分化的调控, 但RGDS是否会影响BG对hDPCs的作用尚缺乏实验证据。因此, 本研究使用BG浸提液加入不同质量浓度RGDS培养hDPCs, 初步探讨RGDS在BG对hDPCs增殖、矿化作用中的影响。
BG为60%(质量分数)SiO2、36%(质量分数)CaO和4%(质量分数)P2O5, 颗粒大小约500 nm(华南理工大学生物医学工程中心制备)。RGDS由北京中科亚光生物科技有限公司合成, 纯度98.5%。
本研究使用的主要试剂有达尔伯克必需基本培养基(Dulbecco’ s minimum essential medium, DMEM)、3%(质量分数)Ⅰ 型胶原酶、0.25%(质量分数)胰蛋白酶-EDTA(trypsinase-ethylene diaminetetraacetic acid)(GIBCO公司, 美国), 青霉素、链霉素、L-谷氨酰胺、茜素红溶液(Sigma公司, 美国), 胎牛血清(fetal bovine serum, FBS)(090620, 元亨金马生物技术开发有限公司, 中国), 测定细胞增殖用试剂包括噻唑蓝溶液[(4, 5-dimethyhhiazol-2)2, 5-diphenyl tetrazoliumbromide, MTT]、二甲基亚砜(dimethyl sulfoxide, DMSO)(Amresco公司, 美国)、氯化十六烷吡啶(国药集团化学试剂有限公司, 中国)。
本研究使用的主要仪器有超净工作台(Steril CARD Ⅲ , BAKER公司, 美国), 恒温振荡器(Eppendoff公司, 美国), 离心机(X22R, Beckman Coulter公司, 美国), 6孔板、12孔板、96孔板(Corstar公司, 美国), 倒置显微镜(TSI00, Nikon公司, 日本), CO2孵箱(SERIES Ⅱ , ThermoForma公司, 美国), 酶标仪(ELX808, BioTek公司, 美国), 电热恒温水箱(HHW21-Cr, 长安科学仪器厂, 中国), 0.22 μ m滤器(Millex® GP Filter Unit公司, 爱尔兰)。
收集完整的无牙体、牙髓疾病, 无牙周炎的新鲜拔除第三磨牙(16~29岁, 患者知情同意, 由北京大学口腔医院外科门诊提供), 无菌条件下使用含250 U/mL青霉素/链霉素双抗的D-Hanks液冲洗牙齿3次, 去除牙冠, 取出牙髓组织。使用含双抗的D-Hanks液冲洗牙髓组织3次后剪碎, 0.3% Ⅰ 型胶原酶消化50 min, 终止消化后离心5 min, 收集沉淀物, 置于60 mm培养皿, 加入含20%(体积分数)FBS、1%青霉素/链霉素双抗的DMEM培养基5 mL, 置37 ℃、5%(体积分数)CO2细胞培养箱中培养, 24 h换液, 观察组织块周围有细胞爬出后, 每隔2~3 d换液, 待细胞70%~80%汇合时按1 :2比例传代, 使用第4~6代细胞用于后续试验。
称取10 mg BG粉末, 于180 ℃烤箱4 h高温灭菌, 冷却后加入100 mL DMEM培养基, 于37 ℃、100 r/min摇动浸提24 h, 使用0.22 μ m滤器过滤后取滤液为BG浸提液。分别溶解RGDS粉末加入BG浸提液中, 配成不同质量浓度的BG+RGDS浸提液(12.5 mg/L、25.0 mg/L、50.0 mg/L、100.0 mg/L、200.0 mg/L), 用于后续实验。
实验分为DMEM培养基对照组、BG浸提液组及上述5个不同质量浓度的BG+RGDS复合组。取hDPCs按3× 103/孔的细胞密度接种于96孔板中, 每组设5个复孔, 于4 h小心洗去未黏附的细胞及死细胞, 使用MTT法测定光密度值(D)检测细胞黏附能力。每2天换液1次, 于培养第1、3、5、7、9天使用MTT法测定D值检测细胞增殖能力。测定方法如下:PBS冲洗3次, 每孔加入20 μ L MTT溶液, DMEM培养液补足至200 μ L, 置于37 ℃细胞培养箱内孵育4 h后, 用1 mL注射器小心吸干孔内液体, 每孔加入150 μ L DMSO, 摇床振荡至结晶充分溶解, 在酶联免疫检测仪上测定570 nm波长处各孔的D值。
使用茜素红钙化结节染色及氯化十六烷基吡啶(cetylpyridinium chloride, CPC)半定量分析检测各组材料对hDPCs矿化作用的影响。将hDPCs以5× 104/孔的细胞密度接种于24孔板中, 置于37 ℃、5% CO2的培养箱中孵育过夜, 待细胞80%~90%汇合时加入矿化诱导培养基, 培养2周, 每2天换液。分为生物活性玻璃浸提液组(BG组), 含50.0 mg/L RGDS培养基组(RGDS组), 生物活性玻璃浸提液中加入50.0 mg/L RGDS组(BG+RGDS组), 以矿化诱导培养基作为阳性对照组, 未加入矿化诱导液的培养基作为阴性对照组, 分别于2、4周后进行体外矿化检测。测定方法如下:吸净待测孔中的培养基, PBS冲洗3次, 2 mL 4%(体积分数)多聚甲醛固定过夜, Milli-Q水冲洗3次。室温下加入等量40 mmol/L pH 4.2的茜素红溶液染色10 min, 去离子水冲洗去除非特异性染色, 倒置显微镜下观察、拍照。每孔彻底干燥后, 使用100 mmol/L CPC溶解结节, 取150 μ L液体放入96孔板, 测定570 nm处D值。
使用SPSS 19.0统计软件, 各组间增殖、矿化和黏附的差别经方差齐性检验方差齐后, 采用单因素方差分析。在组间差异有统计学意义时, 采用LSD检验进行两两比较, 双侧检验, P< 0.05为差异有统计学意义。
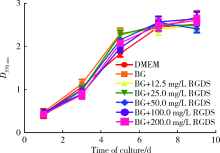
BG浸提液中加入不同质量浓度的RGDS(12.5 mg/L、25.0 mg/L、50.0 mg/L、100.0 mg/L、200.0 mg/L)对hDPCs增殖的作用见图1。第1天时, 12.5、25.0和200.0 mg/L组的细胞数量显著少于BG组(F=7.19, P< 0.05), 第3天时, 含RGDS的各组细胞数量显著少于BG组(F=28.55, P< 0.05), 其余时间点RGDS各组与BG组及DMEM培养基对照组的细胞增殖差异无统计学意义。
BG浸提液中加或未加入50.0 mg/L RGDS对hDPCs矿化的作用见图2。矿化结节半定量实验结果见图3, 结果显示, 2周时BG组及BG+RGDS组可见少量矿化结节生成, 这两组与其余3组相比差异有统计学意义(F=318.97, P< 0.05); 4周时, 阳性对照组、RGDS组、BG组和BG+RGDS组均见矿化结节生成, BG组和BG+RGDS组与其余3组相比差异有统计学意义, 阳性对照组和RGDS组与阴性对照组相比差异有统计学意义(F=106.71, P< 0.05), 而BG+RGDS组与BG组相比、RGDS组与阳性对照组相比差异无统计学意义。
BG浸提液中加入不同质量浓度的RGDS对hDPCs在BG作用下黏附于培养皿底的影响见图4。在接种细胞后4 h, DMEM培养基组与BG组的细胞数量差异无统计学意义, BG+RGDS各组与DMEM组相比细胞数量均显著降低(F=10.53, P< 0.05), 含50.0、100.0、200.0 mg/L RGDS组与BG组相比细胞数量均显著降低(F=10.53, P< 0.05)。总体来说, RGDS浓度越高, 细胞在BG作用下对培养皿底的黏附数目越少。
通过组织工程学进行牙髓再生必需3个条件:种子细胞、生长因子和支架[8]。研究表明, BG能够促进hDPCs的增殖和分化[5, 6, 7], 在复合了BG的胶原支架上, hDPCs的增殖和分化比胶原支架活跃[9]。在此基础上, 添加生物活性多肽成分可能进一步调控细胞在支架上的迁移、黏附、生长、增殖以及分化过程, 为此, 本研究考察了RGDS是否影响BG对hDPCs的作用。
在使用MTT液检测RGDS各质量浓度组对hDPCs增殖影响的实验中, 早期(1、3 d)可以观察到培养基中含有游离RGDS的各组, 黏附于皿底的hDPCs数量较少, 随着培养时间的增加, 第5、7、9天各组之间的细胞数量差异没有统计学意义, 这表明RGDS没有抑制BG对hDPCs的增殖作用, 不具有细胞毒性。
本研究中, BG浸提液培养hDPCs组在2周时即产生矿化结节, 4周时可见大量矿化结节, 半定量实验显示与DMEM培养基对照组相比差异有统计学意义, 提示BG在矿化方面明显优于对照组。BG能释放出硅离子诱导羟磷灰石沉积, 激活成骨细胞基因, 从而促进矿化成骨[10]。有研究将BG植入动物体内并观察到新骨形成[11], 亦有多个研究证明BG具有促进hDPCs分化、矿化的作用[2, 7, 9]。本研究在BG浸提液中加入RGDS后培养hDPCs, 2周及4周时矿化结节半定量实验显示与DMEM培养基组差异有统计学意义, 与未加RGDS的BG浸提液组相比差异无统计学意义, 说明RGDS不会影响BG对hDPCs的促矿化作用。
细胞黏附一般发生于细胞接种的1~4 h, 本研究中4 h的MTT实验证明BG浸提液加入不同质量浓度的RGDS后, 与未加入RGDS的BG浸提液组相比, 均能抑制hDPCs在BG作用下对培养皿底的黏附。细胞黏附包括细胞附着、细胞铺展、细胞骨架调整和黏着斑形成, 细胞表面的整合素参与最早期的细胞附着过程。以往的研究发现, 含RGD序列的作用是与细胞表面的整合素结合而实现的, hDPCs表面存在有整合素α vβ 3, 并且能与材料上的RGD序列结合, 产生增加hDPCs黏附的效果[12]。正是由于RGD序列的作用特点, 当它处于游离态的时候会占据细胞表面整合素位点, 从而抑制细胞向胞外基质黏附。RGDS是在RGD序列的C端修饰一个丝氨酸(S), 从而提高黏附活性[3]。本研究中BG+RGDS组的细胞黏附数目低于BG组, 由此考虑游离的RGDS能够与hDPCs表面的黏附位点结合, 从而进一步降低了细胞在BG作用下对培养皿底的黏附, 同时由于皿底黏附的细胞数量少, 导致在增殖早期检测出的细胞数量也相对较少。
本研究结果表明, 培养基中游离态RGDS不影响BG对hDPCs增殖及矿化的促进作用, 但影响hDPCs向培养皿底的黏附, 进一步的研究将把RGDS与BG枝接, 以达到利用RGDS调控细胞在BG支架上迁移、黏附和生长的目的。
(本文编辑:任英慧)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|