目的 明确生物活性玻璃(bioactive glass, BG)和牙本质浸提蛋白(extracted dentin proteins, EDP)对人牙髓细胞增殖、成牙本质向分化、矿化的作用。方法 采用酶消化法培养牙髓细胞,传代至第4代用于实验。分别用含BG-EDP浸提液、BG浸提液、EDP浸提液的达尔伯克必需基本培养基(Dulbecco’s minimum essential medium,DMEM)培养牙髓细胞,对照组为DMEM培养组;通过细胞活性噻唑蓝比色法检测细胞增殖能力,碱性磷酸酶(alkaline phosphatase,ALP)活性检测及real-time PCR检测细胞成牙本质向分化能力,茜素红钙化结节染色及氯化十六烷基吡啶半定量分析检测细胞矿化能力。结果 BG-EDP组3、7、9 d时(光密度值1.36±0.06、2.52±0.20 、2.72±0.29)能够增强人牙髓细胞增殖活性,同BG组(光密度值1.20±0.26、2.33±0.26、2.50±0.30)、EDP组(光密度值1.13±0.15、2.10±0.13、2.38±0.22)和对照组(光密度值0.84±0.17、1.84±0.18、1.95±0.19)比较差异具有统计学意义( P<0.05)。7 d时,BG-EDP组ALP活性与EDP组、对照组差异无统计学意义,分化相关基因( DSPP、 DMP-1)表达无明显升高。14 d时,BG-EDP组ALP活性升高(56.67±1.83), 显著高于EDP组(41.98±9.71)及对照组(30.82±6.70), P<0.05,但同BG组(56.29±6.20)相比差异无统计学意义( P>0.05);BG-EDP组 DSPP表达量明显升高(5.79±1.94),显著高于BG组(2.62±0.46)、EDP组(2.66±1.06)及对照组(1.84±0.76), P<0.05;BG-EDP组 DMP-1表达升高(3.87±1.87),略高于BG组(1.89±0.90)、EDP组(2.38±1.04)和对照组 (2.25±0.93),但差异无统计学意义( P>0.05)。诱导2周后,BG-EDP组形成较多矿化结节,氯化十六烷基吡啶半定量分析显示BG-EDP组钙化量最高(0.27±0.01)。结论 同单纯的BG及EDP相比,BG-EDP复合后具有更强的促进人牙髓细胞的增殖、成牙本质向分化、矿化作用。
Objective: To investigate the proliferation, odontogenic differentiation and mineralization of human dental pulp cells (HDPCs) on bioactive glass(BG) and extracted dentin proteins(EDP). Me-thods: Primary HDPCs were isolated from third molars by enzyme digestion and were cultured in Dulbecco’s minimum essential medium (DMEM). Then the 4th generation of HDPCs was cultured with DMEM, which contained BG-EDP, BG, and EDP, respectively. Meanwhile HDPCs were cultured in DMEM as control group. Proliferation of HDPCs was evaluated by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide(MTT) colorimetric assay. Odontogenic differentiation was determined by alkaline phosphatase (ALP) activity assay and real-time PCR. Mineralization was investigated by Alizarin red staining and cetylpyridinium chloride (CPC) assay.Results: The proliferation of HDPCs was increased significantly in BG-EDP group on 3,7,and 9 d(optical density value:1.36±0.06, 2.52±0.20, 2.72±0.29) compared with BG(optical density value: 1.20±0.26,2.33±0.26,2.50±0.30),EDP(optical density value: 1.13±0.15, 2.10±0.13, 2.38±0.22) and control group(optical density va-lue: 0.84±0.17, 1.84±0.18, 1.95±0.19), P<0.05. After 7 days, ALP activity of BG-EDP group had no statistical difference compared with EDP group and control group; the expression of odontogenic differentiation genes (DSPP, DMP-1) showed no difference among all the groups( P>0.05). After 14 days, ALP activity of BG-EDP group (56.67±1.83) was significantly upregulated compared with EDP group (41.98±9.71) and control group (30.82±6.70), P<0.05, but had no statistical difference compared with BG group (56.29±6.20), P>0.05; DSPP gene expression was upregulated significantly in BG-EDP group (5.79±1.94) compared with the other groups ( P<0.05); DMP-1 gene expression of BG-EDP group (3.87±1.87) increased but had no statistical difference compared with the other groups ( P>0.05). The alizarin red staining showed more mineral nodules in BG-EDP group, the cetylpyridinium chloride semi-quantification presented higher calcification in BG-EDP group (0.27±0.01) compared with the other groups ( P<0.05).Conclusion: Compared with either BG or EDP, BG-EDP significantly promotes the proliferation, odontogenic differentiation and mineralization of HDPCs.
采用组织工程学手段诱导牙髓-牙本质复合体再生, 是修复因龋损、外伤等原因丧失的牙齿组织、恢复牙齿功能的更为理想的方法[1]。目前用于研究诱导牙本质和牙髓再生的材料有很多, 其中生物活性陶瓷类材料以其良好的生物诱导活性被广泛关注, 如Peng等[2]研究发现体外Ca3SiO5能够促进牙髓细胞的增殖和成牙本质向分化。本课题组近期的研究也发现, 生物活性玻璃(bioactive glass, BG), 尤其是新型纳米BG, 不仅具有良好的生物相容性, 能够促进人牙髓细胞的增殖, 同时能够促进人牙髓细胞的成牙本质向分化及矿化作用[3, 4, 5]。
生物活性因子对细胞的成牙本质向分化、牙本质的形成同样具有重要的作用。有学者将生物活性因子骨形态发生蛋白-2(bone morphogenetic protein, BMP-2)加载于BG支架上, 发现该复合支架能显著提升新骨的形成能力[6], 生物活性因子的加入能提升生物材料的活性。牙本质浸提蛋白(extracted dentin proteins, EDP)是使用浸提法处理牙本质后得到的有机活性成分, 是含有多种蛋白质、生长因子等的混合物[7, 8], 成分包括Ⅰ 型胶原蛋白(collagen-Ⅰ , COL-Ⅰ )、牙本质基质蛋白-1(dentin matrix protein-1, DMP-1)、牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)、转化生长因子-β 1(transforming growth factor-β 1, TGF-β 1)等[9, 10]。EDP能够促进牙髓细胞及前体细胞的增殖和矿化, 提高碱性磷酸酶(alkaline phosphatase, ALP)活性, 增强分化相关基因(DSPP、DMP-1等)的表达, 促进成牙本质向分化[11, 12, 13, 14]。
考虑到BG对牙髓的组织诱导作用, 以及牙本质浸提液中含有的多种促进牙本质形成的蛋白质和生长因子, 推测构建二者合一的复合材料可能成为诱导牙髓牙本质复合体再生的理想材料, 因此, 本研究选取这两种材料, 旨在观察BG和EDP对牙髓细胞的增殖和分化是否具有协同作用, 从而为下一步构建具有更好组织诱导性的装载EDP的BG复合材料提供理论依据。
高糖型达尔伯克必需基本培养基(Dulbecco’ s modified eagle medium, DMEM)、0.25%(质量分数)胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA )购自美国GIBCO公司, Milli-Q水购自美国-Millipore公司, 青霉素、链霉素、L-谷氨酰胺、TritonX-100(分析纯)、茜素红溶液购自美国-Sigma公司, 特级胎牛血清购自中国-北京康源生物公司, 甲基噻唑基四唑[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, MTT]、二甲基亚砜(dimethyl sulphoxide, DMSO)购自美国-Amresco公司, 聚氰基丙烯酸正丁酯(bicinchoninic acid, BCA)蛋白定量试剂盒购自中国-北京康为世纪生物科技有限公司, ALP活性检测试剂盒购自中国-南京建成科技有限公司, Trizol购自美国Invitrogen公司。
1.2.1 人牙髓细胞(human dental pulp cells, HDPCs)的体外培养 本实验获得北京大学口腔医院医学伦理委员会批准, 研究对象均签署知情同意书。收集新鲜拔除的健康、完整第三磨牙(16~29岁, 由北京大学口腔医学院口腔颌面外科门诊提供), 浸泡于含250 U/mL青霉素/链霉素的D-HANKS液。无菌条件下, 使用含双抗的D-HANKS液冲洗牙齿3次, 随后去除牙冠, 取出牙髓组织。用含双抗的D-HANKS液冲洗牙髓组织3次, 剪碎牙髓组织后用3 g/L的Ⅰ 型胶原酶消化50 min, 随后终止消化并离心5 min。收集细胞及组织块, 置入60 mm培养皿, 加入含10%(体积分数)胎牛血清(fetal bovine serum, FBS, 体积分数)、1%(体积分数)L-谷氨酰胺及1%(体积分数)青霉素/链霉素的DMEM培养基5 mL, 放于37 ℃、5%CO2培养箱中培养, 24 h后换液, 观察至组织块周围有细胞生长, 记为原代细胞, 此后每隔2~3天换液。待细胞生长面积达培养皿底面积75%时按1 :2比例传代, 收集第4代细胞用于后续实验。
1.2.2 EDP的制取 收集新鲜拔除的健康、完整牙齿, 浸泡于250 U/mL青霉素/链霉素的D-HANKS液中。去净牙齿表面软组织, 蒸馏水冲洗牙齿, 去除釉质、牙骨质、牙髓并清理髓腔及根管, 制得牙本质块, 干燥并称取牙本质块重量。无菌条件下, 将制得的牙本质块超声冲洗, EDTA(17%、10%、5%, 质量分数)梯度脱钙, 粉碎, 并浸泡于4 ℃的青霉素/链霉素双抗中2 d。随后弃双抗, 按1 :5比例(200 g/L)将牙本质粉加入DMEM培养基中, 37 ℃培养箱浸提1周, 期间每2天换液1次, 收集所得全部浸提液用于下一步实验。
1.2.3 BG浸提液的制备 实验所用BG由华南理工大学生物医学工程中心提供, 组分为60%(质量分数)SiO2、36%CaO和4%P2O5, 粒径大小约为500 nm。称取10 mg 500 nm BG粉末, 180 ℃高温灭菌4 h, 冷却2 h。加入100 mL DMEM培养基, 37 ℃、100 转/ min摇动浸提24 h, 用0.22 μ m滤器过滤后, 取滤液(0.1 g/L)用于下一步实验。
1.2.4 实验分组 实验分为BG-EDP复合浸提液组、BG浸提液组、EDP浸提液组及对照组(等体积DMEM培养基组)4组。
1.2.5 MTT法测定牙髓细胞增殖能力 通过MTT比色法检测HDPCs增殖能力, 取HDPCs按照3× 103个/孔的细胞密度接种于96孔板中培养, 每个检测时间点每组设置5个复孔。接种24 h后换液, 换液时分别加入各组培养基并记为第0天, 此后每2 天换液一次, 培养第1、3、5、7、9天测定细胞的光密度值。测定方法如下:每孔更换新鲜各组培养液180 μ L, 同时加入20 μ L的新鲜MTT溶液(5 g/L), 置37 ℃培养箱内孵育4 h后, 用1 mL注射器小心吸干孔内液体, 每孔加入150 μ L DMSO, 置摇床上振荡10 min, 观察至结晶物充分溶解。用酶联免疫检测仪测定D570 nm波长处各孔的光密度值。
1.2.6 ALP活性的检测 将HDPCs以3× 104个/孔的细胞密度接种于24孔板, 置于37℃、5% CO2 培养箱中孵育, 24 h后, 分别加入各组培养基, 培养7、14 d, 每隔2天换液。第7、14天时弃各孔内培养基, PBS冲洗HDPCs 3次, 0.1%(体积分数)Triton打孔细胞15 min, 用细胞刮刀收集细胞至1.5 mL离心管。冰上超声破碎细胞, 离心取上清液。分别使用BCA蛋白定量检测盒及AKP检测盒测定上清液中蛋白含量及ALP活性。
1.2.7 Real-time PCR检测牙髓细胞成牙本质向分化相关基因的表达 使用real-time PCR测定牙髓细胞分化相关基因(DSPP、DMP-1)的表达, 方法如下, 将HDPCs以1.5× 105个/孔的细胞密度接种于6孔板中, 置于37 ℃、5% CO2 培养箱中孵育, 24 h后, 加入各组培养基, 分别培养7、14 d, 每隔2天换液。7、14 d时, 弃各孔中培养基, PBS冲洗细胞3次, 按厂商说明使用Trizol提取总RNA。取2 μ L RNA用于纯度和浓度检测, 其余置于-80 ℃冰箱保存, 备用。RNA加入Oligo(dT)及DEPC水, 混匀后70 ℃条件下将RNA预变性5 min后, 迅速将其放入冰上。加入逆转录cDNA体系, 42 ℃, 60 min, 95 ℃终止5 min, 冰上冷却, 置于-20 ℃冰箱保存, 备用。使用SYBR® 预混酶体系在实时定量PCR仪上检测DSPP, DMP-1及GAPDH, 采用2-Δ Δ Ct法进行数据分析。
1.2.8 茜素红染色检测牙髓细胞矿化作用 使用茜素红钙化结节染色及氯化十六烷基吡啶(cetylpyridinium chloride, CPC)半定量分析检测各组材料对牙髓细胞矿化作用的影响。将HDPCs以3× 104 个/孔的细胞密度接种于24孔板中, 置于37 ℃、5% CO2的培养箱中孵育过夜, 待细胞80%~90%汇合时加入矿化诱导培养基, 培养2周, 每2天换液。2 周后进行体外矿化检测:吸净待测孔中的培养基, PBS冲洗3次, 2 mL 4%(体积分数)多聚甲醛固定过夜, Milli-Q水冲洗3次。室温下每孔加入500 μ L茜素红溶液(40 mmol/L, pH=4.2)染色10 min, 去离子水冲洗去除非特异性染色。倒置显微镜下观察、拍照。每孔彻底干燥后, 使用100 mmol/L CPC溶解结节, 取200 μ L液体放入96孔板, 测定D570 nm处光密度值。
使用SPSS 19.0软件, 用双因素多水平析因设计资料的方差分析对BG和EDP的交互作用进行统计分析, 并使用单因素方差分析(One-way ANOVA)/Tukey检测方法进行多组间两两比较, P< 0.05为差异有统计学意义。
使用MTT法检测牙髓细胞的增殖情况, 结果显示随着细胞培养时间延长, 各实验组牙髓细胞的增殖均呈上升趋势; 从培养第3天开始, BG-EDP组、BG组、EDP组光密度值均高于对照组, 且在培养的第3、7、9天BG-EDP组光密度值高于BG组及EDP组, 经统计学处理, 差异均有统计学意义(P< 0.05, 图1), BG-EDP组对人牙髓细胞的增殖活性的增强高于单独的BG组或EDP组。
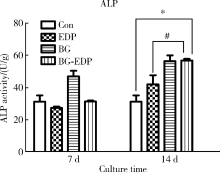
7 d时, BG-EDP组牙髓细胞的ALP活性值与EDP组及对照组差异无统计学意义(P> 0.05)。14 d时, BG-EDP组、BG组和EDP组牙髓细胞ALP活性值升高, 均高于对照组, 其中BG-EDP组ALP活性显著高于EDP组(P< 0.05), 但同BG组差异无统计学意义(P> 0.05, 图2)。
采用real-time PCR检测牙髓细胞成牙本质向分化相关基因DSPP、DMP-1的表达水平, 结果显示, DSPP基因表达量, 7 d时BG-EDP组同BG组、EDP组及对照组相比差异无统计学意义(P> 0.05); 14 d时, BG-EDP组DSPP基因表达量显著高于BG组、EDP组和对照组, 差异有统计学意义(P< 0.05)。DMP-1基因的表达量, 在第7天时BG-EDP组同BG组、EDP组、对照组相比差异无统计学意义(P> 0.05); 14 d时BG-EDP组、BG组、EDP组DMP-1表达量均有上调, BG-EDP组略高于BG组、EDP组和对照组, 但各组间差异无统计学意义(P> 0.05, 图3)。
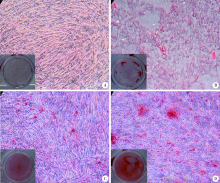
使用茜素红钙化结节染色及氯化十六烷基吡啶(cetylpyridinium chloride, CPC)半定量观察分析各组材料对牙髓细胞矿化的影响, 结果发现牙髓细胞培养2周后, BG-EDP组牙髓细胞中钙化结节形成多且大, BG组和EDP组及对照组矿化结节形成较少(图4)。CPC半定量分析结果显示BG-EDP组、BG组、EDP组钙离子浓度均高于对照组, 且BG-EDP组显著高于BG组、EDP组和对照组, 差异有统计学意义(P< 0.05, 图5)。
牙本质的形成和矿化是一个复杂的过程, 其中牙髓细胞的成牙本质向分化是牙髓牙本质复合体修复及再生的关键。细胞的成牙本质向分化是由多个基因参与调控的复杂过程, 涉及到生长因子、牙本质基质蛋白等分子信号对相关信号通路的激活, 刺激下游基因的表达, 进而引起细胞趋化、分化和矿化等过程[15]。
BG植入体内后, 表面可形成羟基磷灰石晶体, 介导胶原纤维和细胞等骨组织和软组织的紧密结合[16]。BG还会释放硅、钙、磷等离子, 进而促进细胞增殖, 刺激成骨相关基因的表达, 形成有利于细胞生长微环境[17]。研究发现BG能够促进牙髓细胞增殖、DMP-1, DSPP, ALP, Collagen type Ⅰ 基因表达增强、矿化结节形成增加, 异位移植BG能够诱导含小管样结构的牙本质形成, 说明BG对牙髓细胞的增殖和分化具有良好的诱导作用[3, 4, 5]。
同BG不同, EDP通过刺激骨涎酸蛋白(bone sialoprotein, BSP)、DSPP、骨钙蛋白(osteocalcin, OCN)等基因的表达, 促进牙髓细胞中干细胞的聚集, 进而刺激其增殖、分化。天然牙本质中主要成分为羟基磷灰石晶体, 有机成分约占重量比的20%, 有机物中胶原成分占85%~90%[8, 13]。在处理后的牙本质浸提液中, EDP的成分较为复杂, 有约289种蛋白质[7], 这些蛋白质既是牙本质基质的重要组成成分, 也是调控牙本质形成和矿化的关键因素, 同BG通过离子的释放来发挥其生物学作用不同, 这些蛋白质可通过产生酶进而改变某些蛋白质的功能或通过调控离子的转运来发挥促进细胞和胞外基质的成核或促进矿化发生在正确的位点等功能[1]。DMP-1能够同胶原的N-端肽链特异性结合, 影响胶原纤维的形成, 牙本质磷蛋白(dentin phosphoprotein, DPP)促进成核并能调控晶体的生长和生长方向, 可能参与Ca2+的转运[18, 19], 这些蛋白质和BG释放的Si2+、Ca2+等可能产生协同作用, 进一步促进牙本质的再生。
ALP在硬组织形成过程中具有促进钙化的作用, 是细胞外基质分化和矿化的标记物[1]。DSPP和DMP-1基因位点临近, 基因结构和蛋白产物结构相似, 是对成牙本质向分化有重要影响的基因[19], 因此本研究选择ALP、DSPP基因、DMP-1基因作为牙髓细胞成牙本质向分化的标志物。宫玮玉[20]的研究中证实生物活性玻璃能够激活 ERK 通路和 p38 通路, 提高磷酸化活化蛋白的表达水平, 促进下游矿化相关基因的表达。Yu等[21]通过Western blot检测观察到牙本质基质蛋白能够激活骨髓间充质干细胞 MAPK通路中的ERK和p38通路, 促进细胞成牙本质及成骨方向分化。本研究结果显示, BG-EDP组牙髓细胞增殖活性、DSPP基因表达量高于BG组、EDP组及对照组, ALP活性高于EDP组及对照组。BG-EDP不仅具有促进牙髓细胞增殖、分化和矿化的作用, 且与单独的BG组和EDP组相比其作用更加显著, 提示BG和EDP可协同相互作用, 进一步增强对牙髓细胞的增殖、分化和矿化的作用。
综上所述, BG-EDP可促进人牙髓细胞的增殖、分化和矿化, 提高了牙髓细胞的成牙本质向分化能力, BG与EDP复合有可能在促进牙本质再生、恢复牙髓功能等方面具有重要的潜力。
(本文编辑:刘淑萍)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|