目的 研究低能量激光照射(low level laser irradiation,LLLI)的照射剂量对人脂肪基质细胞(human adipose-derived stromal cells,hASCs)增殖与分化作用的影响,为LLLI进一步在骨组织工程中的应用奠定基础。方法 将P4代hASCs接种于孔板中,24 h后利用半导体激光器(980 nm,100 mW~12 W)连续照射4 d。以增殖培养基为空白对照组(PM组),实验组接受2、4、6、8 J/cm2的激光照射,连续7 d进行细胞计数试剂盒(cell counting kit-8,CCK-8)增殖检测。当细胞达到70%的融合后将一半细胞更换为成骨培养基(osteogenic medium,OM),根据培养基及累计接受的激光总能量密度分为6组:PM、OM、PM+LLL$I_{2J/cm^{2}}$、OM+LLL$I_{2J/cm^{2}}$、PM+LLL$I_{4J/cm^{2}}$、OM+LLL$I_{4J/cm^{2}}$。于第7天进行碱性磷酸酶(alkaline phosphatase,ALP)染色及定量检测,于第14、21天进行矿化沉积检测,于第7、14天进行实时定量PCR检测成骨相关基因的表达,探究低能量激光对hASCs成骨分化的影响,结果采用SPSS 19.0软件进行统计学分析。结果 PM+LLL$I_{4J/cm^{2}}$组细胞增殖速率最快,OM各组的ALP染色均呈阳性表达,且染色深度随激光能量密度的增高而加重。第14天时,OM各组随激光照射能量升高,矿化结节体积明显增大、数目增多;第21天时,OM组间茜素红染色结果无明显差异。ALP及茜素红定量结果均与相应染色结果趋势一致。hASCs实时定量PCR结果提示,LLLI可促进ALP和Runx2的表达,且促进作用与照射剂量呈正相关。结论 LLLI具有促进hASCs增殖分化的作用,且在一定剂量范围内,这种促进作用会随照射剂量的增大而加强,当达到峰值后随照射剂量的增大而减弱。
Objective: To examine the in vitro effects of low-level laser irradiation (LLLI) on proliferation and differentiation of human adipose-derived stromal cells(hASCs).Methods: Cultured cells were exposed to different doses of LLLI with a semiconductor diode laser (980 nm; 100 mW-12 W power output). The effects of laser on proliferation were assessed daily up to seven days of culture in cells irradiated for four consecutive days with laser doses of 2, 4, 6 or 8 J/cm2, the cells without irradiation were used as controls. Half of the cells were changed to osteogenic medium (OM) when they had grown to 70% confluence. The hASCs both with and without osteogenic supplements were divided into three groups, and each group was irradiated at doses of 0, 2 and 4 J/cm2. In order to examine the in vitro effects of LLLI on osteogenic differentiation of hASCs, the alkaline phosphatase activity was assessed on day 7, and alizarin red staining (AR-S) and quantitative detection were assessed on days 14 and 21. The expression of osteoblast master genes (ALP and Runx2) were tested on days 7 and 14.Results: The proliferation medium(PM)+LLL$I_{4J/cm^{2}}$ group had the highest multiplication rate. In the groups with osteogenic supplements, LLLI increased alkaline phosphatase activity and mineralized nodule formation, and stimulated the expression of ALP and Runx2. Furthermore, the effect became more obvious at high dose.Conclusion: Our data demonstrated that hASCs proliferation and osteogenic differentiation were enhanced by LLLI. With the increase of laser dose, the effect of LLLI would be enhanced at first, and then be decreased after reaching a peak.
人脂肪基质细胞(human adipose-derived stromal cells, hASCs)作为间充质干细胞的一种, 具有容易分离扩增、自我更新、多向分化和低免疫原性等特性, 被认为是目前组织工程和再生医学中理想的种子细胞[1]。如何能有效促进hASCs增殖并诱导其成骨向分化, 进而实现骨组织的修复与再生, 已经成为骨组织工程的一项挑战。
低能量激光是指波长在600~1 100 nm、输出功率不超过500 mW的红色光束或近红外激光, 其能量密度在0.04~50 J/c
本研究以不同激光能量密度分组, 研究LLLI的照射剂量对hASCs增殖与分化作用的影响, 为LLLI进一步在骨组织工程中的应用奠定基础。
主要设备:激光发生器(A.R.C, 德国), 激光功率测量仪(OPHIR, 以色列), JY300C电泳仪(北京君意东方电泳设备有限公司), JY300C电泳槽(北京君意东方电泳设备有限公司), ChampGel 5000凝胶成像仪(北京赛智创业科技有限公司), SMA-1000分光光度计(北京美林恒通科技有限公司), StepOne Plus实时定量PCR仪(美国ABI公司)。
主要试剂与材料:hASCs细胞株购自美国ScienCell公司; 碱性磷酸酶(alkaline phosphatase, ALP)活性定量检测试剂盒购自南京建成公司; ALP染色试剂盒、THiFiScript cDNA第一链合成试剂盒均购自北京康为世纪生物科技有限公司; BCA蛋白定量试剂盒购自美国Thermo公司; 细胞计数试剂盒(cell counting kit-8, CCK-8)、茜素红、TritonTM X-100、氯化十六烷基吡啶以及成骨向分化诱导因子β -甘油-2-磷酸二钠盐水合物、抗坏血酸、地塞米松均购自美国Sigma公司; Trizol 试剂购自美国Invitrogen公司, qPCR试剂盒购自美国KAPA Biosystems公司; DMEM(Dulbecco’ s modified Eagle’ s medium)培养基、胎牛血清(fetal bovine serum, FBS)、100× 细胞培养用青链霉素混合液均购自美国Gibco公司; 细胞培养皿等耗材购自美国Corning公司。
将P0代hASCs加入增殖培养基, 培养基成分为DMEM+10%(体积分数)FBS+1%(体积分数)青链霉素, 置于含5%(体积分数)CO2、95%(体积分数)空气的37 ℃恒温培养箱中进行培养。培养至7 d左右, 细胞生长至70%~80%汇合状态后进行细胞传代, 每个培养皿中的细胞经过胰酶消化、中和、离心和重悬后, 接种至3个培养皿中, 每5~7天汇合度达到80%~90%后再次进行传代, 传代4次后的hASCs标记为P4代, 作为实验所用种子细胞。
搭建低能量激光实验平台。本实验采用了半导体激光器, 波长为980 nm, 输出功率为100 mW~12 W。将光纤置于暗盒中, 激光光束从暗盒下方的圆孔中发出, 使得光斑呈规则圆形。照射时, 将培养皿盖打开, 并在培养皿下方垫以不透光黑纸, 避免激光发生反射。通过调整光纤头至被照表面距离来调节光斑大小, 使得光斑面积与被照培养皿表面积一致, 照射过程在生物安全柜中进行, 避免细菌污染。用激光功率测量仪测量被照表面实际接收功率, 得出功率密度, 照射时间的计算方法为:照射时间(s)=能量密度(J/cm2)/功率密度(W/cm2)。
P4代hASCs按照每孔2 000~3 000个细胞接种96孔板, 加入增殖培养基培养。为避免不同组间激光照射的相互影响, 每组细胞接种于不同的96孔板, 调整光斑直径为0.6 cm, 光纤头至被照表面距离为2 cm, 功率密度为141.5 mW/cm2。在细胞接种24 h后进行第1次激光照射, 记为第0天, 并于第0~3天连续照射4 d。以增殖培养基为空白对照组, 记为PM组; 实验组接受不同能量密度的激光照射, 以4 d累计接受的总能量密度分组:PM+LLL
P4代hASCs按照每孔5× 104个细胞接种于6孔板中, 当细胞达到70%的融合后将一半细胞更换到成骨培养基(osteogenic medium, OM)中, 培养基成分为DMEM+10%FBS+100 nmol/L地塞米松+0.2 nmol/L抗坏血酸+10 nmol/L β -甘油磷酸+1%青链霉素, 并将该天设置为第0天。调节光斑直径为3.5 cm, 光纤头至被照表面距离为14.3 cm, 于第0~3天连续照射4 d。实验设计详见表1。
| 表1 hASCs成骨分化能力检测实验设计 Table 1 Experimental design about the osteogenic differentiation of hASCs |
1.4.1 ALP定性及定量检测 染色步骤按照商品说明书进行, 以细胞胞浆呈现蓝紫色判断染色为阳性; 定量检测按照ALP活性定量检测试剂盒进行; 细胞总蛋白定量依照BCA定量检测试剂盒说明进行。每组重复3 孔, 检测时每孔重复2次, 每组共6个数据进行统计学分析。
1.4.2 矿化沉积检测 使用0.1%(质量分数)茜素红溶液进行矿化沉积染色及定量检测, 以细胞间质中出现红染结节判断为阳性。显微镜下观察后加入1%(质量分数)十六烷基吡啶溶液, 待完全溶解后, 吸取100 μ L至96孔板, 在490 nm波长下测光密度值。
1.4.3 实时定量PCR检测低能量激光对hASCs成骨相关基因表达的影响 实时定量PCR检测成骨相关基因碱性磷酸酶(alkaline phosphatase, ALP)及Runt相关转录因子-2(runt-related transcription factor 2, Runx2)的表达。用Trizol裂解细胞, 提取总RNA, 取2 μ L提取好的总RNA, 1.2%(质量分数)琼脂糖凝胶电泳, 用UV分光光度计测定RNA浓度(g/L)并记录260 nm与280 nm的光密度比值(D260 nm/D280 nm)。使用反转录试剂盒THiFi Script, 各组均用2.0 g总RNA在20 μ L反应体系中进行反转录合成cDNA。用实时定量PCR仪检测目的基因ALP及Runx2的表达情况, 将管家基因ACTB(β -actin)作为内参, 引物见表2; 实时定量PCR为每管10 μ L的扩增反应体系, 95 ℃ 3 min预变性同时激活DNA聚合酶, 95 ℃ 变性3 s, 60 ℃ 退火及延伸20 s, 共40个循环。用2-Δ Δ Ct法对实验组与对照组的基因表达进行相对定量分析, 采用PM组进行校正, 即PM组的Δ Δ Ct为0。所有数据由软件自动生成。
| 表2 实时定量PCR中成骨相关基因的引物序列 Table 2 Primer sequence of target genes for real-time PCR |
采用SPSS 19.0软件进行统计学分析, 数值以
通过CCK-8检测手段, 连续7 d对hASCs增殖进行观察, 并绘制细胞生长曲线(图1), 可见各组细胞增殖曲线均呈S型, 第4~6天为快速增长期, 其中PM+LLL
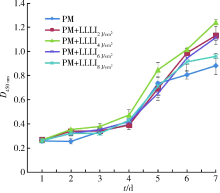 | 图1 hASCs增殖生长曲线Figure 1 Proliferation curves of hASCsAbbreviations as in Table 1. PM, proliferation medium; LLLI, low-level laser irradiation. |
2.2.1 ALP定性及定量检测 观察对照组与实验组hASCs成骨诱导7 d后ALP染色结果, 可见PM、PM+LLL
 | 图2 hASCs ALP染色显微镜下观察结果Figure 2 The microscope observation results of ALP stainingA, PM; B, PM+LLL |
2.2.2 矿化沉积检测 hASCs成骨诱导14 d、21 d时分别进行茜素红染色及定量分析。14 d时, PM、PM+LLL
| 表3 ALP及矿化沉积(D490 nm)定量检测( |
2.2.3 实时定量PCR 将提取的总RNA行1.2%琼脂糖凝胶电泳, 得出各组样本的D260 nm/D280 nm值均在1.8~2.0。PM组间的成骨相关基因表达量在第7天和14天时差异均无统计学意义。成骨诱导第7天时, OM+LLL
 | 图4 成骨相关基因的表达Figure 4 Expression of osteoblast-related genesAbbreviations as in Table 1 and 2. # P< 0.01, vs. corresponding OM group. |
近年来, 随着骨组织工程的飞速发展, 越来越多的新药品与技术被发现利用。hASCs由于具有多向分化潜能, 且具有来源广泛、取材容易、倍增速度快等优点, 可以作为骨组织工程较理想的种子细胞[1]。hASCs骨向分化的诱导可通过改变其所处的微环境或内部基因的修饰等两方面入手, 其中物理诱导的方法有其独特的优势, 因而成为一个值得研究的方向。
低能量激光作为一种物理诱导方式, 对细胞生物活性的影响与激光器的参数及照射方式密切相关。Pagin等[14]发现用低能量激光照射前成骨细胞24 h后, 不再具有促细胞增殖作用; 同样, Horvat-Karajz等[15]提出低能量激光照射产生的生物学刺激仅能持续48 h。激光照射具有能量累积特点, 故两次照射的间隔时间不能太短, 否则累加起来的能量过大反而使刺激作用减小, 甚至产生抑制作用[16], 故本实验采取分次小剂量照射, 照射间隔为24 h。
LLLI发生生物效应的首要基础是组织中存在光子接收器, 现已证实线粒体内膜上细胞色素C氧化酶是主要的光子接收器, 它吸收光子能量后处于电子激发态, 线粒体氧化还原状态改变, 可以引起以下细胞效应:加快的电子传递反应增加了ATP合成, 提供能量; 细胞质膜上的NADPH氧化酶可催化产生活性氧(reactive oxygen species, ROS), 将刺激信号快速传入核内, 进而调节某些转录因子, 如核转录因子激活蛋白-1(apetala-1, AP-1)、核转录因子κ B(nuclear factor-κ B, NF-κ B)等, 促进细胞增殖[17]。在其他条件相同时, 一定剂量范围内ROS上升的幅度与LLLI处理所用的光剂量成正比[18], 但大剂量激光照射会对细胞生物活性起抑制作用[19], 大小剂量的划分则随生物结构和机能的不同而不同[20], 故针对不同的细胞, 不同的激光器产生促增殖、分化作用的激光参数也不尽相同, 这在以往学者的研究中也得到了证实, 如Moore等[21]用不同波长的激光分别照射鼠成纤维细胞和内皮细胞, 发现细胞的增殖反应会因激光波长及细胞种类不同而有所差异。
为了探索激光照射剂量对hASCs增殖的影响, 本研究设置了不同能量密度的激光照射组, 实验结果表明, 能量密度为4 J/cm2的低能量激光促进hASCs增殖作用最明显, 其次为2 J/cm2和6 J/cm2, 而8 J/cm2的低能量激光促增殖作用不明显。正如Arndt-Schulz定律中所叙述的:小剂量的LLLI刺激可以增加细胞活性, 随剂量增大这种刺激作用先逐步加强达到峰值, 而后逐步减弱直至抑制细胞活性[22], 即LLLI的剂量-效应关系呈“ 双向曲线” 。因此, 只要我们得到了某种激光的“ 双向曲线” , 就能够预测该激光在任意剂量时对细胞活性的影响水平。
对于LLLI对细胞分化的影响, 不同学者的研究结果有较大的差异。Bloise等[5]发现波长为659 nm的半导体激光具有促成骨样细胞成骨分化的作用, Li等[11]和Kim等[23]分别提出了波长为647 nm和630 nm的红光可促进骨髓间充质干细胞成骨向分化, 而Incerti等[24]的研究却发现波长为915 nm的半导体激光没有促进MG63细胞增殖分化的作用, 造成这种差异的原因可能是不同研究所用的激光波长、照射剂量及培养条件不同。本研究得出波长为980 nm的半导体激光可以促进hASCs增殖的结果, 且最佳能量密度为4 J/cm2, 而6 J/cm2或8 J/cm2对于hASCs而言能量过高。为探索该参数的激光是否有促进hASCs成骨分化的作用, 本研究分别用2 J/cm2和4 J/cm2的激光照射增殖/成骨培养的hASCs, 与相同条件下不予激光刺激的对照组进行比较。ALP是成骨细胞早期分化的标志, 在未分化的间充质干细胞中呈极低水平表达, 细胞成骨向分化时表达量升高。本研究中增殖培养组的ALP表达呈阴性, 而成骨诱导组均呈阳性, 且表达量随激光能量密度的增高而增多。茜素红定性及定量实验中, 成骨诱导14 d时, 成骨诱导组随激光照射能量的升高, 矿化结节体积明显增大、数目增多, 而成骨诱导21 d时, 照射组与未照射组间并无明显差异, 造成这一结果的原因可能为:LLLI可以升高胞内钙离子的浓度[25], 在给予成骨诱导培养的情况下, 储备的钙离子可以迅速释放至胞外, 逐步堆积形成矿化结节; 一定剂量范围内, 激光能量密度越高胞内钙离子浓度越大, 因而可以在更短的时间内形成大量矿化结节。除此之外, 成骨相关基因ALP及Runx2的表达情况也进一步证实了LLLI具有促成骨分化的作用。
综上所述, 本研究得出的结论如下:LLLI具有促进hASCs增殖及成骨向分化的作用, 且作用强弱与照射剂量呈正相关, 但LLLI不能单独作为一种成骨诱导的方式, 需配合成骨诱导培养才能发挥促干细胞成骨分化的作用。今后应将研究对象扩展到三维结构, 更进一步模拟人体内的环境, 为低能量激光在骨组织工程中的应用奠定更加坚实的基础。
(本文编辑:赵 波)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|



