肺癌是发病率和死亡率增长最快、对人群健康和生命威胁最大的恶性肿瘤之一, 据不完全统计, 2015年我国肺癌确诊人数达73.3万, 因肺癌导致死亡的患者有61万。目前, 用于肺癌诊治的医疗费用成倍增长, 给医疗资源的分配带来了严峻的挑战。WHO根据生物学行为、治疗以及预后等因素, 将肺癌分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC), 其中NSCLC占80%以上[1]。在NSCLC中, 约65%的患者在首诊时已经发生了局部进展或者远处转移, 转移性NSCLC患者的平均中位生存期只有1~2年[2], 而相对于 SCLC, NSCLC 对于传统治疗手段化疗和放疗都较不敏感, 即使目前的靶向治疗药物如厄洛替尼或贝伐单抗等已在临床上广泛应用, 但往往也只是初期疗效较为显著而已, 几个月后多由于肿瘤细胞演化出不同的代谢旁路而逐渐耐药进而失去作用[3, 4]。因此, 提高转移性 NSCLC的疗效已刻不容缓, 亟需新疗法来改善治疗效果、延长患者生存期。随着单克隆抗体尤其是肿瘤抗原特异性的单克隆抗体研究的发展, 进一步推动了多种与肿瘤特异性抗体相结合的靶向疗法的基础与临床研究。
本研究通过大数据分析及临床资料阐明特异性肿瘤抗原podoplanin(PDPN)在非小细胞肺癌中的表达情况以及其与患者预后的关联, 证实PDPN是一个新的、较为可靠的肺癌治疗靶点, 从而为将来非小细胞肺癌中各类新型生物靶向疗法的开展提供了新的潜在特异性治疗靶位。
利用美国癌症基因图谱(the cancer genome atlas, TCGA)大数据平台, 选取PDPN基因明显高表达和低表达的患者(选取最高表达及最低表达各25%), 对于NSCLC中的最主要的两大类肺鳞癌和肺腺癌病例按PDPN基因表达情况分为高表达组和低表达组, 进一步根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)的淋巴结分期进行随机配对, 获得肺鳞癌高表达及低表达各108例, 腺癌高表达及低表达各109例。
本研究组依托复旦大学附属肿瘤医院组织病理库, 选取了2012年接受治疗的NSCLC患者的43例石蜡切片进行PDPN免疫组织化学染色分析, 确定PDPN蛋白的表达情况, 并分析这些患者临床的病理诊断淋巴结转移情况。
本研究开始前经过复旦大学附属肿瘤医院伦理委员会审查批准, 所取组织库标本已经患者书面知情同意。
采用免疫组化SP法对NSCLC患者石蜡切片中的PDPN抗原进行检测。将石蜡切片进行脱蜡和水洗后使用PBS冲洗, 再用3% (体积分数)过氧化氢甲醇溶液封闭, 室温下封闭10 min, 然后用 PBS 冲洗, 经抗原修复后再用PBS冲洗, 加羊血清20 min, 加抗人PDPN一抗(Sigma), 于4 ℃冰箱内过夜, 使用PBS冲洗后滴加二抗, 用 PBS 冲洗后行 DAB 染色, 然后水洗, 使用苏木精复染后冲洗脱水封片镜检。免疫组化图片采用OLYMPUS荧光显微镜BX51摄取, 并用Image Pro Expess分析系统进行分析。经病理科医师阅片, 诊断为强阳性并排除其他部位的表达如淋巴管等, 仅肺癌肿瘤病变区域的表达者确定为阳性。
使用PASW 18.0(SPSS Inc, Chicago, IL)软件进行统计学分析, 使用Kaplan Meier法绘制生存曲线, 并用log-rank检验比较分析PDPN基因表达与患者总生存情况的关系; 计数资料用例数和百分率表示, 组间比较采用Fisher精确概率法, 采用双侧检验, P< 0.05认为差异有统计学意义。
经TCGA数据库大于15年的随访分析发现, 在肺鳞癌患者中PDPN基因低表达患者的总生存(overall survival, OS)明显优于高表达患者, 且中位生存时间分别为65.2个月和36.6个月, 差异有统计学意义(P< 0.05, 图1)。这一结果提示在肺鳞癌中, PDPN基因高表达可能通过下游的各项信号转导通路引起肿瘤的侵袭性以及转移性增加, 从而导致患者的预后不佳。在肺腺癌患者中, PDPN基因高表达和低表达的患者总生存差异无统计学意义(P> 0.05, 图2)。
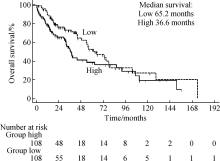 | 图1 PDPN基因表达情况与肺鳞癌患者的生存曲线分析Figure 1 Association between overall survival curve in lung squamous cell cancer patients and expression of PDPN gene |
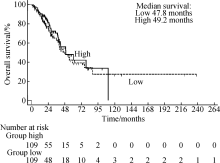 | 图2 PDPN基因表达情况与肺腺癌患者的生存曲线分析Figure 2 Association between overall survival curve in lung adenocarcinoma patients and expression of PDPN gene |
本研究组选取的2012年接受治疗的43例NSCLC患者的石蜡切片PDPN免疫组化染色分析并确定其PDPN蛋白的表达情况, 其中包括肺鳞癌15例, 肺腺癌15例, 其他NSCLC 13例。染色结果显示, PDPN在8例肺鳞癌患者病理标本中呈现阳性表达, 阳性率53.3%, 肺腺癌中4例阳性, 阳性率26.7%, 其他NSCLC 4例阳性, 阳性率30.8%(表1, 图3)。进一步分析PDPN表达阳性与阴性患者, 发现肺鳞癌与其他NSCLC中PDPN阳性患者中淋巴结N2以上淋巴结转移比例明显高于PDPN阴性者, 其中肺鳞癌患者中两者差异具有统计学意义(P=0.04, 表1)。
 | 图3 NSCLC患者病理切片的PDPN免疫组化染色结果(× 40)Figure 3 Immunohistochemistry expression of PDPN in NSCLC patients (× 40)A, PDPN (+) in squamous cell carcinoma; B, PDPN (+) in adenocarcinoma. |
| 表1 非小细胞肺癌中PDPN免疫组化表达与病理淋巴结转移程度的相关性分析 Table 1 Association between immunohistochemistry expression of PDPN and pathological lymph node metastasis in NSCLC |
肺癌发病率和死亡率均居我国恶性肿瘤首位, 肺癌也是我国疾病负担最重的肿瘤, 本研究通过TCGA大数据平台进行候选基因表达与NSCLC患者总生存等预后相关首要指标分析, 结合小样本的中国肺癌患者人群免疫组化表达及病理诊断的淋巴结转移能力相关性分析, 结果提示可以将PDPN这一肿瘤表面抗原作为潜在治疗转移性非小细胞肺癌尤其是肺鳞癌的目标靶点。
PDPN最初在足细胞表面被检测到, 故也称平足蛋白, 是一个由162个氨基酸组成的Ⅰ 型跨膜唾液黏蛋白样糖蛋白抗原, 它由一个富含丝氨酸和苏氨酸的细胞外功能域, 一个单次跨膜功能域以及一个含有cAMP和蛋白激酶C磷酸化位点的细胞内功能域组成[5]。PDPN在淋巴内皮细胞中选择性表达, 并有一定调节血管淋巴管的发育、细胞运动, 促进肿瘤侵袭和转移能力。多种人源性肿瘤细胞已报道有PDPN的表达, 包括黑色素瘤、脑肿瘤、生殖细胞肿瘤、泌尿系肿瘤、头颈部肿瘤以及非小细胞肺癌等[6, 7, 8, 9, 10], 同时, PDPN与肿瘤的恶性进展, 如上皮间质转化(epithelial mesenchymal transition, EMT)、远处转移及浸润等紧密相关[9, 10, 11]。Shimada等[12]报道在其检测的66% NSCLC样本中发现PDPN高表达。
美国癌症基因图谱(TCGA, https://tcga-data.nci.nih.gov/tcga/)是目前最大的癌症基因信息的数据库, 是美国国立癌症研究所(National Cancer Institute, NCI)与国家人类基因组研究所(National Human Genome Research Institute, NHGRI)联合于2006年启动的大型研究平台, 通过大数据大样本的方式, 全面、系统地提供恶性肿瘤生长和转移等过程中的分子生物学信息及临床相关资料。本研究分析了非小细胞肺癌中的特异性肿瘤抗原PDPN靶点, 通过TCGA大数据平台分析, 阐明了PDPN基因表达情况与NSCLC尤其是其中的肺鳞癌患者的总生存有着密切的关系, 发现PDPN基因高表达的肺鳞癌患者往往预后不佳, 预示PDPN基因表达水平可能是影响NSCLC尤其是肺鳞癌患者预后的一个重要因素。在本研究中, 经淋巴结转移程度配对后的 PDPN基因表达与肺鳞癌患者的总生存仍呈现了明显的相关性, 提示PDPN在促进淋巴结转移作用的基础上, 仍可能直接影响预后。研究中的复旦大学附属肿瘤医院患者的免疫组化结果与国外研究报道的结果基本吻合[12], 阐明了在中国NSCLC患者中, PDPN蛋白同样有着相当高的阳性率, 尤其是在肺鳞癌患者中的比例, 经病理组织学审核后排除正常情况下淋巴管的一定表达, PDPN在肺癌区域的阳性率仍大于50%, 进一步在蛋白质表达的层面上证明PDPN可以成为治疗中的一个新的潜在细胞表面治疗靶点。
目前已有多种抗PDPN抗体处于成熟的研究阶段, 对这些抗体的构造已有了相当的了解, 包括NZ-1, D2-40, AB3及18H5[13, 14], 同时如NZ12, chLpMab-7等诸多新抗体也在积极的研发和检测中[15, 16]。
综上所述, 在靶向治疗占重要地位的各项抗肿瘤疗法中, 与抗PDPN抗体相结合的各类新型靶向治疗可能作为一个潜在的个体化新疗法, 给以鳞癌为主的PDPN阳性NSCLC患者带来新的治疗希望。
(本文编辑:王 蕾)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|


