目的 探讨纳米银(silver nanoparticles, AgNPs)对皮肤细胞半通道活性的影响,并进一步研究半通道活性的改变在AgNPs诱导的细胞增殖抑制中的作用。方法 不同浓度(0、0.1、0.2、1.0、5.0、10.0、15.0和20.0 μg/cm2)的AgNPs处理人永生化表皮细胞系(HaCaT)24 h,采用碘化丙啶(propidium iodide, PI)染料排除法测定细胞活性,采用溴化乙锭(ethidium bromide, EB)摄取法测定细胞半通道活性。通过以常规密度(4×104 个/cm2)或低密度(1×104 个/cm2)接种细胞及采用半通道抑制剂甘珀酸(carbenoxolone, CBX)预处理的方法调节细胞半通道活性,采用细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8)检测半通道活性受抑制、不同浓度AgNPs作用后的HaCaT细胞的增殖水平。结果 当AgNPs浓度低于10 μg/cm2时,HaCaT细胞的细胞活性未受明显影响。10 μg/cm2的AgNPs作用2、12和24 h可导致细胞半通道活性升高至对照组的116.67%、124.85%和139.53%,与对照组相比差异均具有统计学意义( P<0.01), 且25、50和100 μmol/L CBX预处理可明显抑制10 μg/cm2AgNPs作用24 h 后的细胞的半通道活性( P<0.01)。此外,100 μmol/L CBX预处理可升高低密度和常规密度下10 μg/cm2AgNPs 作用24 h后细胞的增殖水平,其中,低密度下,CBX预处理组与AgNPs单独处理组相比,细胞增殖水平显著升高( P<0.01)。结论 一定浓度的AgNPs可激活HaCaT细胞的半通道,半通道活性升高在AgNPs引发的细胞增殖抑制效应中具有重要作用。
Objective: To investigate the effect of silver nanoparticles (AgNPs) on hemichannel activity in human skin keratinocytes (HaCaT) and to explore the role of hemichannel in AgNP-induced anti-proliferative effect on HaCaT cells.Methods: HaCaT cells were exposed to 0, 0.1, 0.2, 1.0, 5.0, 10.0, 15.0 and 20.0 μg/cm2 of AgNPs for 24 h and cell viability was assessed by propidium iodide (PI) staining with flow cytometry. Hemichannel activity was examined by ethidium bromide (EB) uptake experiments in cells exposed to AgNPs with and without hemichannel inhibitor carbenoxolone (CBX). Afterward, HaCaT cells were seeded at a low density of 1×104cell /cm2 or a normal density of 4×104cell /cm2 and cultured for 24 h. Cell proliferation was measured by cell counting kit-8 (cck-8) in low- or normal-density cultured cells exposed to AgNPs for 24 h with and without 100 μmol/L CBX.Results: Cell viability showed no significant differences between the control and AgNP-exposed groups with the concentration less than 10 μg/cm2. Exposure to AgNPs increased EB uptake in a time- and dose-dependent manner in HaCaT cells and EB fluoresce density was increased to 116.67%, 124.85% and 139.53% of the control after exposure to 10 μg/cm2 AgNPs for 2 h, 12 h and 24 h. After being treated with 25, 50 and 100 μmol/L CBX, 10 μg/cm2 AgNP-induced increase in EB uptake was significantly reduced in HaCaT cells ( P<0.01). The cellular proliferation rate was increased inlow- and normal-density cultured cells after AgNPs exposure with 100 μmol/L CBX. After being treated with 100 μmol/L CBX, 10 μg/cm2 AgNP-induced anti-proliferation in low-density cultured cells was significantly restrained ( P<0.01).Conclusion: AgNPs could enhance hemichannel activity of HaCaT cells. Hemichannel activation was involved in AgNP-induced anti-proliferative effect.
纳米银(silver nanoparticles, AgNPs)因其独特的光学、电学及抗菌特性受到广泛应用[1], 尤其是它在烧伤烫贴敷料等的应用使人们对其皮肤生物学效应倍加关注。体外实验研究发现, 与纳米二氧化钛、纳米铝、纳米四氧化三铁等金属纳米颗粒相比, AgNPs对大鼠肝细胞具有更强的细胞毒性[2], 如抑制细胞增殖、诱导细胞凋亡及引发细胞自噬等。近年来, 细胞膜上的半通道在细胞病理、生理学改变中发挥的作用受到关注, 包括皮肤细胞在内的多种细胞均可表达由间隙连接蛋白组成的半通道, 相邻两个细胞可以由胞膜上两个相匹配的半通道形成细胞间隙连接通讯(gap junction intercellular communication, GJIC)。半通道开放时允许一些可溶性的第二信使通过, 如氨基酸、核苷酸、离子、葡萄糖及其代谢产物等[3]。生理情况下, 半通道以较低的频率开放, 参与多项组织和细胞的生理活动, 而在病理情况下, 半通道活性升高, 常表现为半通道开放频率增加和(或)半通道数量增加[4, 5, 6]。有研究发现, 超细炭黑和纳米铬酸钴颗粒等纳米材料可激活细胞膜表面的半通道, 这可能影响细胞通过半通道向胞外释放三磷酸腺苷(adenosine triphosphate, ATP)[7, 8], 这些研究提示半通道可能在纳米材料的生物学效应中发挥重要作用, 然而, 目前有关AgNPs对细胞半通道影响的研究仍较为有限。本研究以人永生化表皮细胞系(HaCaT)为细胞模型, 研究AgNPs对细胞半通道活性的影响, 并进一步探讨AgNPs引起的半通道活性改变对细胞增殖的影响, 以期为深入揭示AgNPs的生物学作用机制提供科学依据。
1.1.1 仪器 CO2培养箱购自美国Thermo Scientific公司, 倒置显微镜购自德国Zeiss公司, 荧光倒置显微镜购自德国Zeiss公司, 多功能酶标仪购自美国Thermo Scientific公司, 流式细胞仪购自美国BD公司。
1.1.2 试剂 AgNPs(粒径< 100 nm)购自美国Sigma公司, 杜尔伯科改良伊格尔培养基(Dulbecco’ s modified Eagle’ s medium, DMEM)培养基购自美国Gibco公司, 标准胎牛血清购自美国PAN公司, 胰酶消化液[含0.25%(质量分数)胰酶和0.02%(质量分数)乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)]购自碧云天生物技术有限研究所, 甘珀酸(carbenoxolone, CBX)购自美国Sigma-Aldrich公司, 碘化丙啶(propidium iodide, PI)购自美国Sigma-Aldrich公司, 溴化乙锭(ethidium bromide, EB)购自美国Sigma-Aldrich公司, 细胞增殖-毒性检测试剂盒(cell counting kit-8, CCK-8)购自日本同仁化学研究所。
本课题组前期研究采用透射电子显微镜和动态光散射粒度仪对AgNPs进行表征, 本研究选用的AgNPs为球状颗粒, 粒径为20~50 nm, 比表面积为5 m2/g, 纯度为99.5 %(质量分数); AgNPs在培养液中部分团聚, 其水和动力学粒径为214.1 nm。用十万分之一天平称取AgNPs, 加入适量超纯水, 配置1 000 mg/L储备液, 低温超声30 min, 于4 ℃保存备用。临用前将储备液低温超声10 min, 用含10%(体积分数)胎牛血清的培养液将储备液稀释至相应浓度, 混匀后使用。
HaCaT购自中国典型培养物保藏中心, 采用DMEM培养液[10%(体积分数)的胎牛血清、100 U/mL青霉素和100 μ g/mL链霉素]于37 ℃、5%(体积分数)的CO2培养箱中进行常规培养, 当细胞进入对数生长期后, 用胰酶消化液消化5~6 min, 传代并用于实验。
采用PI染料排除法测定不同浓度AgNPs作用后的细胞活性, 取对数生长期细胞, 以4× 104个/cm2的密度接种于细胞培养板, 培养24 h待细胞长至80%~90%融合时, 弃去培养液, 进行AgNPs处理。加入终浓度为0(空白对照)、0.1、0.2、1.0、5.0、10.0、15.0和20.0 μ g/cm2AgNPs的培养液作用24 h。消化细胞, 收集细胞悬液于离心管中。采用适量磷酸盐缓冲液(phosphate buffer saline, PBS)离心清洗细胞后, 加入4 μ mol/L的PI染液4 ℃避光染色10 min。加入适量PBS重悬细胞, 离心清洗残留染液, 采用流式细胞仪测定。细胞活性=[(1-实验组PI阳性率)/(1-对照组PI阳性率)]× 100 %。根据试验结果确定无明显细胞毒性的剂量作为后续AgNPs的作用剂量。各剂量组设置3个平行样。
为观察半通道活性改变在AgNPs诱导的细胞增殖抑制中的作用, 以常规密度(4× 104 个/cm2)和低密度(1× 104 个/cm2)接种细胞于细胞培养板, 培养24 h待细胞完全贴壁。加入终浓度为0(空白对照)、0.1、0.2、1.0、5.0和10.0 μ g/cm2AgNPs的培养液作用24 h。CBX预处理组先采用25、50和100 μ mol/L的CBX预处理细胞0.5 h后再与不同浓度的AgNPs共同作用24 h, 作用结束后向每孔加入10 μ L CCK-8溶液。将培养板置于37 ℃、5% (体积分数)CO2的培养箱中孵育1~4 h, 肉眼可观察到显色变化后, 将上清液转移至另一96孔板, 用多功能酶标仪测定在450 nm处的光密度值。细胞增殖水平=(实验孔光密度值-对照孔光密度值)/对照孔光密度值× 100 %。各剂量组设置5个平行样。
分别以常规密度和低密度接种细胞于细胞培养板, 培养24 h待细胞完全贴壁后处理细胞。为研究AgNPs对半通道活性的影响, 加入终浓度为0(对照)、0.1、0.2、1.0、5.0和10.0 μ g/cm2AgNPs的培养液作用 24 h进行测定。为研究半通道抑制剂CBX对AgNPs作用后细胞半通道活性的影响, 分别采用0、25、50和100 μ mol/L的CBX预处理细胞0.5 h, 再与10 μ g/cm2AgNPs共同作用24 h。各项处理结束后吸弃细胞培养上清液, 采用Hank’ s平衡盐溶液(Hank’ s balanced salt solution, HBSS)清洗细胞3次后, 用2 μ mol/L EB染液避光染色10 min[37 ℃, 5%(体积分数)CO2]。吸弃EB染液, 用HBSS-Ca2+缓冲液清洗3次, 以去除游离的荧光染料并终止染色。加入适量HBSS-Ca2+缓冲液覆盖细胞, 以抑制半通道活性, 防止胞内染料通过半通道流失。采用倒置荧光显微镜观察结果(激发波长508 nm, 发射波长605 nm), 每孔随机选取5个视野拍照并保存结果, 拍摄时参数设置保持不变。采用Image J软件分析EB平均荧光强度, EB荧光强度=实验组荧光强度/对照组荧光强度× 100%。
所有实验均重复3次, 实验数据以均数± 标准差表示。采用SPSS 20.0软件进行统计分析。两组间均数比较采用Student t检验; 多组间均数比较采用单因素方差分析(One-way ANOVA), 进一步进行组间两两比较, 方差齐时采用LSD法检验, P< 0.05为差异有统计学意义。
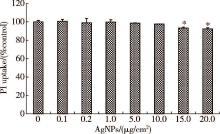
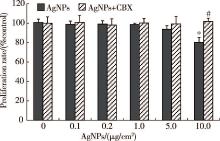
与对照组比较, 10 μ g/cm2及以下浓度的AgNPs作用24 h后, 细胞活性无明显改变, 当AgNPs浓度升高至15 μ g/cm2和20 μ g/cm2时, 细胞活性与对照组相比明显下降, 差异具有统计学意义(P< 0.05, P< 0.01, 图1)。为确保细胞活性不受AgNPs影响, 后续实验选取最高AgNPs作用剂量为10 μ g/cm2。
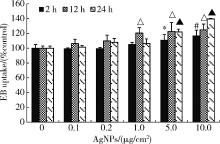
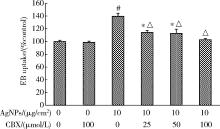
图2结果表明, 随AgNPs浓度升高、作用时间延长, 细胞对EB染料的摄取增加。当AgNPs浓度为10 μ g/cm2时, 作用2、12和24 h后细胞的EB摄取均达最大值, 分别为对照组的116.67%、124.85%和139.53%, 与对照组相比, 差异均具有统计学意义(P< 0.01)。因AgNPs作用24 h后HaCaT细胞的染料摄取最为明显, 后续实验选取该时间点进行相关测定。为证实细胞对EB的摄取是通过开放的半通道, 本研究进一步测定了半通道抑制剂CBX预处理后细胞的EB摄取水平。如图3所示, 经CBX预处理, AgNPs引起的EB摄取增加被显著抑制, 且该抑制作用具有剂量依赖性, 其中100 μ mol/L CBX的效果最为显著, 因此后续研究选用100 μ mol/L的CBX抑制半通道活性。
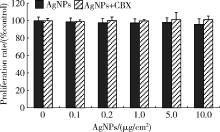
由图4所示, 常规密度下, CBX预处理组与相应浓度的AgNPs单独作用组相比, 细胞增殖水平略升高, 但差异无统计学意义。由图5所示, 低密度下, CBX预处理组与相应浓度的AgNPs单独作用组相比, 细胞增殖水平升高, 当AgNPs浓度为10 μ g/cm2时, 两组之间的差异具有统计学意义(P< 0.01)。
体内大多器官、组织和细胞均存在多种由Cx蛋白或Panx蛋白构成的半通道, 其中, HaCaT细胞具有可独立发挥作用的半通道。缝隙连接和半通道允许相对分子质量小于1 000的小分子和离子通过, 基于此特性, 常在体外采用细胞对胞外小分子荧光物质的摄取来测定半通道功能。正常生理状态下, 半通道活性较低, 细胞通过半通道摄取的荧光染料较少。本研究发现, 在细胞活性未受影响的剂量下(≤ 10 μ g/cm2), AgNPs可激活HaCaT细胞的半通道, 主要表现为细胞摄入荧光染料EB的含量增多。CBX是一种常见的间隙连接/半通道抑制剂, 它对间隙连接和半通道功能均有抑制作用, 其主要作用机制是通过插入细胞膜、改变Cx半通道结构和功能来关闭间隙连接通道和半通道[9]。本研究进一步测定了CBX对细胞荧光染料摄取的阻滞作用, 该结果证实了AgNPs处理后的HaCaT细胞是通过激活的半通道摄取EB染料, 即AgNPs作用可激活HaCaT细胞的半通道。
目前, 已有少数研究报道了纳米颗粒对半通道活性的影响。一项研究发现, 超细炭黑颗粒在未引起明显细胞毒性的剂量下可上调大鼠星形胶质细胞Cx43和Panx1的蛋白表达和胞膜分布, 激活细胞Cx43和Panx1半通道并促进星形胶质细胞谷氨酸和ATP的释放[7]。另一项研究发现, 纳米铬酸钴颗粒可通过激活细胞半通道释放ATP, 释放的ATP以旁分泌的形式作用于纳米颗粒未直接接触的人成纤维细胞, 使人成纤维细胞形成钙波并造成 DNA损伤[8]。以上研究表明, 纳米颗粒可能激活细胞半通道进而造成细胞损伤。AgNPs对HaCaT细胞半通道的激活作用可能与氧化应激有关, 氧化应激可引发细胞膜去极化, 而细胞膜电位的改变对半通道活性具有调控作用[10, 11]。此外, 分散在培养液中的AgNPs会向周围环境不断释放银离子[12], 这可能会改变细胞的微环境(如pH或离子组成), 进而对细胞造成间接影响。
既往研究发现, 一定浓度的AgNPs可对多种细胞的增殖产生抑制作用[13, 14]。本研究进一步探讨AgNPs引发的半通道活性增加是否对细胞增殖造成影响。以常规密度接种并培养细胞, 细胞同时存在GJIC和可独立发挥作用的半通道, 采用 CBX预处理并与AgNPs共同作用后, HaCaT细胞的增殖水平与AgNPs单独作用组相比有小幅升高, 但差异无统计学意义。目前尚缺乏有效途径单独调控细胞半通道活性而不影响GJIC的功能[15]。CBX对GJIC的功能和半通道活性均有抑制作用[7, 16, 17, 18], GJIC受抑制可能会影响半通道活性受抑后的细胞增殖水平, 因而本研究采用化学抑制剂结合调整细胞培养密度的方法, 进一步对半通道活性改变造成的影响进行单独研究[19]。以低密度接种并培养细胞, 细胞GJIC功能较弱而存在独立发挥作用的半通道, 采用CBX预处理并与AgNPs共同作用后, 细胞增殖水平与AgNPs单独作用组相比显著升高(P < 0.01), 说明降低半通道活性可有效减弱AgNPs对HaCaT细胞的增殖抑制作用。AgNPs对正常细胞的增殖抑制作用是其细胞毒性的一种表现。本研究结果提示, 细胞半通道活性改变可能是AgNPs细胞毒性的机制之一, 调节半通道活性或可成为降低AgNPs细胞毒性的手段。
近几年, 半通道由于其对细胞生理功能的调节作用而愈加受到人们重视。以往研究提示, 半通道对细胞增殖具有一定影响。Panx3半通道可抑制颅盖骨细胞增殖, 该作用可能是通过激活糖原合成酶激酶-3β 降解β -连环蛋白造成[20]。抑制Cx43半通道活性可增强大鼠心肌细胞增殖活性, 这可能与半通道活性受抑后细胞内ATP和Ca2+浓度的改变有关[19]。半通道活性异常可对细胞产生多种损伤, 甚至导致细胞死亡。有研究发现, 采用β 甘草次酸抑制半通道活性后可显著降低香烟烟雾及过氧化氢引发的细胞死亡[17]。半通道活性升高对细胞的损伤作用可能是由于胞膜半通道开放, 重要的细胞代谢产物(如ATP、烟酰胺腺嘌呤二核苷酸、三磷酸肌醇、环磷酸腺苷、环磷酸鸟苷等)可通过半通道流失, 而小分子量毒性物质通过半通道进入细胞, 胞内钙离子平衡受到破坏, 最终造成细胞损伤[21]。
综上所述, 本研究观察到, 在对细胞活性无明显影响的浓度下, AgNPs可激活HaCaT细胞半通道, 而半通道激活在AgNPs诱导的细胞增殖抑制效应中具有重要作用。
(志谢:感谢首都医科大学环境毒理学北京市重点实验室在本课题完成过程中提供的帮助)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|