目的 探讨槲皮素对大气细颗粒物(fine particulate matter,PM2.5)发育毒性的拮抗作用及可能机制。方法 于2015年12月至2016年3月以大气采样器将北京市某地区采暖期PM2.5收集在石英滤膜上,超声震动后将洗脱液过滤,冷冻干燥后得到PM2.5样品。采用体外全胚胎培养模型,将胎龄9.5 d的SD大鼠胚胎以50 mg/L PM2.5染毒,然后用不同剂量(0.1、0.5、1.0、5.0 μmol/L)的槲皮素干预,培养48 h后对大鼠胚胎生长发育和组织器官形态分化进行评分。染毒结束后,剥离卵黄囊,制备胚胎单细胞悬液,通过流式细胞仪检测细胞线粒体内活性氧(reactive oxygen species,ROS)的生成情况。结果 PM2.5染毒后,大鼠体外胚胎的卵黄囊直径、头长、颅臀长和体节数明显减少,各组织器官形态学评分明显降低,细胞线粒体内ROS水平显著升高。槲皮素干预后,对PM2.5致胚胎生长发育阻滞有明显改善作用,可使胚胎卵黄囊直径、颅臀长、头长增大,体节数增多,卵黄囊血管分化情况得到改善,并对PM2.5所致的尿囊、体屈、心脏、后脑、中脑、前脑、听觉、视觉、嗅觉、腮弓、上颌突、前肢芽及后肢芽分化抑制均有不同程度的改善,细胞内线粒体ROS含量也显著降低。1.0 μmol/L槲皮素干预效果最佳,其他3个剂量组的槲皮素干预也有一定的保护作用,但效果均不及1.0 μmol/L剂量组。结论 适量补充槲皮素对PM2.5致胚胎发育毒性有拮抗作用,清除线粒体内ROS可能是其机制之一。
Objective: To explore the antagonistic effect of quercetin on fine particulate matter (PM2.5)-induced embryonic developmental toxicity in vitro.Methods: PM2.5 was collected on glass fiber filters by PM2.5 samplers during the heating period of Dec. 2015 to Mar. 2016 in an area of Haidian District, Beijing City. The sampled filters were cut into 1 cm×3 cm pieces followed by sonication. The PM2.5 suspension was filtered into a 10 cm glass dish through 8 layers of sterile carbasus and stored at -80 ℃ until freeze drying. Frozen PM2.5 suspension was dried by vacuum freeze-drying. In vitro post-implantation whole embryo culture was used in this study. Pregnant rats with 9.5 gestation days (GD) were killed by cervical dislocation and the uteri were removed into sterile Hank’s solution. The embryos with intact yolk sacs and ecto placental cones were induced by PM2.5, and then subjected to intervention of quercetin at the doses of 0.1 μmol/L, 0.5 μmol/L, 1.0 μmol/L and 5.0 μmol/L, respectively. At the end of the 48 h culture period, the cultures were terminated, and all embryos were removed from the culture bottles and placed in prewarmed Hank’s solution for evaluation. Morphological evaluation of the embryos was conducted under a stereomicroscope using the morphologic scoring system by Brown and Fabro. The mitochondrial reactive oxygen species (ROS) level was detected by FACSCalibur flow cyto-metry using MitoSOXTM Red staining.Results: An obvious antagonistic effect was achieved through querce-tin at the dose of 1.0 μmol/L, which could result in an increase of visceral yolk sac (VYS) diameter, crown-rump length and head length, somite number, and the differentiation of visceral yolk sac vascular vessels. The scores of allantois, flexion, heart, hind brain, midbrain, forebrain, auditory system, visual system, olfactory system, branchialarch, maxillary process, forelimb bud and hindlimb bud also revealed a significant increase and the relative mitochondrial ROS level of embryonic cells was significantly decreased when compared with PM2.5 group. Although quercetin at the doses of 0.1 μmol/L, 0.5 μmol/L, 5.0 μmol/L also exhibited protective effects against PM2.5-induced embryonic developmental toxicity, the protective effect was weaker when compared with the dose of 1.0 μmol/L.Conclusion: Quercetin at proper dose may be of great benefit for the development of embryos exposed to PM2.5 in the uterus of the rats. Quercetin provides an effective strategy for the prevention of PM2.5-induced embryonic developmental toxicity. Clearance of mitochondrial ROS may be one of its mechanisms .
出生缺陷是导致早期流产、死胎、围产儿死亡、婴幼儿死亡和先天残疾的主要原因, 不但严重危害儿童生存和生活质量, 影响家庭幸福和谐, 也会造成巨大的潜在寿命损失和社会经济负担[1]。胚胎时期对环境因素的影响极为敏感, 此时许多有害因素可导致胚胎损伤, 甚至死亡。大量研究结果表明, 污染空气的暴露是不良妊娠结局或出生缺陷的一个危险因素, 包括低出生体重、宫内生长迟缓、早产、心脏出生缺陷、自然流产和怀孕概率降低[2, 3, 4, 5]。近年来, 我国爆发大面积持续性雾霾, 可吸入颗粒物(inha-lable particles)是主要的污染物之一, 其中空气动力学当量直径≤ 2.5 μ m的细颗粒物(fine particulate matter, PM2.5)因其粒径小、比表面积大, 为一些化学物质、细菌、病毒提供了载体[6]。Ha等[7]发现PM2.5会增加低出生体重和早产的风险; Agay-Shay等[8]的队列研究结果表明, PM2.5与婴儿孤立性动脉导管未闭有关。动物实验也观察到PM2.5和汽车尾气对胎儿体重、早期胚胎发育和孵化过程有不利影响[9, 10]。
到目前为止, 大气中PM2.5造成胚胎发育及出生缺陷的机制尚未定论。细胞内活性氧(reactive oxygen species, ROS)的积累被认为是PM2.5导致胚胎发育阻滞或出生缺陷的主要原因之一[11, 12], 鉴于此, 我们推测, 具有抗氧化活性的物质可能对PM2.5的发育毒性具有一定的拮抗作用。
槲皮素是具有多种生物活性的黄酮类化合物, 是人类天然膳食的成分, 广泛存在于蔬菜、水果和茶叶中, 相对安全无毒[13]。1982年, Willhite[14]曾报道大鼠整个孕期服用2~2 000 mg/kg槲皮素对胎儿均没有明确的致畸作用, 提示其用于孕期的安全性。大量研究表明, 槲皮素是强的自由基清除剂, 对超氧阴离子有直接或间接的清除作用, 进而达到保护细胞免受各种不良因素的损伤, 发挥其抗炎、抗纤维化、调节免疫功能、抗肿瘤、抗氧化等作用[15, 16]。Yoon等[17]的研究也提示, 低于100 μ mol/L的槲皮素体外干预对胚胎无任何胚胎毒性。卢春凤等[18]通过细胞实验发现槲皮素对ROS介导的细胞氧化损伤具有保护作用, 作用机制可能与槲皮素减少细胞ROS生成, 增加细胞抗氧化系统的能力, 发挥抗脂质过氧化作用有关。贾秀芬[19]的槲皮素对小鼠胚胎体外发育能力影响的研究提示, 0.1~1.0 μ mol/L槲皮素能促进小鼠早期胚胎的体外发育, 而当槲皮素浓度超过50 μ mol/L时, 对胚胎发育具有毒性效应。基于前述研究成果, 本研究采用0.1 μ mol/L、0.5 μ mol/L、1.0 μ mol/L、5.0 μ mol/L的槲皮素对暴露于PM2.5的胚胎进行干预, 研究其是否具有拮抗PM2.5发育毒性的效果。
无特定病原体(specific pathogen free, SPF)级健康成年未生育SD大鼠由北京大学医学部实验动物科学部提供[实验动物合格证号:SCXK(京)02011-0012, 实验动物使用许可证号:SYXK(京)2012-0011]。饲养在温度为(22± 2)℃、湿度为40%~60%、昼夜循环为12 h/12 h的屏障环境中, 自由进食、饮水。雌、雄大鼠于晚18:00按2 :1合笼, 次日晨7:00作雌鼠阴道分泌物涂片, 光镜下检查, 见到精子则认为受孕, 当天定为孕第0天(GD0)。用于制备即刻离心血清(immediately centrifuged serum, ICS)的大鼠选用SPF级健康雄性SD大鼠, 体重大于300 g。
主要试剂有: 槲皮素、青霉素、链霉素(美国Sigma公司), MitoSOXTM Red线粒体超氧化物指示剂(美国Invitrogen公司), 石英纤维滤膜、碘化丙啶(propidium iodide, PI)染色液、二甲基亚砜、Hank’ s液、磷酸盐缓冲液(phosphate buffered saline, PBS)(北京宝瑞杰公司)。主要仪器:恒温旋转培养箱(北京博奥森公司), 混合供气系统(O2、CO2、N2体积比分别为5 :5 :90、 20 :5 :75、 40 :5 :55的3种混合气体, 北京环宇京辉公司), 体式显微镜(SZX10, 德国Olympus公司), 双激光流式细胞仪(FACSCalibur, 美国BD公司), PM2.5采样器(TH-100, 武汉天虹公司)。
1.3.1 PM2.5采集及洗脱 于2015年12月至2016年3月通过PM2.5采集仪器将采暖期的大气PM2.5样品收集在石英纤维滤膜上。采样器置于北京市海淀区学院桥附近某建筑六层平台, 距离地面15 m, 采样流量设置为0.1 m3/min, 每天连续采集22 h。将采集有PM2.5的滤膜剪成小块放入烧杯中, 加入150 mL蒸馏水, 放入超声震动仪器中进行洗脱。将洗脱液通过6~8层的无菌纱布过滤到玻璃平皿中, 用封口膜密封, 储存在-80 ℃的冰箱中, 直到冷冻干燥[11]。选取相应数量的干净滤膜用同样方法洗脱冻干后溶于Hank’ s液中, 用于对照组。
1.3.2 即刻离心血清(immediately centrifugal se-rum, ICS)的制备[20] 成年健康SD大鼠乙醚麻醉后, 常规消毒剖腹, 无菌操作条件下腹主动脉快速取血, 即刻离心, 3 000 r/min离心10 min, 小心挤压上层纤维蛋白凝固体后再离心, 3 000 r/min离心10 min, 上层清亮液体即为ICS, 56 ℃水浴30 min灭活补体。加青霉素、链霉素(终浓度均为100 g/L), 经 0.22 μ m一次性滤器过滤除菌后分装到无菌血清瓶, -20 ℃保存待用。
1.3.3 实验分组 将PM2.5粉末溶于ICS中配成2 g/L的储备液, 将槲皮素粉末溶于Hank’ s液中配成2 mmol/L的储备液, 稀释后分装到无菌EP管, 密封后-20 ℃留存。Yuan等[11]在大鼠体外全胚胎模型中发现, 当PM2.5浓度达到50 mg/L时表现出一定的胚胎发育毒性, 能导致胚胎的生长阻滞, 因此, 本研究将50 mg/L作为PM2.5的染毒剂量。实验分为6组:空白对照组、PM2.5染毒组(50 mg/L PM2.5)、0.1 μ mol/L槲皮素干预组(0.1 μ mol/L槲皮素+50 mg/L PM2.5)、0.5 μ mol/L槲皮素干预组(0.5 μ mol/L槲皮素+50 mg/L PM2.5)、1.0 μ mol/L槲皮素干预组(1.0 μ mol/L槲皮素+50 mg/L PM2.5)、5.0 μ mol/L槲皮素干预组(5.0 μ mol/L槲皮素+50 mg/L PM2.5)。
1.3.4 体外培养[21] 麻醉后断颈椎处死孕9.5 d大鼠, 用75%(体积分数)乙醇溶液常规腹部消毒, 剖腹取出孕鼠子宫, 无菌条件下分离出含胚胎的蜕膜组织置于37 ℃预温的Hank’ s液中, 仔细剥离蜕膜, 体式显微镜下用显微镊子剥离Reichert’ s膜及壁层卵黄囊(visceral yolk sac, VYS)。选取完整的包裹脏层VYS和羊膜的胚胎移至加有ICS和不同浓度受试物的50 mL培养瓶中, 每瓶3~4只, 每只胚胎1 mL血清, 37 ℃旋转培养, 转速为40 r/min。分别于培养开始时、16 h、26 h向培养瓶内充入混合气体(O2、CO2、N2)2.5 min, 其体积比依次为 5 :5 :90、20 :5 :75和40 :5 :55, 连续旋转培养48 h。
1.3.5 结果观察 培养结束后, 将胚胎移至含预温Hank’ s液的平皿中, 在体视显微镜下测量胚胎脏层VYS直径, 并对VYS的血管发育进行评分。小心剥离VYS, 获得完整胚胎, 观察胚胎心跳, 并测量胚胎颅臀长(crown-rump length, CRL)、头长(head length, HL), 计数体节数, 采用Brown等[22]的大鼠胚胎发育评分法对胚胎组织器官形态分化指标进行评分。
1.3.6 ROS测定 培养48 h后, 每组随机选取3~5个胚胎, 剥离VYS, 放入5 μ mol/L MitoSOXTMRed线粒体超氧化物指示剂的Hank’ s液中孵育 30 min, Hank’ s液润洗胚胎两遍, 在37 ℃、含有0.1%(体积分数)胶原酶和20%(体积分数)ICS的Hank’ s液中继续孵育15 min。将处理后的胚胎和消化液用400目筛网过滤, 得到的单细胞悬液用Hank’ s液洗涤后重新混悬在500 μ L的Hank’ s液中, 用双激光流式细胞仪检测各组胚胎细胞中ROS的含量。
用SPSS 22.0软件进行单因素方差分析(ANOVA)。用Levene’ s检验对各组数据进行方差齐性检验, 方差齐时用LSD-t检验进行组间比较, 方差不齐时用Tamhane’ s T2检验进行组间比较。各指标以± s表示, P< 0.05为差异有统计学意义。
由表1可知, PM2.5模型组VYS直径及VYS血管分化得分均显著降低, 与空白对照组相比, 差异有统计学意义(P< 0.05), 表明PM2.5染毒后VYS生长受抑制, 血管分化不良, 影响母体循环向发育中的胎儿运送营养物质, 进而影响胚胎生长发育。槲皮素干预后, VYS直径明显增大, 与PM2.5模型组相比差异有统计学意义(P< 0.05), 其中1.0 μ mol/L槲皮素组VYS直径与空白对照组相比差异均有统计学意义(P> 0.05)。0.1 μ mol/L、0.5 μ mol/L、1.0 μ mol/L槲皮素组干预对VYS血管分化均有一定的改善作用(P< 0.05), 与空白对照组和PM2.5组相比差异均有统计学意义(P> 0.05)。
| 表1 槲皮素对PM2.5染毒的体外培养大鼠胚胎VYS生长发育和血管分化的影响( |
颅臀长、头长及体节数是反映胚胎生长发育的指标。本实验结果显示, PM2.5染毒后可导致胚胎颅臀长、头长和体节数降低, 与空白对照组相比, 差异有统计学意义(P< 0.05)。与PM2.5模型组相比, 0.1 μ mol/L、0.5 μ mol/L、1.0 μ mol/L的槲皮素干预组胚胎颅臀长均显著增加(P< 0.05), 0.5 μ mol/L、1.0 μ mol/L、5.0 μ mol/L槲皮素组胚胎头长也较PM2.5模型组明显增大(P< 0.05), 且与空白对照组相比差异无统计学意义(P> 0.05)。0.5 μ mol/L与1.0 μ mol/L的槲皮素干预组体节数与PM2.5模型组相比显著增多(P< 0.05), 且1.0 μ mol/L 槲皮素干预组与空白对照组相比差异无统计学意义(P> 0.05)。在本次实验干预组中, 1.0 μ mol/L 槲皮素干预组拮抗PM2.5致大鼠胚胎生长发育阻滞效果最佳, 与PM2.5 模型组相比, 生长发育得到明显改善, 颅臀长、头长、体节数均显著提高(P< 0.05), 且其头长和体节数与空白对照组相比差异无统计学意义(P> 0.05, 表2)。
| 表2 槲皮素对PM2.5染毒的体外培养大鼠胚胎生长发育的影响( |
由表3可见, 50 mg/L PM2.5染毒可致胚胎多个组织器官形态分化指标评分显著降低, 与空白对照组相比, 差异有统计学意义(P< 0.05)。槲皮素干预后, 对绝大多数组织器官分化有不同程度的改善作用。0.1 μ mol/L槲皮素干预组对体屈、心脏、听觉器官、视觉器官、嗅觉器官、腮弓、后肢芽有一定的改善作用, 与PM2.5模型组相比差异有统计学意义(P< 0.05)。0.5 μ mol/L槲皮素干预组对尿囊、体屈、心脏、后脑、中脑、听觉器官、视觉器官、嗅觉器官、腮弓、后肢芽、体节有一定的改善作用, 与PM2.5模型组相比差异有统计学意义(P< 0.05), 且尿囊、体屈、后脑、中脑及体节得分与空白对照组相比差异无统计学意义(P> 0.05)。5.0 μ mol/L槲皮素干预组对心脏、视觉器官、嗅觉器官、体节有一定的改善作用, 但与空白对照组相比差异仍有统计学意义(P> 0.05)。1.0 μ mol/L槲皮素拮抗PM2.5染毒所致胚胎发育毒性的干预效果最佳, 除背神经管及下颌突外的各项组织器官形态分化指标得分外均显著高于PM2.5模型组(P< 0.05), 且尿囊、体屈、心脏、后脑、中脑、前脑、视觉器官、腮弓、上颌突、前肢芽、后肢芽及体节的得分与空白对照组相比差异无统计学意义(P> 0.05)。与PM2.5模型组相比, 0.1 μ mol/L、0.5 μ mol/L及1.0 μ mol/L槲皮素干预能使胚胎总形态学得分显著提高(P< 0.05), 且1.0 μ mol/L槲皮素干预组总得分与空白对照组相比差异无统计学意义(P> 0.05)。
| 表3 槲皮素对PM2.5染毒的体外培养大鼠胚胎组织器官形态分化的影响(n=15, \(\overline{x}\)± s) Table 3 Effect of quercetin on morphological differentiation of tissues and organs of rat embryos exposed to PM2.5in vitro(n=15, \(\overline{x}\)± s) |
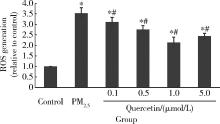
如图1所示, PM2.5染毒后细胞线粒体内ROS水平显著提高(P< 0.05), PM2.5模型组细胞线粒体内ROS含量是空白对照组的3.53倍, 各槲皮素干预组中的ROS含量与PM2.5模型组相比均显著降低(P< 0.05), 1.0 μ mol/L槲皮素干预组中ROS含量降低最为明显, 降至空白对照组的2.14倍, 但与空白对照组相比差异仍有统计学意义(P< 0.05)。
已有的流行病学队列研究及实验研究已证实PM2.5是多种慢性疾病的危险因素, 对胚胎生长发育也有一定的抑制作用。近年来, 随着雾霾天气的加重, PM2.5更加成为威胁健康的焦点问题而广受重视。孕期妇女对环境因素的影响极为敏感, 因此, 如何对PM2.5所致的发育毒性进行干预已引起越来越多的关注。
对哺乳动物而言, 在绒毛膜尿囊胎盘形成前, VYS是母体循环向发育中的胎儿运送营养物质的唯一通道[23]。本实验结果显示, 50 mg/L的PM2.5染毒可抑制VYS生长发育和血管分化, 同时导致胚胎生长发育迟滞, 颅臀长、头长及体节数均降低, 多器官形态分化抑制, 表现为体屈翻转不全, 心脏发育不全, 后脑、中脑、前脑闭合不全, 听觉、视觉、嗅觉、腮弓、上颌突、下颌突、前肢芽、后肢芽发育障碍, 形态学总得分降低, 这与Yuan等[11]的研究结果一致, 一定程度上证实了PM2.5的发育毒性。
本实验提示, 补充槲皮素可在一定程度上改善PM2.5所致的胚胎发育迟缓, 对组织器官分化有明显的改善作用。胚胎细胞线粒体ROS水平检测结果显示, PM2.5染毒后, 细胞内线粒体ROS水平为空白对照组的3.53倍, 而槲皮素干预后, 这一比值明显降低, 但与空白对照组相比, 差异仍具统计学意义, 这一变化趋势与各组胚胎生长发育情况的变化趋势一致, 进一步提示槲皮素对胚胎有一定的保护作用, 但并不能完全抵消PM2.5的发育毒性。这可能是由于PM2.5诱发的胚胎细胞的氧化应激, 刺激ROS的大量产生, 导致细胞过度凋亡, 抑制胚胎生长发育, 而槲皮素干预后, 发挥了其抗氧化的作用, 清除了部分氧自由基, 降低了细胞内ROS的水平, 从而对PM2.5致发育毒性产生干预作用。
本实验中, 在0.1 ~1.0 μ mol/L槲皮素的干预下, 随着其剂量的升高, 胚胎生长发育情况逐渐得到改善, 表现为各项形态学分化指标得分逐渐提高, 总得分也提高, 而5.0 μ mol/L槲皮素干预效果反而变差。1.0 μ mol/L槲皮素表现出了最佳的对PM2.5发育毒性的拮抗作用, 这可能与槲皮素的跨膜转运及其吸收代谢有关, 同时也提示, PM2.5的发育毒性可能还有氧化损伤以外的机制, 过高的槲皮素剂量可能通过增加其他毒性机制而相应地削弱了其抗氧化所带来的保护作用, 综合表现为胚胎发育毒性加重, 具体的机制还有待进一步探讨。
综上, 本实验采用全胚胎培养模型对槲皮素拮抗PM2.5发育毒性的干预效果进行了初步探讨, 结果表明, 适量补充槲皮素对PM2.5的发育毒性具有一定的干预作用, 提示孕期妇女适量增加富含槲皮素的蔬果摄入也许对胎儿的生长发育有积极作用, 但还需更多实验进行支持, 其干预机制也有待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|