目的 研究环境大气颗粒物及多环芳烃(polycyclic aromatic hydrocarbons, PAHs)暴露对慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者全身性氧化应激水平的影响。方法 招募45名居住在北京大学医学部半径5 km范围内的COPD患者作为研究对象,采用定组研究方法,于2014年11月至2015年5月对研究对象进行两次临床随访。通过肺功能检查测定第1秒用力呼气容积占预计值百分比(即FEV1%预计值),用于评估COPD患者病情的严重程度。收集患者尿样,分别采用高效液相色谱(high performance liquid chromatography, HPLC)法和酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)法测定尿样中的全身性氧化应激指标丙二醛(malondialdehyde, MDA)和8-羟基脱氧鸟苷(8-hydroxy-2'-deoxyguanosine, 8-OHdG)水平,同时,通过本课题组于校园内自行建立的空气污染监测站点连续收集研究期间该区域的环境大气污染物浓度以获得人群污染物暴露水平。利用线性混合效应模型,分别通过单污染物模型、双污染物模型和分层分析来研究大气污染物对COPD患者尿样中MDA和8-OHdG水平的影响。结果 滞后2 d(lag2)的超细颗粒物(ultrafine particles, UFP)和PAHs浓度与尿样中MDA水平呈显著正相关( P<0.05),UFP和PAHs每升高四分位间距(interquartile range, IQR)浓度,MDA浓度分别升高28%(95% CI: 4%~57%)和36%(95% CI: 4%~77%), 控制黑碳(black carbon, BC)的影响后,UFP和PAHs与MDA的关联强度略有升高。以COPD的严重程度进行分层分析后发现,多数污染物在疾病程度较轻的COPD患者中具有更强的氧化应激效应。在FEV1%预计值≥50%的COPD患者中发现,UFP每升高IQR浓度,尿样中MDA浓度升高98%(95% CI: 38%~186%),BC、UFP和PAHs每升高IQR浓度,尿样中8-OHdG浓度分别升高87%(95% CI: 32%~166%)、69%(95% CI: 24%~130%)和156%(95% CI: 66%~294%)。本研究未观察到细颗粒物(fine particulate matter, PM2.5)与尿样中氧化应激指标的显著关联。结论 大气污染物暴露可加重COPD患者全身性氧化应激水平,其中UFP和PAHs的效应更为显著,并且污染物对于疾病程度较轻的COPD患者氧化应激效应更强。
Objective: To investigate the effects of exposure to ambient particulate matter (PM) and polycyclic aromatic hydrocarbons (PAHs) on systemic oxidative stress biomarkers in chronic obstructive pulmonary disease (COPD) patients.Methods: A panel of forty-five diagnosed and stable COPD patients, whose residences were within 5 kilometers from Peking University Health Science Center (PKUHSC), were recruited and followed up twice between November 2014 and May 2015. The lung function index percentage of forced expiratory volume in 1 second (FEV1) to predicted value (FEV1%pred), was measured to reflect the severity of COPD patients. The systemic oxidative stress biomarkers malondialdehyde (MDA) and 8-hydroxy-2'-deoxyguanosine (8-OHdG) in their urine samples were measured using high performance liquid chromatography (HPLC) and enzyme-linked immunosorbent assay (ELISA), respectively. Concentrations of ambient air pollutants and levels of meteorological factors were measured continuously through the air pollution-monitoring station located in PKUHSC. PM2.5 samples, which were used for measuring the concentrations of PAHs, were collected by PM2.5high volume air sampler. We constructed linear mixed-effects models, including single-pollutant model, 2-pollutant models and stratification analysis, to estimate the effects of air pollutants on urinary MDA and 8-OHdG after adjusting for confounding factors.Results: In our COPD-patient panel, the associations between ultrafine particles (UFP) and PAHs and urinary MDA were statistically significant at lag2 ( P<0.05). For an interquartile range (IQR) increase in UFP and PAHs, respective increases of 28% (95% CI: 4%-57%) and 36% (95% CI: 4%-77%) in urinary MDA were observed, and the effects became stronger after adjusting for the concentration of black carbon (BC). The COPD patients were divided into 2 groups stratified by FEV1%pred. Most air pollutants had stronger effects of systemic oxidative stress in the COPD patients of FEV1%pred≥50%. In this group, we observed that an IQR increase in UFP was associated with a 98% (95% CI: 38%-186%) increase in urinary MDA, and an IQR increase in BC, UFP and PAHs were associated with respective increases of 87% (95% CI: 32%-166%), 69% (95% CI: 24%-130%) and 156% (95% CI: 66%-294%) in urinary 8-OHdG. We didn’t find significant associations between fine particulate matter (PM2.5) and urinary oxidative stress biomarkers.Conclusion: Our results suggested that exposure to air pollutants, especially UFP and PAHs, was responsible for exacerbation of systemic oxidative stress in COPD patients. Most air pollutants had stronger effects of systemic oxidative stress in mild to moderate COPD patients.
大气污染对人体产生一系列的健康危害, 对呼吸系统的损害尤为明显, 高水平的细颗粒物(fine particulate matter, PM2.5)暴露可导致人群呼吸系统疾病死亡率升高[1, 2]。慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是全球范围内一种严重危害人类健康的常见病和多发病, 已成为全球主要卫生负担之一。研究表明, 全球每年因大气颗粒物污染导致的过早死亡人数从2005年的393万升高到2015年的424万, 2015年大气颗粒物导致COPD死因的过早死亡人数高达86万[3]。Song等[4]关于环境PM2.5对中国居民健康负担的研究表明, 2015年PM2.5对我国COPD患者死亡的贡献率高达18.7%。
既往研究发现, 大气颗粒物与COPD患者的病情加重和肺功能降低存在密切关联[5, 6, 7], 但其潜在的致病机制尚不明确。氧化应激在COPD的发生发展过程中具有重要作用[8], 同时, 氧化应激被视为大气颗粒物所致健康危害的主要机制之一[9, 10]。丙二醛(malondialdehyde, MDA)和8-羟基脱氧鸟苷(8-hydroxy-2'-deoxyguanosine, 8-OHdG)是当前研究用于评价人体氧化应激水平最常用的指标, 可分别代表脂质过氧化水平和DNA氧化损伤程度[11, 12]。
流行病学研究显示, 大气颗粒物与人体氧化应激指标MDA和8-OHdG存在显著关联[13]。Song等[14]研究表明, 粒径更小的超细颗粒物(ultrafine particles, UFP)具有更显著的氧化应激效应。Wei等[15]研究发现颗粒物上的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)组分是其引起人体氧化应激水平升高的重要毒性组分, 然而, 目前关于大气颗粒物及PAHs组分暴露对人群氧化应激影响的研究多是关注一个横断面的污染物暴露, 且研究尚未得出一致结论, 同时现有研究中对于大气污染物与COPD患者全身性氧化应激水平关联的研究还较为缺乏。本研究通过对COPD患者的两次临床随访, 评估大气颗粒物及PAHs对其全身性氧化应激水平的影响。
本研究通过北京大学第三医院呼吸科招募了45名已确诊并且处于病情稳定期的COPD男性患者, 研究对象的纳入标准以及研究设计的具体细节见本课题组既往发表的文章[16]。本研究开始前获得北京大学生物医学伦理委员会审查批准(IRB00001052-13083), 所有研究对象均签署知情同意书。
本研究通过调查问卷获得研究对象的一般情况, 包括年龄、身高、体重、吸烟史、疾病史和用药史等信息, 分别于2014年冬季(2014年11月5日至2015年1月16日)和2015年春季(2015年4月21日至5月26日)对研究对象进行了两次临床随访。
研究对象于随访日9:00~9:30到达北京大学第三医院呼吸科, 记录其近1个月内COPD急性加重情况、用药情况以及现阶段是否感冒等信息。使用美国森迪斯(Sensor Medics)公司生产的6200型肺功能仪对研究对象进行肺功能检查, 获得肺功能指标第1秒用力呼气容积占预计值百分比(即FEV1%预计值)。
随访当日收集研究对象晨尿, 置于-20℃冰箱中储存。采用高效液相色谱(high performance liquid chromatography, HPLC)法对尿样中MDA水平进行测定, HPLC检测系统均为美国Waters公司产品, 包括Waters 1525高压泵、Waters 717plus自动进样器和Waters 2475多波长荧光检测器, 所用色谱分离柱为Waters XTerra C18(4.6 mm× 250 mm)色谱柱。采用酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)法对尿样中8-OHdG水平进行测定, 测定所使用的试剂盒由美国TSZ(Trust Specialty Zeal)生物公司生产。使用南京建成生物工程研究所生产的试剂盒测定尿样中的肌酐(creatinine, Cr)含量, 测定后的MDA和8-OHdG值均经过Cr校正。
1.4.1 大气污染物与气象因素的在线监测 通过北京大学公共卫生学院楼7层平台设立的环境大气污染在线监测站点, 连续监测研究期间环境大气污染物浓度和气象因素水平。监测仪器的具体型号详见本课题组既往已发表的文章[16]。该站点在线监测的大气污染物包括PM2.5(空气动力学当量直径≤ 2.5 μ m的颗粒物)、黑碳(black carbon, BC)、二氧化硫(sulfur dioxide, SO2)、二氧化氮(nitrogen dioxide, NO2)和UFP(空气动力学当量直径≤ 0.1 μ m的颗粒物), 监测的气象因素包括温度和相对湿度。
1.4.2 PM2.5滤膜采样及PM2.5中PAHs组分的测定 在北京大学公共卫生学院楼6层平台, 采用美国赛默飞世尔科技(Thermo Fisher Scientific)公司生产的VFC-PM2.5型大流量采样器连续采集PM2.5滤膜样品。采样膜为石英纤维滤膜(美国PALL公司生产, 尺寸为25.40 cm× 20.32 cm), 采样前将滤膜在450 ℃马弗炉中烘烤4~5 h, 以去除其中的有机物等杂质。换膜时间为每日9:00~9:30, 每日采样时长为23.5 h。将采样后的滤膜对折后用铝箔纸包好封严, 置于-20 ℃冰箱冷藏保存, 防止所采集的组分挥发与降解。
中国科学院地球环境研究所(西安)采用美国安捷伦(Agilent)公司生产的7890A/5975C型气相色谱/质谱联用仪对PM2.5滤膜中的PAHs组分进行分析测定, 包括苊烯(ACY)、苊(ACE)、芴(FLU)、菲(PHE)、蒽(ANT)、荧蒽(FLT)、芘(PYR)、苯并[a]蒽(BaA)、 
采用R 3.3.1软件和SPSS 20.0软件进行统计分析。
氧化应激指标MDA和8-OHdG的浓度值呈偏态分布, 数据以中位数来描述, 将指标浓度值进行对数变换后服从正态分布, 对两次随访期间的氧化应激指标浓度进行配对t检验, 分析两次随访指标的差异是否具有统计学意义。大气污染物与气象因素数据以均数± 标准差表示, 采用独立样本t检验进行两次随访之间均数差异性的检验, 采用Spearman相关来分析污染物与气象因素之间的相关程度。
采用线性混合效应模型评估大气污染物对COPD患者全身性氧化应激水平的影响。模型中调整潜在混杂因素的影响, 包括研究对象的年龄、身体质量指数(body mass index, BMI)、吸烟状态、季节、随访当日的“ 星期几效应” 以及温湿度。本研究通过单污染物线性混合效应模型来分析环境大气污染物与尿样中氧化应激指标最长为6 d的滞后效应(lag0~ lag5)。针对污染物与氧化应激指标关联较强的滞后天数, 本研究进一步通过双污染物线性混合效应模型分析目标污染物在控制了其他污染物之后的效应。最后, 根据第1次随访时COPD患者的气流受限严重程度对研究对象进行分层, 分析污染物对于不同疾病程度的COPD患者氧化应激水平的影响。P< 0.05认为差异有统计学意义。
研究对象为确诊的COPD患者, 共计45名, 均为男性。所有患者随访前1个月内均未出现COPD急性加重情况, 病情稳定, 且随访时未感冒。研究对象的基本情况如表1所示, 年龄(66.5± 8.6)岁, BMI(23.9± 3.7)kg/m2。45人中有22人现阶段吸烟, 其余23人不吸烟或已戒烟6个月以上。根据第1次随访时肺功能检查的结果, COPD患者气流受限严重程度处于GOLD 1~2级(即FEV1%预计值≥ 50%)的为20人, 占总人数的44.4%, 其余25人处于GOLD 3~4级(即FEV1%预计值< 50%)。研究对象尿样中氧化应激指标浓度结果如表2所示, 第2次随访期间MDA浓度略低于第1次随访, 而8-OHdG浓度则是第2次随访高于第1次随访。经配对t检验, 发现两次随访的MDA和8-OHdG浓度差异无统计学意义。
| 表1 研究对象的人口统计学和临床特征情况 Table 1 Demographic and clinical characteristics of study population |
| 表2 研究期间COPD患者尿样中氧化应激指标的描述性结果 Table 2 Results of descriptive analysis for urinary oxidative stress biomarkers in COPD patients over the two different visits during the study period |
2.2.1 大气污染物与气象因素水平的基本情况 随访期间的大气污染物浓度与气象因素水平如表3所示, 第1次随访期间大气PM2.5、BC、SO2、NO2、UFP和PAHs的浓度水平均高于第2次随访, 差异具有统计学意义。随访期间PM2.5、BC、SO2和NO2浓度的四分位间距(interquartile range, IQR)分别为79.6、6.9、32.2和35.2 μ g/m3, UFP数浓度的IQR为7 028 个/m3, PAHs浓度的IQR为78.2 ng/m3。
| 表3 研究期间大气污染物和气象因素的描述性结果 Table 3 Results of descriptive analysis for air pollutants and meteorological conditions over the two different visits during the study period |
2.2.2 大气污染物与气象因素的相关性分析 随访期间环境大气污染物与气象因素相关性分析结果如表4所示, 大气PM2.5、BC、SO2、NO2、UFP和PAHs两两之间均存在显著的正相关, PM2.5、BC、SO2和NO2两两之间的相关性较强, PAHs与BC、SO2、UFP具有较强的相关性, 温度与各污染物之间均呈现负相关关系。
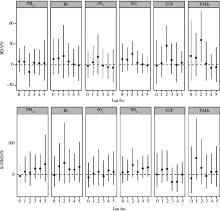
2.3.1 线性混合效应模型的单污染物模型结果(图1) 图1显示的是滞后第0~5天(lag0~ lag5)的污染物浓度与全身性氧化应激指标水平的关联。UFP与MDA水平在lag2时呈显著正相关(P< 0.05), UFP每升高IQR浓度, MDA浓度升高28%(95%CI: 4%~57%)。PAHs与MDA水平在lag2时呈显著正相关(P< 0.05), PAHs每升高IQR浓度, MDA浓度升高36%(95%CI: 4%~77%)。NO2与MDA水平在lag2时存在边缘显著(P=0.061), NO2每升高IQR浓度, MDA浓度升高16%(95%CI: -1%~34%)。各污染物与尿样中8-OHdG水平的关联均无统计学意义。
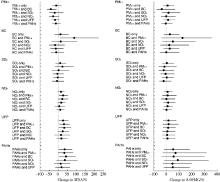
2.3.2 线性混合效应模型的双污染物模型结果(图2) 控制BC的影响后, UFP和PAHs对MDA的效应增强, 仍具有统计学意义(P< 0.05), UFP和PAHs每升高IQR浓度, MDA浓度分别升高34%(95%CI: 4%~71%)和43%(95%CI: 5%~96%), 而PM2.5与MDA水平呈负相关(P< 0.05)。控制PM2.5的影响后, UFP对MDA的效应增强, 仍具有统计学意义(P< 0.05), UFP每升高IQR浓度, MDA浓度升高32%(95%CI: 8%~63%)。与单污染物模型相比, 控制PM2.5的影响后, BC和NO2与MDA的关联具有统计学意义(P< 0.05), BC和NO2每升高IQR浓度, MDA浓度分别升高89%(95%CI: 10%~223%)和28%(95%CI: 6%~53%)。在分别控制其他污染物后, 各污染物对于8-0HdG的效应差异无统计学意义。
| 表4 研究期间大气污染物与气象因素的Spearman相关系数 Table 4 Daily Spearman’ s rank correlation coefficients for air pollutants and meteorological conditions during the study period |
2.3.3 线性混合效应模型的分层分析结果 根据第1次随访时COPD患者的气流受限严重程度对研究对象进行分层, 将其分为FEV1%预计值≥ 50%和FEV1%预计值< 50%两层(表5), FEV1%预计值与各污染物的交互作用均无统计学意义。多数污染物对氧化应激指标MDA的效应在FEV1%预计值≥ 50%的COPD患者中效应更强, NO2、UFP和PAHs每升高IQR浓度, MDA浓度分别升高41%(95%CI: -1%~99%)、98%(95%CI: 38%~186%)和77%(95%CI: -3%~226%)。各污染物对氧化应激指标8-OHdG的效应也是在FEV1%预计值≥ 50%的COPD患者中效应更强, 且分层分析后发现, 在FEV1%预计值≥ 50%的人群中, BC、UFP和PAHs与8-OHdG的关联均具有统计学意义(P< 0.05), BC、UFP和PAHs每升高IQR浓度, 8-OHdG浓度分别升高87%(95%CI: 32%~166%)、69%(95%CI: 24%~130%)和156%(95%CI: 66%~294%)。
| 表5 污染物对不同严重程度的COPD患者的氧化应激效应 Table 5 The effects of air pollutants to urinary oxidative stress biomarkers in COPD patients at different GOLD stages |
本研究发现, UFP和PAHs与COPD患者全身性氧化应激指标存在正相关, 疾病程度较轻的COPD患者对空气污染物引起的氧化应激效应响应更为显著。
目前关于空气污染对COPD患者氧化应激影响的相关研究较少见, 本研究除了对PM2.5的分析外, 进一步展开了对粒径段更小的UFP以及PM2.5中具有明显毒性的PAHs组分的研究。既往研究报道[17, 18], 与PM2.5相比, UFP由于粒径小, 可更深地进入肺部, 引起肺部和全身的氧化应激, 损伤气道上皮和肺泡组织, 进而造成气流受限。本研究发现, UFP浓度与尿样中全身性氧化应激指标MDA水平在lag2呈显著正相关, 未发现PM2.5、BC及气态污染物SO2、NO2暴露与患者尿样中MDA水平有关联。相似地, Bae等[19]的研究也未发现北京地区PM2.5与小学生尿样中MDA水平的关联, 但其研究发现内蒙古阿拉善地区PM2.5与小学生尿样中MDA水平在lag1显著相关, PM2.5浓度每升高10 μ g/m3, MDA升高0.03 mmol/g Cr。不同年龄段及健康状态的人群可能对污染物的敏感性存在一定差异, 不同地区的污染物特点也可能导致不同的结果。另外, PM2.5作为一种化学组成极为复杂的混合物, 富含大量有毒物质, 越来越多的学者开始展开对PM2.5中各种化学组分健康效应的研究, PAHs是PM2.5中具有显著健康危害的一种重要有机组分[20, 21, 22]。有研究发现[15, 19, 23], PM2.5中的PAHs组分可引起机体氧化应激损伤, 本研究也观察到了PAHs与尿样中MDA水平的显著关联, 未发现各污染物暴露与COPD患者尿样中8-OHdG水平的关联。Ren等[24]研究发现PM2.5和NO2与老年人尿样中8-OHdG的关联, 较长时间污染物的平均暴露带来的效应更明显, 结果显示, 过去21 d的污染物平均浓度与尿样中8-OHdG水平的关联较强。本研究未观察到阳性结果, 可能是污染物的滞后天数较为有限, 若建立更长时间的污染物暴露与健康指标的关联, 或可观察到显著性结果。
FEV1%预计值变异性小且易于测定, 是评估COPD患者气流受限严重程度的良好指标[25]。本研究以COPD严重程度分层分析后发现, 多数污染物在病情较轻, 即FEV1%预计值≥ 50%的COPD患者中具有更强的氧化应激效应。本研究纳入的患者均处于COPD稳定期, 但由于患者病情严重程度不同, 因而患者用药种类与用药频率均存在一定差异。轻中度患者多是按需用药, 中重度患者则用药相对较为规律, 同时病情稍重的患者使用的药物也较多, 因而患者口服或吸入的不同药物及用药频率可能对污染物的氧化应激效应产生一定影响, 病情较重的患者由于用药较为频繁, 可能一定程度上改善了污染物的氧化应激作用。另外, 肺功能损伤较轻的患者由于自身健康状态较好, 可能对空气污染等其他外来刺激更为敏感。香烟烟雾与空气污染类似, 是对人群具有一定健康危害的外来刺激, Maskey-Warzechowska等[26]研究发现短时间的香烟烟雾刺激后, 健康的吸烟者比COPD患者氧化应激水平更高, 表明肺功能状况较好、健康状况较完善的人群对香烟烟雾的有害刺激具有更高的敏感性。此外, 本研究还发现, 在FEV1%预计值< 50%的人群中, PM2.5等污染物与尿样中8-OHdG存在负相关。类似地, Kim等[27]在高血压患者中也发现了PM2.5与该指标的负相关。尿中8-OHdG是特异性的DNA损伤修复的产物, 虽然大多研究都将其作为氧化损伤的标记物, 但该指标也可能代表机体对该损伤的修复能力[27]。因而, 本研究观察到的负相关可能并不代表污染物的暴露减少了DNA的氧化损伤, 而是反映污染物的暴露降低了机体DNA的损伤修复能力。
本研究采用定组研究设计, 每个研究对象自身的前后指标对照比较, 可降低某些未知混杂因素对研究结果的影响, 同时在不同季节对人群健康指标进行重复测量, 增加了数据量, 且利于观察大气污染物浓度水平的连续变化对健康指标的影响。另外, 选择男性COPD患者作为研究对象, 排除了性别差异对结果的混杂作用。
本研究尚存在一定的局限性, 研究是基于对COPD患者两次随访得出的结果, 由于数据量有限, 因而结果的推广性还存在一定的局限, 后续本课题组将对多次随访的结果进一步分析, 可能会得出更为可靠的结果; 另外, 本研究中研究对象的污染物暴露未采用个体暴露的测量, 而是通过校园监测站点的污染物数据来代表个人的暴露水平, 虽然研究对象的入选标准限定其均为居住在该监测站点半径5 km范围内的居民, 且站点污染物每日的监测时间与研究对象随访时间一致, 但站点的污染物水平与研究对象的真实暴露情况仍存在一定偏差, 可能对结果产生一定影响; 此外, 吸烟是研究大气污染对人群健康影响的重要混杂因素之一, 本研究在统计模型中虽已根据研究对象现阶段是否吸烟而对该因素进行了调整, 但由于大多数COPD患者均是既往吸烟者, 在患病后方戒烟, 因而仍可能对结果产生一定影响, 并且, 对于吸烟者应该更进一步地具体记录其吸烟量的多少, 以便更准确地评估大气污染的健康危害。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|