目的 探讨巨噬细胞加帽蛋白(macrophage-capping protein,CapG)对胃癌细胞系迁移和增殖能力的影响。方法 采用real-time PCR方法检测了4种胃癌细胞AGS、BCG823、PHM82、MNK45中CapG基因的表达情况,选择低表达并且易转染的AGS细胞作为研究对象,设计针对CapG的特异性引物并合成重组质粒。构建可以表达CapG的慢病毒包装系统,通过侵染人胃癌细胞系AGS,建立可稳定表达CapG的细胞株。通过CCK8实验分析过表达CapG基因对AGS细胞的生长和增殖能力的影响,细胞划痕以及Transwell小室实验分析过表达CapG基因对AGS细胞迁移能力的影响。结果 过表达CapG后,AGS细胞的生长速度略低于对照组,但二者间差异无统计学意义( t=2.424, P=0.073)。划痕试验显示CapG实验组划痕间距相对于对照组明显缩小,两组平均缩小距离分别为336.99 μm和45.54 μm,差异有统计学意义( t=14.97, P=0.004)。Transwell试验显示CapG实验组和对照组穿膜细胞数目分别为176个和70个,CapG实验组显著多于对照组,差异有统计学意义( t=40.00, P<0.001)。结论 过表达 CapG基因对胃癌细胞系AGS细胞的生长和增殖无显著影响,过表达 CapG基因能促进胃癌细胞系AGS细胞的迁移。
Objective: To investigate the effect of macrophage-capping protein (CapG) on migration and proliferation of human gastric cancer cell line.Methods: Real-time PCR method was used to detect the expression of CapG gene in four gastric cancer cell lines, and AGS cells with low expression and transfection were selected as the research objects. Specific primers were designed for CapG and recombinant plasmids synthesized. A lentivirus packaging system which could express CapG was constructed, and a cell line stably expressing CapG was established by infecting human gastric cancer cell line AGS cells. The effect of overexpression of CapG gene on the growth and proliferation of AGS cells was analyzed by CCK8 assay. Cells cratch and Transwell assay were used to analyze the effect of overexpression of CapG gene on AGS cell migration.Results: After the overexpression of CapG, the growth rate of AGS cells was slightly lower than that of the control group, but there was no significant difference between the two groups ( t=2.424, P=0.073). Scratch test showed that the average narrowing distance of the scratches in the CapG experimental group was significantly reduced compared with the control group, the average narrowing distance of the CapG experimental group and the control group was 336.99 μm and 45.54 μm, the difference was statistically significant ( t=14.97, P=0.004). The average number of cell penetra-ting membrane in the CapG experimental group and the eGFP control group was 176 and 70, the number of the cells in the CapG experimental group was significantly higher than that of the control group ( t=40.00, P<0.001).Conclusion: The overexpression of CapG gene has no significant effect on the growth and proliferation of AGS cells of gastric cancer cell line. Overexpression of CapG gene can promote the migration of AGS cells of gastric cancer cell lines.
巨噬细胞加帽蛋白(macrophage-capping protein, CapG)是一种重要的肌动蛋白结合蛋白, 可重组肌动蛋白丝, 与细胞运动密切相关。CapG在肌动蛋白为基础非肌肉细胞的运动控制过程中起重要作用, 肿瘤细胞中上述细胞功能往往失去正常的调控, 因此, 肌动蛋白及肌动蛋白结合蛋白被认为是一种潜在的促进肿瘤形成因素和抗肿瘤药物的靶点之一。本研究以胃癌细胞系为研究对象, 应用CapG表达质粒转染技术, 进行CapG表达干预, 研究CapG对胃癌细胞系迁移能力的影响, 旨在初步探讨CapG在体外对胃癌淋巴结转移的作用。
人胃癌细胞株AGS、BCG823、MNK45和PHM82由北京大学基础医学院病原生物学系实验室提供。胎牛血清(fetal bovine serum, FBS)购自美国Gibco公司, RPMI-1640培养基购自美国Hyclone公司。GenStar PCR 2× Mix购自北京全式金生物技术有限公司, 快速PCR扩增的热启动高保真DNA聚合酶试剂盒购自北京全式金生物技术有限公司, 琼脂糖粉购自美国Invitrogen公司, Lipofextamine 2000购自美国Invitrogen公司。
胃癌细胞系AGS、BCG823、PHM82、MNK45分别培养于含10%(体积分数)灭活FBS的RPMI-1640培养液中, 在37 ℃、5%(体积分数)CO2条件下培养, 每3天换一次液, 当细胞达到90%融合度时用消化液(0.25%胰酶和0.01%EDTA, 均为体积分数)消化, 按1 :3传代。
用实时PCR(real-time PCR, RT-PCR)选择CapG表达低的细胞。分别培养上述步骤中的胃癌细胞系(AGS、BCG823、PHM82、MNK45), 用Trizol法提取细胞系总RNA, 用RevertAid第1链cDNA合成试剂盒合成cDNA, 并以此为模板进行RT-PCR, 检测4种胃癌细胞系的CapG表达水平。CapG引物和内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)的引物序列参照文献[1]:CapG引物序列为F:5'-CCC AGA GTG GCT CTC CAT TC-3', R:5'-GAA GAC GCC CTG GTT CTC TTG-3'; 内参基因GAPDH的引物序列为F:5'-GAA GGT GAA GGT CGG AGT TC-3', R:5'-CAT GGG TGG AAT CAT ATT GGA A-3', 均由上海生工公司合成。RT-PCR用25 mL的体系:SYBR Green RT-PCR Master Mix(Toyobo)12.5 mL, 上、下游引物各1 mL(10 mmol/L), cDNA 1 mL, 焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)水补至25 mL。反应参数:95 ℃预变性10 min, 95 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸30 s, 35 个循环; 熔解曲线50 ℃ 1 s, 95 ℃持续, 每摄氏度取15个点; 40 ℃降温, 得出各个胃癌细胞系CapG的相对表达量, 比较 AGS、BCG823、PHM82、MNK45胃癌细胞系CapG的表达水平。所有实验重复3次。
1.4.1 pLEX-Myc-eGFP(增强绿色荧光蛋白, enhanced green fluorescent protein)-CapG表达质粒的构建 设计可扩增CapG全长编码序列的特异性引物, 以HeLa细胞的cDNA为模板, 利用高保真酶PCR进行PCR扩增, 得到CapG编码序列加上Flag标签的目的片段。将PCR产物进行纯化回收, 将其连接至pLEX-Myc-eGFP载体, 对pLEX-Myc-eGFP-CapG表达质粒进行测序, 将pLEX-Myc-eGFP-CapG表达质粒瞬时转染HeLa细胞, Western blot实验验证。
1.4.2 pLEX-Myc-CapG病毒上清制备 将对数生长期的293T细胞接种至10 cm培养皿, 密度为70%左右。24 h后培养皿内更换为不含抗生素的DMEM培养基, 用lipo2000转染质粒pLEX-Myc-CapG+p8.74+VSVG(水疱性口炎病毒, vesicular stomatitis virus G), 质量比为5.0 :3.5 :1.5, 对照组用pLEX-eGFP质粒; 48 h后更换新鲜的完全培养基; 96 h后取上清, 3 000 r/min离心10 min, 用0.45 mmol/L滤膜过滤, 分装, 冻存于-80 ℃备用, 同时用Western blot实验验证CapG表达情况。
1.4.3 CapG慢病毒表达胃癌细胞系的构建 将AGS细胞铺于六孔板内, 细胞密度为30%左右, 24 h后加入含有10 mg/L聚凝胺(polybrene)的CapG病毒上清2 mL, 48 h后更换完全培养基, 72 h后加入筛选药物嘌呤霉素(puromycin), 持续筛选 5 d后, 荧光显微镜下观察荧光细胞所占比例, Western blot实验验证表达情况。
收集对数期生长的CapG过表达胃癌细胞系AGS及对照细胞, 以每孔3× 103/200 mL接种在96孔板中, 每组细胞设置5个复孔, 共铺5板, 每板细胞周边加一圈磷酸盐缓冲液(phosphate buffer saline, PBS)或培养基, 在5%CO2、37 ℃培养温箱内培养, 每隔24 h检测1次。
在6孔板每孔的底面用记号笔对称画3条线, 间隔0.5~1.0 cm左右。培养生长状态良好的AGS稳定转染细胞系, 接种至预先画好标记线的6孔板内, 每孔接种约2× 106个细胞(过夜培养细胞贴壁后汇合率达95%以上)。第2天用无菌10 mL枪头在每孔中央划一条直线, 枪头要垂直, 用力需均匀。随后, 用PBS轻柔操作, 清洗细胞表面, 去掉脱落的细胞及细胞碎片, 孔内更换为无血清培养基, 放入培养箱内。2 h后在倒置显微镜下观察细胞划痕情况并拍照, 然后放入细胞培养箱内继续培养。在随后的12 h、24 h、36 h和48 h时间点分别拍照记录, 拍照前若有悬浮死细胞, 则用PBS清洗换液后再进行拍照。最后用Image J软件测量细胞划痕间的宽度, 定量比较细胞迁移的速度。
实验前24 h将处于对数生长期的实验组及对照组细胞的培养基更换为无血清培养基。
1.7.1 小室制备 在24孔板内加入800 mL含10%(体积分数)血清的完全培养基, 将小室轻轻放入24孔板内, 使小室下层浸润于液面下, 避免液面与小室下层之间产生气泡。
1.7.2 细胞准备 胰酶消化细胞, PBS洗两遍, 计数, 取0.5× 104~1× 104个细胞, 1 200 r/min离心5 min, 弃上清, 加入150 mL不含血清的培养基重悬细胞, 然后移入Transwell小室内轻轻混匀。
1.7.3 固定、染色 培养48 h后用棉签擦去小室上部未穿膜的细胞, 在24孔板内加入800 mL 4%(体积分数)多聚甲醛室温固定 20~30 min, PBS洗2次, 然后加入0.1%(体积分数)结晶紫染液室温染色30 min, PBS洗2次。
1.7.4 镜下观察 在倒置显微镜下观察并拍照, 计算穿过小室膜的细胞数。
本研究所有的统计学分析均采用SAS 9.1软件实现。CCK8实验和Transwell实验均采用配对t检验, P< 0.05为差异有统计学意义。
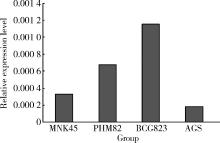
RT-PCR检测结果如图1所示, CapG基因在4种胃癌细胞系中均有表达, 其中在BCG823细胞中表达水平最高, 在AGS表达水平最低。因此, 在后续实验中选择AGS细胞作为过表达CapG基因功能研究的细胞株。
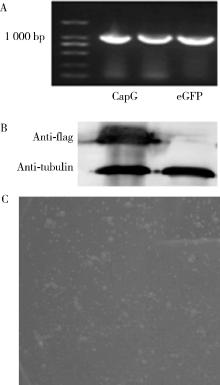
本实验目的片段CapG编码序列加上Flag标签的理论值为1 070 bp, 而PCR扩增产物经电泳后可见约1 000 bp的条带, 3个条带均为加上Flag标签后的目的片段CapG(图2A), 与理论值相符合, 质粒经酶切、连接、转化后得到白色单克隆菌(图2B), 测序结果证实, pLEX-Myc-eGFP-CapG表达质粒序列正确。将pLEX-Myc-eGFP-CapG表达质粒瞬时转染HeLa细胞, Western blot实验证实pLEX-Myc-eGFP-CapG表达质粒可以成功表达带有Flag标签的CapG蛋白(图2C)。
用含有pLEX-Myc-CapG的病毒上清侵染293T细胞后, 经Western blot实验验证293T细胞中瞬时表达CapG的情况, 结果如图3所示, CapG慢病毒表达系统构建成功, 病毒侵染293T细胞后可在293T细胞中成功表达CapG蛋白。为构建稳定表达外源CapG的胃癌细胞系, 用CapG病毒液侵染AGS细胞, 72 h后加入筛选药物嘌呤霉素, 持续筛选7 d后, 在荧光显微镜下观察eGFP病毒液的侵染效果, 荧光细胞所占比例约为80%(图4), 侵染效果良好。Western blot实验检测细胞表达外源CapG的情况, 用外源CapG蛋白的标签抗体能够在AGS细胞中清楚检测到外源CapG蛋白结果(图5), 可证实过表达外源CapG的稳定转移胃癌细胞系构建成功。
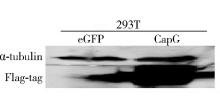 | 图3 Western blot 验证瞬时表达CapG的293T细胞Figure 3 Western blot verified transient expression of CapG in 293T cells Abbreviations as in Figure 2. |
 | 图4 荧光显微镜下观察慢病毒的侵染效果 (× 100)Figure 4 The effect of lentivivus was observed under fluorescence microscopy (× 100) |
采用CCK8实验检测稳定表达外源CapG的AGS细胞与对照细胞间的细胞增殖速度差异, 并绘制生长曲线, 结果显示, 过表达CapG后AGS细胞的生长速度略低于对照组(P=0.073), 但二者之间差异无统计学意义, 提示过表达CapG并不影响AGS细胞的生长和增殖(图6)。
采用细胞划痕实验和Transwell小室实验检测稳定表达CapG的AGS细胞的迁移能力, 划痕12 h后, 对实验组和对照组细胞的迁移距离进行统计(表1), 过表达CapG的AGS细胞的划痕间距明显小于对照组细胞(P=0.004, 图7A), 提示CapG过表达可明显促进细胞的迁移速度。进一步通过Transwell小室实验比较过表达CapG组与对照组细胞的穿膜细胞数目, 并对实验组和对照组细胞的穿膜数目进行统计分析(表2), 结果表明, 过表达CapG实验组穿膜细胞数目显著多于对照组(P=0.001, 图7B), 过表达CapG能显著促进胃癌细胞系AGS的迁移能力。
| 表1 划痕实验的细胞迁移距离 Table 1 Cell migration distance of scratch test |
| 表2 迁移实验的细胞穿膜数目 Table 2 The number of cell penetrating membrane |
近年来, 细胞骨架蛋白在肿瘤转移中的关键性影响逐渐被人们所重视, 细胞骨架重组是肿瘤细胞移动, 进而发生肿瘤侵袭和转移的重要因素。本课题组前期研究曾应用蛋白质组学方法, 比较伴或不伴淋巴结转移胃癌组织中蛋白表达的差异, 结果发现CapG在伴淋巴结转移组的胃癌组织中表达高于不伴有淋巴结转移的胃癌组织, 并已通过RT-PCR和免疫组织化学研究证实了该结果的可靠性, 研究还发现脱离原位癌灶的肿瘤细胞CapG免疫组织化学染色强度更强[1], 说明与非侵袭性肿瘤细胞相比, 侵袭性肿瘤细胞高表达CapG, 因此, 推测CapG有可能促进胃癌细胞转移。最近日本学者应用蛋白质组学技术, 同样发现CapG在胃癌淋巴结转移组织中高表达, 认为CapG可能与胃癌淋巴结转移有关[2], 但机制不详。
CapG最初发现于人肺泡巨噬细胞, 由348个氨基酸构成, 是一种重要的肌动蛋白结合蛋白, 其作为Ca2+依赖性肌动蛋白结合蛋白, 通过对微丝加帽、切割而调控肌动蛋白的长度, 在特定的条件下将纤丝组装成致密的网络, 促进肌动蛋白交联, 导致细胞骨架重组。CapG分布在细胞质和细胞核, 呈棕黄色颗粒, 具有3个凝溶胶蛋白样同源性结构域, 在正常组织特别是巨噬细胞广泛表达。
CapG是一种肌动蛋白结合蛋白, 由348个氨基酸组成。Witke等[3]研究发现, CapG是受体介导的巨噬细胞胞膜运动所必需的, 推测CapG可能是机体调节巨噬细胞介导的炎症反应的一个有用的靶标。已有研究发现, 成纤维细胞和内皮细胞中CapG过表达均可导致细胞的运动性增强[4]。Rao等[5]研究发现, CapG通过维持细胞形态、调节细胞迁移、黏附和生长来参与多种肿瘤细胞的迁移和侵袭, CapG过表达可提高成纤维细胞的运动能力, 同时也可调节内皮细胞的运动[6]。
本研究发现, CapG能够促进肿瘤细胞的迁移, 但不影响肿瘤细胞的增殖能力, 这一观察结果与Kimura等[7]的CapG不影响肝癌细胞增殖但促进肝癌细胞侵袭的研究结果一致。CapG的表达已在多种恶性肿瘤中报道[8, 9, 10, 11], CapG在胰腺癌、乳腺癌和前列腺癌中均被发现与肿瘤细胞迁移和侵袭相关[9, 12], 与本研究结果一致。Liao等[13]报道称, CapG被缺氧诱导因子-1所诱导, 表明CapG在缺氧条件下具有促进肿瘤细胞存活的作用。
除了分子水平上的表征和临床材料的观察外, 在转移过程中CapG的主要性能仍有待阐明。CapG在上述多种恶性肿瘤中异常表达, 与肿瘤的恶性特征相关, 因此, CapG可能在肿瘤进展中起基础性作用, 但关于CapG的表达差异如何影响肿瘤细胞的表型还有待进一步研究。
CapG是一种细胞骨架蛋白, 细胞骨架是真核细胞中的蛋白纤维网络结构, 细胞骨架蛋白可能通过某种机制与细胞骨架相互作用, 出现细胞骨架系统异常。恶性转化的细胞常表现为微管减少和解聚, 细胞骨架异常可增强癌细胞的运动能力, 研究表明, 微丝束及其末端黏着斑的破坏以及肌动蛋白小体的出现与肿瘤细胞的浸润和转移特性有关。CapG是凝溶胶蛋白/绒毛蛋白家族肌动蛋白调节蛋白, 它通过在肌动蛋白丝的两端加帽来控制以肌动蛋白为基础的运动。
此外, Laye等[14]和Weaver等[15]研究发现, 核CapG蛋白通过核运输受体(NTF2)和Ran GTPase进入细胞核, 可促进肿瘤侵袭转移, 但核CapG如何通过下游靶基因影响细胞骨架, 进而影响肿瘤细胞的迁移和侵袭, 目前尚未见相关文献报道。
本研究观察到CapG在各种胃癌细胞株中的表达水平不同, 这些细胞系将会成为在胃癌中进行CapG研究的非常有价值的资源, CapG的功能特性及其在具有转移潜能的肿瘤细胞中独特的表达还有待进一步研究, 以便了解胃癌转移的分子背景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|