目的 探讨脾窦岸细胞血管瘤(littoral cell angioma, LCA)的临床病理特征、形态学特点和免疫表型,为正确的诊断、避免误诊提供依据。方法 回顾性研究13例LCA患者的临床病理资料、组织学特点并将LCA的石蜡包埋标本进行免疫组织化学染色,同时将5例海绵状血管瘤和4例正常脾窦岸细胞作为对照组。结果 13例LCA患者包括7名男性和6名女性,年龄从39~70岁,平均54.2岁,中位年龄55岁,这些肿瘤患者中,6例伴有腹腔内恶性、良性肿瘤或者炎症,7例由体格检查被偶然发现。 肿瘤标本大体观发现脾内含有直径为0.5~6.2 cm孤立性或者多发性灰白色结节。肿瘤组织学特征为由相互吻合的血管腔隙构成,血管腔隙内排列丰富的、从圆形到立方状窦岸细胞,并延伸到血管腔,通常可以看到在肿瘤的一些区域中,覆盖于乳头状结构中的窦岸细胞延伸到血管腔内,在血管腔中还可以辨认出另外一种组织细胞样细胞,大小比窦岸细胞大,两种细胞均未显示细胞学非典型性。免疫组织化学显示所有病例中的窦岸细胞对血管内皮细胞和组织细胞标记物(如CD21、CD31、CD68、多克隆FⅧRAg 和ERG)呈阳性表达,而这些细胞对CD8、CD34和WT-1呈阴性表达,表明LCA中的窦岸细胞的免疫表型与对照组不同。结论 LCA是一种良性病变,多发生在老年人,它的病因尚不清楚,然而,由于在一些病例中伴随的其他肿瘤或炎症,因此免疫失调可能和该肿瘤存在关联,LCA中的窦岸细胞在免疫组织化学中呈内皮细胞-组织细胞混合性表型,因此这些细胞可能具有介于内皮细胞和组织细胞之间的特征,强调组织学检查和免疫表型对诊断和鉴别诊断至关重要。
Objective: To investigate the clinicopathological features, morphological characteristics, immunophenotypes of littoral cell angioma (LCA) in spleen, and to provide new evidence for making diagnosis and avoiding misdiagnosis.Methods: Clinicopathological data, histological characteristics of 13 cases of LCA were retrospectively studied and immunohistochemical staining was imposed on the paraffi-nembedded specimens, and 5 cases of cavernous hemangioma, 4 cases of normal littoral cells of spleens were used as control groups, simultaneously.Results: All the 13 LCA patients included 7 males and 6 females, aged from 39 to 70 years with an average of 54. 2 years and a median age of 55 years. Among these tumor patients, 6 cases were accompanied by malignances, benign tumors or inflammation states at abdominal cavities, and 7 cases were accidentally discovered by physical examinations. Grossly, spleens contained solitary or multiple gray red nodules ,which ranged from 0.5 to 6.2 cm in diameter. Histologically, tumors were composed by anastomosing vascular spaces which were lining by plump, rounded to cuboidal littoral cells that extended into vascular lumens. Usually, papillary frameworks that were covered by these cells were also seen extending into the lumens in some areas. Other types of histiocytoid cells were identified in lumens and the sizes were larger than the littoral cells. Both types of cells absented cytologic atypia. Immunohistochemical study demonstrated that the littoral cells in all cases were positive for vascular endothelial and histiocyte markers, such as CD21, CD31, CD68, polyclone FⅧRAg and ERG, while these cells were negative for CD8, CD34, and WT-1. These findings manifested that immunophenotype of littoral cell in LCA distinctive from that in controls.Conclusion: LCA is a benign lesion, which frequently occurs in the elderly. Its etiology remains confusion, however, immune dysregulation may associate with it because of the concomitance with other tumor or inflammation in some cases. The littoral cells in LCA show a hybrid endothelial-histiocytic phenotype on immunohistochemistry, therefore these cells may have features that intermediate between those of endotheliocytes and histiocytes. Emphasizing the histological findings and immunophenotypes is significant for diagnosis and differential diagnosis.
血管源性肿瘤是脾最常见肿瘤类型, 包括良性、中间型和恶性, 其中大部分肿瘤属于良性(包括血管瘤和错构瘤等), 绝大多数是偶然发现或者尸检才被发现[1], 其发病率约占尸检的0.03%~14.00%。近年来由于免疫组织化学染色的发展, 脾窦岸细胞血管瘤(littoral cell angioma, LCA)作为一种新的血管肿瘤被发现, 它属于一种中间型血管肿瘤。由于国内外文献绝大多数为个案报道且报道病例数量有限, 对其病因学和自然过程尚不完全清楚, 而且其形态特点极易与其他的血管肿瘤相混淆。本研究回顾13例LCA的临床病理资料并进行免疫组织化学染色, 将5例脾海绵状血管瘤和4例正常脾窦岸细胞作为对照组, 对比分析, 以了解该肿瘤临床病理特点、免疫表型及鉴别诊断, 避免误诊、漏诊。
13例LCA取自黄冈市中心医院和绍兴市人民医院2004年8月至2014年6月期间手术切除病例。对所有的13例LCA进行形态学复习, 将5例脾海绵状血管瘤和4例正常脾作为对照组, 进行大体标本和组织学观察比较, 收集所有病例的临床资料、影像学和随访的资料。病理学观察包括:脾大小、肿物的大小、切面、孤立性或多发性、质地、是否存在其他部位的肿瘤转移病灶。所有标本均经4%(体积分数)中性甲醛溶液固定, 常规脱水透明浸蜡切片及HE染色, 同时行免疫组织化学En Vision二步法染色, 所用抗体CD8、CD21、CD31、CD34、CD68、多克隆FⅧ RAg、ERG、WT-1均购自北京中杉金桥生物技术有限公司。显微镜下观察所有病例的形态学特征和免疫表型。
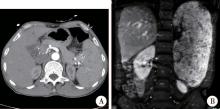
13例LCA患者, 男7例, 女6例, 年龄39~70岁, 中位值55岁, 平均值54.2岁。5例以“ 上腹隐痛不适” , 6例由B超偶然发现“ 脾占位性病变” , 1例“ 进行性记忆力下降” 入院, 1例在进行卵巢癌的手术中偶然发现脾肿块。所有病例中, 1例伴胃弥漫性大B细胞淋巴瘤, 1例伴发卵巢浆液性癌, 1例伴发肾上腺皮质腺瘤, 1例伴发脾周围脓肿, 2例伴发胆囊结石和息肉, 其余7例不伴其他疾患。7例B超提示脾多发性高回声, 6例CT提示“ 脾明显肿大, 多发性弥漫性病变” , 2例MRI提示“ 脾实质内散在多发性小圆形长T2, 稍长T1信号灶。DW1呈不均匀弥散受限征, 内信号欠均匀, 增强后逐渐持续强化, 内仍见多个斑点状无强化灶” (图1)。
13例LCA病例表现为脾稍大或明显增大, 大小为10.0 cm× 8.0 cm× 5.0 cm至17.0 cm× 10.0 cm× 6.0 cm, 切开脾实质内或上下极可见直径0.5~6.2 cm孤立性或者多发性肿块, 切面灰红色或者灰白灰红相间, 质地比脾稍硬。
镜下可见红髓区血管扩张, 白髓萎缩; 肿瘤由大小、形态不一, 相互吻合, 呈海绵状腔隙构成, 与脾血窦类似, 部分区域可见乳头状结构突入腔隙内; 腔隙或乳头状结构衬覆立方状、柱状或扁平细胞, 并延伸到腔隙中, 该细胞异型性小, 形态与窦岸细胞相似, 部分细胞浆内见含铁血黄素沉积和/或玻璃样小球。腔隙内可见泡沫样或含铁血黄素性组织细胞样细胞沉积, 体积稍大于窦岸细胞(图2)。
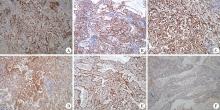
本组13例LCA进行免疫组化染色, 其中CD21、CD31、CD68、FⅧ RAg、ERG为阳性; CD8、CD34、WT-1为阴性(图3)。5例海绵状血管瘤中CD31、CD34、FⅧ RAg、ERG 为阳性, CD8、CD21、CD68、WT-1为阴性(图4), 4例正常脾窦岸细胞CD8、CD31、CD34、CD68、FⅧ RAg 、ERG、WT-1为阳性(图5), CD21为阴性(表1)。
| 表1 LCA与对照组的免疫表型 Table 1 The immunophenotype of LCA and the control groups |
13例病理诊断均为LCA。
13例患者行脾切除术, 术后进行了10~62个月的随访, 平均随访29.8个月, 仅2例因为恶性肿瘤致患者复发或死亡, 其余11例患者均未出现复发。
脾窦岸细胞血管瘤是一种罕见的良性血管肿瘤, 最初由Falk等[2]于1991年首先描述。由于LCA起源于排列在脾红髓血窦内特异的名为“ 窦岸细胞” 的内皮细胞, 故LCA属于网状内皮细胞系统的肿瘤。该肿瘤的病因尚不十分清楚, 到目前为止, 大多数患者多无明显症状或者由影像学检查被偶然发现, 最终的诊断主要依靠病理。
脾LCA各个年龄段均可发生, 以中老年患者居多, 中位年龄50岁, 男女比例约为5 :3。大多数为良性的自然过程, 无明显症状, 少数患者有脾肿大及脾功能亢进导致血小板减少或贫血。有学者报道[3], 约33%的患者伴随有各种内脏恶性肿瘤, 约17%的患者伴随有先天性或者后天免疫异常, 所以认为LCA的发病可能与恶性肿瘤、慢性感染及自身免疫失调有关。有研究指出[4, 5], 在免疫失调或者免疫抑制的条件下, TNF-α 在LCA起病过程中起重要作用, 然而, 因为该肿瘤少见, 以及尚缺乏对患者进行随访的报道, 它们之间的相关性尚未得以确立[6]。到目前为止, 英文文献中报道的最多的25例LCA中的15例有上皮、间皮及血液系统肿瘤与之共存[7]。本研究13例患者中, 3例伴发了内脏良性或恶性肿瘤, 1例伴发脾周围脓肿, 2例伴发胆囊炎, 推测部分LCA的发生可能与免疫因素存在一定关联。
影像学检查对诊断脾的血管肿瘤有重要价值, 大部分LCA表现为脾弥漫性多发性结节状病灶, 极少数表现为孤立性单发结节[1], 上述多发性病变可以在CT扫描显现出来, 往往特异性不强。与大多数血管瘤一样, LCA平扫表现为脾多发大小不等的低密度结节, 动脉期轻度强化, 门静脉期及延迟期进一步强化, 呈延迟性强化的特点。在增强CT扫描情况下, LCA与多发性、小的、低密度结节, 恶性疾病(如转移性肿瘤、淋巴瘤、Kaposi肉瘤), 或者其他的感染性疾病导致的微小脓肿极其相似[8]。MRI扫描LCA在T1加权成像分别显示低信号, T2强度多变, 成像特性取决于窦岸细胞吞噬能力而导致内含铁血黄素的沉积量的多少, 大量的含铁血黄素沉积则显示出T1低信号, 无增强[9]。在多发病灶中一般无典型血管瘤样异常强化, 动脉期呈轻度强化, 平衡期病灶与正常脾相仿; 单发病灶可呈典型血管瘤样强化, 但病灶内散在低密度影无强化, 本组有影像学资料的病例符合上述文献报道。
目前, LCA的诊断主要依靠组织病理学检查。毕成峰等[10]将LCA归纳为如下特点:(1)脾体积不同程度增大, 切面见单个或多个暗红色或灰褐色结节; (2)主要组织学特点表现为病变由相互吻合呈海绵状的血管腔隙构成, 与脾血窦类似, 腔隙常形成乳头状突起或囊性扩张, 其中可见两类细胞, 一类是形态非常类似于正常脾的窦岸细胞, 衬覆在乳头状结构表面且体积较小的细胞, 另一类是体积要明显大于前者的组织细胞, 常脱落于腔隙中, 两种细胞均无异型性。根据上述特点本研究13例LCA均符合其形态学特征。
与正常的脾窦岸细胞、海绵状血管瘤、淤血性脾肿大不同的是LCA表达组织细胞与内皮细胞标记物, 如小细胞中CD31、多克隆FⅧ RAg呈阳性, CD34和组织细胞分化抗原呈阴性, 免疫表型与脾血管内皮细胞、海绵状血管瘤不同, 但是与病变周围脾窦、正常脾和淤血脾之血窦内皮细胞相似, 提示小细胞就是窦岸细胞, 大细胞则表达组织细胞分化抗原, CD34和FⅧ RAg呈阴性, 提示大细胞是组织细胞, 两种细胞均不表达S-100[10]。由于LCA中的窦岸细胞表达血管内皮和组织细胞标记物, 因此可能是一种免疫功能相关的内皮细胞, 具有更强的物质摄取和转运功能, 与脾的血液滤过有关。
LCA的形成机制可能为某种原因使得脾局部血流状态改变, 从而导致窦岸细胞增生, 脾窦扩张并相互吻合形成局部血管瘤样改变, 伴组织细胞反应[10]。Falk等[2]认为LCA就是窦岸细胞增生而形成的血管肿瘤, 呈现内皮细胞和组织细胞双向分化。本研究13例LCA中窦岸细胞CD31、FⅧ RAg 、CD68均呈强阳性表达, 表明该细胞具有内皮细胞-组织细胞混合性免疫表型, 可能具有上述两种细胞的功能和特性。ETS相关基因(ETS-related gene, ERG)属于转录因子E-26转化特异(E-26 transformation-specific, ETS)家族成员, 在血管生成、造血和骨骼发育中起重要作用, 约有40%~50%的前列腺癌呈ERG高表达, 它与雄激素诱导的TMPRRSS2基因的启动子区域发生基因融合, 导致前列腺癌的发生[11]。ERG还可以在某些髓系肿瘤和尤文肉瘤呈阳性表达, 因此是一种潜在的癌基因。有研究表明[12], ERG通过对CLDN5目的基因的转录调控从而调节血管内皮细胞屏障功能, ERG的下调导致血管通透性增加。ERG在血管和淋巴管内皮细胞核中呈持续阳性表达, 而在血管周细胞和平滑肌细胞则为阴性, 因此它可能是一种新型血管肿瘤标记物[13]。WT-1是一种肿瘤抑制基因, 位于11p13染色体, WT-1蛋白在许多肿瘤中表达, 尤其是在间皮肿瘤和卵巢浆液性癌中呈强阳性表达。WT-1还可以对血管生成、血管平滑肌细胞增生起重要作用, 在毛细血管瘤中内皮细胞胞浆呈阳性表达, 而在海绵状血管瘤、淋巴管瘤和血管外皮瘤少见阳性[14]。ERG和WT-1是两种新一代血管标记物, 具有较高敏感性和特异性。O'Malley等[15]对5例LCA、6例血管瘤(海绵状、毛细血管和硬化性血管瘤各2例)、3例错构瘤、2例正常脾、1例紫癜病、1例硬化性血管瘤样结节转化、1例异常血红蛋白病继发性梗死及1例T细胞性大粒淋巴细胞性白血病/淋巴瘤进行免疫组织化学染色后发现:在正常窦岸细胞中, ERG和WT-1均呈核强阳性着色, 在LCA和海绵状血管瘤中肿瘤细胞EGR呈阳性表达, 而两者肿瘤WT-1则均为阴性, 因此, LCA可能与海绵状血管瘤存在一定关联性, 而非正常的窦岸细胞来源。与正常脾红髓血窦内皮细胞呈CD8(+)/CD21(-)表达的模式不同, LCA中的窦岸细胞的表达模式为CD8(-)/CD21(+)[16], 由此可见, LCA的肿瘤细胞可能不同于正常的窦岸细胞, 但是还需要进一步深入研究。本研究13例LCA的窦岸细胞中CD21和ERG呈阳性表达, CD8和WT-1为阴性; 对照组中, 5例海绵状血管瘤ERG为阳性表达, WT-1、CD21和CD8均为阴性; 4例正常脾窦岸细胞ERG、WT-1和CD8均呈阳性表达, CD21为阴性。结合传统和新型标记物, 本课题发现LCA的免疫表型与对照组不同, 有助于准确地进行诊断和鉴别诊断。
3.5.1 血管瘤 分为毛细血管和海绵状血管瘤, 通常有扩张的或裂隙样血管腔隙, 内衬扁平的内皮细胞, 在不同的组织阶段血管腔内常见微血栓, 常表达内皮细胞标记CD31、CD34、FⅧ RAg, 而组织细胞标记、CD8则为阴性表达。
3.5.2 血管肉瘤 血管肉瘤表现为由相互吻合的呈迷宫样血管腔隙构成, 管腔内衬梭形、多形性及上皮样的体积较大伴非典型性内皮细胞, 常可见核分裂像, 瘤细胞沿血管壁成巢状或乳头状生长浸润。
3.5.3 血管内皮瘤 血管内皮瘤形态特点是在黏液样基质中肿瘤细胞排列成巢状、索状, 核空泡状, 可见小核仁, 胞质常见管腔或空泡, 管腔见红细胞, 细胞呈梭形具有非典型性, 核分裂象和坏死多见, 后两者免疫表型同血管瘤。
3.5.4 窦岸细胞血管肉瘤 窦岸细胞血管肉瘤可见血管吻合, 内皮细胞呈片状增生, 常伴出血坏死及核分裂。与LCA不同的是窦岸细胞血管肉瘤CD8和CD34为阳性表达, CD21、FⅧ RAg为阴性表达[17], 该肿瘤的Ki-67增值指数较高。
3.5.5 硬化性血管瘤样结节转化 被认为是一种错构瘤的亚型, 近几年才确定该病名称, 主要由红髓构成, 而缺乏白髓成分, 镜下见多结节性血管瘤样改变, 结节中间聚集狭窄或窦样血管腔, 周围被胶原纤维组织包绕。结节内血管内皮细胞免疫表型异质化, 小血管内皮细胞呈CD31(+)/CD34(-)/CD8(-), 窦样血管则呈CD31(+)/CD34(-)/CD8(+)[18]表达。
3.5.6 错构瘤 与硬化性血管瘤样结节转化类似, 主要由红髓构成, 但是不形成纤维包绕的结节样外观, 免疫表型两者相似。
此外, 淋巴瘤、转移瘤、淋巴管瘤、炎性假瘤等肿瘤具有不同的形态学特点和免疫表型, 鉴别不难。
虽然将LCA归为中间型肿瘤, 但是大部分呈现良性经过, 预后较好, 进行脾切除即可治愈。有少数的LCA有恶性特征, 将这种具有恶性特征的LCA分为低级别变异型(窦岸细胞血管内皮瘤)和血管肉瘤[4]。部分患者伴发有内脏恶性肿瘤或慢性感染, 基于上述情况, 对患者进行长期随访是必要的。本课题组对所有的13例患者进行了10~62个月的随访, 平均随访29.8个月, 仅2例因为其他部位的恶性肿瘤导致肿瘤复发或死亡, 其余11例患者均未出现复发。
综上所述, LCA呈良性经过, 其临床病理特征、发病机制、免疫表型、肿瘤细胞特性尚待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|