目的 观察模拟载人飞船中微重力和噪声环境下大鼠耳蜗毛细胞的形态学特点,探讨耳蜗三回(底回、中回和顶回)毛细胞的不同变化。方法 选取32只雄性健康SD大鼠,随机分为空白组、失重组、噪声组和失重+噪声组4组,每组8只。失重组以持续尾吊法模拟微重力,噪声组以持续2周的(72±2) dB SPL的稳态噪声及之后的3次高达160 dB SPL的脉冲噪声模拟飞船内复合噪声环境,失重+噪声组同时给予模拟微重力和噪声环境,空白组不做任何处理,常规饲养2周。暴露后检测听性脑干反应(auditory brainstem response, ABR)阈值,处死大鼠即刻取耳蜗基底膜行免疫荧光及扫描电子显微镜(scanning electron microscope, SEM)观察。结果 给予模拟环境暴露后,各组大鼠ABR阈值升高,各实验组大鼠暴露前后ABR阈值差异均有统计学意义( P<0.05)。免疫荧光结果显示:失重组底回以内毛细胞缺失为主,中回可见毛细胞肿胀,顶回毛细胞杂乱不清。噪声组底回以外毛细胞缺失为主,多见于最外层毛细胞,中回毛细胞肿胀,顶回杂乱并有毛细胞的缺失。失重+噪声组底回核缺失较明显,主要存在最外层毛细胞,内毛细胞也存在较多缺失。中回和顶回缺失发生在最内层外毛细胞。电子显微镜观察发现失重组底回纤毛大片倒伏,偶有缺失,顶回和中回毛细胞纤毛无明显异常。噪声组底回纤毛大片倒伏伴缺失,顶回和中回均有缺失,其中顶回最为严重。失重+噪声组底回纤毛大片融合伴缺失,中回纤毛融合、倒伏并缺失,顶回内外毛细胞纤毛大量缺失。4组的损伤程度:失重+噪声组>噪声组>失重组>空白组;三回毛细胞损伤程度:底回>中回>顶回。结论 模拟载人飞船内微重力和噪声环境中暴露2周可致大鼠耳蜗形态学结构发生显著变化,尤以失重+噪声组变化最明显,三回毛细胞中以底回最重,顶回最轻。
Objective: To observe the morphological changes on cochlear hair cells of rats in simulated weightlessness and inboard noise and to investigate the different changes in three turns of hair cells.Methods: Thirty-two healthy SD rats, all males, were randomly divided into four groups: control group, weightlessness group, noise group and weightlessness+noise groups ( n=8). Then rats were exposed to -30° head down tilt as simulated weightlessness and inboard noise including steady-state noise which was (72±2) dB SPL and impulse noise up to 160 dB SPL in spaceship environment. The control group was kept in normal condition for 8 weeks. Bilateral auditory brainstem response (ABR) thresholds were tested before and after exposure respectively, and immunofluorescence staining and scanning electron microscopy (SEMs) of basilar membrane were applied after exposure.Results: ABR threshold shifts of each group were higher after exposure. There was difference between ABRs of the experiment groups before and after exposure ( P<0.05). IF showed that the inner hair cells (IHCs) missing was the main damage in the basal turn of weightlessness group, the hair cells in the middle turn were swell and in the top turn, the hair cells were not clear. In noise group, the main loss happened in the outer hair cells (OHCs) of the outermost layer. In weightlessness+noise group, the nuclear missing in the basal turn was apparent, and mainly happened at the outermost layer. Meanwhile, the missing of hair cells in the middle turn and top turn was seen at the innermost layer. SEM showed that the cilia in the basal turn of weightlessness group were serious lodging, and occasional absence. Furthermore, the basal cilia in noise group became lodged and absent, and the other two turns were seriously missing. And in weightlessness+noise group, the cilia missing in the basal turn was apparently seen. The damage degree of the four groups: weightlessness+noise group>noise group>weightlessness group>control group and the damage degree of the four turns of hair cells: basal turn>mid turn>top turn.Conclusion: The rats exposed to the above environment for 2 weeks displayed obvious changes in cochlea morphology, and the weightlessness+noise group had the most obvious damage.
宇航员在航天飞行过程中持续暴露于微重力、噪声等复杂环境, 其听阈会产生暂时性或永久性阈移, 进而造成听力的损失[1], 因此有必要深入研究载人航天环境下听力损失的机制, 为宇航员的听力防护做临床指导。既往研究表明[2, 3, 4], 听觉感受器中主要起作用的是耳蜗基底膜上的Corti器, Corti器上存在的毛细胞是感受机械刺激从而实现声学-电学转化的关键部位, 对听觉的产生至关重要。毛细胞的损伤是导致感音神经性聋的重要病理基础, 常见的药物性聋、老年性聋、噪声性聋等均与耳蜗毛细胞的损伤有关[5, 6], 但目前毛细胞在噪声及微重力复合环境下的形态学变化尚不明确。
本研究旨在模拟载人飞船内微重力和噪声环境对内耳的损伤, 主要通过听性脑干反应(auditory brainstem response, ABR)阈值来判断听力损伤情况, 并在基底膜铺片后用4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)染料染核和扫描电子显微镜(scanning electron microscope, SEM)来观察耳蜗毛细胞的胞核及纤毛的损伤情况, 为正确评估暴露后听力及毛细胞的损伤状况提供依据。
32只雄性SD大鼠购自北京市兴隆实验动物养殖场, 体重为180~200 g, 耳廓反应灵敏, 鼓膜清晰, 无药物使用史及强声暴露史。随机分为空白组、失重组、噪声组和失重+噪声组4组, 每组8只(16耳)。各组大鼠在实验前均进行ABR阈值检测, 未见差异。失重组以持续尾吊法模拟微重力环境, 噪声组以持续2周的(72± 2)dB SPL的稳态噪声及之后的3次160 dB SPL的脉冲噪声模拟飞船内噪声环境, 失重+噪声组同时给予模拟微重力和噪声环境, 空白组不做任何处理, 常规饲养2周。
采用目前国际通用的头低位模拟微重力法(Morey-Holton法[7]), 尾部用胶带缠在悬吊的铁丝上, 保持大鼠臀高头低位, 后肢离地, 身体纵轴与桌子水平面呈-30° 夹角, 悬吊2周。在悬吊期间保证所有大鼠自由活动、自由进食。
本实验噪声为稳态噪声与脉冲噪声的复合环境。稳态噪声由信号发生器(白噪UZ-3型), 经均衡器(MEQ)和功率放大器(PA-1000)传到扬声器(YZ20-7), 扬声器置于鼠笼的正前方。稳定噪声声级用BK2250手持式分析仪测量, 其声压级为(72± 2)dB SPL, 每天持续给予8 h稳态噪声暴露。暴露2周结束后给噪声组和失重+噪声组大鼠脉冲噪声。脉冲噪声由气动激波管产生传到传声器(BK4136), 峰值声压级为160 dB, 有效持续时间为30 ms, 每次间隔为1 min, 给噪3次。脉冲噪声声级由BK2209精密脉冲声级计测量, 用TDS2022数字示波器记录波形。
所有大鼠在实验前均进行ABR阈值检测。实验组大鼠持续暴露于相应环境2周后, 空白组大鼠常规饲养2周后即刻进行ABR阈值检测。大鼠给予马来酸咪达唑仑(80 mg/kg)和盐酸赛拉嗪注射液(200 mg/kg)进行肌肉注射麻醉, 麻醉深度达角膜反射消失, 必要时给予总量的20%~30%维持, 应用听性脑干反应仪在隔声静电屏蔽室内检测短声诱发(滤波带宽80~3000 Hz, 叠加次数1 024 次, 扫描10 ms)的双耳听性脑干反应阈值。刺激强度为5~97 dB SPL, 间隔5 dB, 以“ 重复性好, 比较稳定的Ⅲ 波” 为标准判断反应阈值。电极设置:颅顶为记录极, 测试耳为参考极, 鼻尖处为地线。测试及麻醉复苏过程中保持环境温度在38 ℃左右, 并用热水瓶保持大鼠体温恒定。
大鼠暴露2周后处死取其耳蜗, 将左侧耳蜗置于4%(体积分数)多聚甲醛液中, 在解剖显微镜下摘除镫骨, 用细针于蜗顶钻一小孔, 将4%多聚甲醛缓慢灌流蜗管内并置于4%多聚甲醛中固定, 在4 ℃冰箱过夜后用PBS漂洗3次, 每次5 min。用10%(质量分数)EDTA脱钙2周, 物理法测定脱钙终点。取右侧耳蜗, 用2.5%(质量分数) 戊二醛固定, 磷酸缓冲液(pH=7.4)充分浸洗, 1%(质量分数)四氧化锇固定, 在解剖显微镜下进行离体耳蜗灌注。固定4 h后, 采用硬剥法暴露出基底膜。
取出左侧固定后的耳蜗, 在解剖显微镜下用游丝镊于PBS溶液中剥除盖膜、螺旋韧带等部位, 取出基底膜。将分离好的基底膜置于小EP管中, PBS 漂洗3次, 每次5 min; 用细针吸出PBS 溶液后, 加入2滴5%(质量分数)BSA溶液完全覆盖基底膜, 常温下封闭30 min, 再以 PBS 溶液漂洗 3次, 每次5 min, 放入 4 ℃冰箱过夜。第2天取出标本, 之后所有操作均在避光条件下进行, 以 PBS 溶液漂洗3次, 每次5 min; 吸出PBS溶液, 加入DAPI溶液反应10 min, 以PBS溶液漂洗3 次, 每次5 min; 将基底膜取出, 平铺于洁净的载玻片上, 滴加两滴甘油, 盖上盖玻片, 将玻片置于共聚焦显微镜(Zeiss LSM 880)下, 在放大60倍下观察, DAPI激发波长为405 nm, 410~490 nm接收。实验中对所观察区域的毛细胞进行序列扫描, 扫描层距设定为2.0 μ m。
取出右侧固定后的基底膜, 用2%(质量分数)单宁酸导电染色, 梯度脱水, 醋酸异戊酯过渡, 进行标本干燥、镀金等处理, 置于扫描电子显微镜(Hitachi S4800)下观察。
采用SPSS 22.0软件进行统计学分析, 计量资料以均数± 标准差表示, 各组ABR阈移比较采用方差分析, P< 0.05认为差异有统计学意义。
各组大鼠实验前ABR阈值差异无统计学意义(P> 0.05), 实验后4组大鼠ABR阈值均较实验前明显升高(P< 0.01), 实验后失重组与空白组差异无统计学意义(P=0.11), 其余各组间差异均有统计学意义(P< 0.01)。
| 表1 各组大鼠ABR阈值(dB SPL, \(\overline{x}\)± s) Table 1 The ABR threshold of rats in different groups(dB SPL, \(\overline{x}\)± s) |
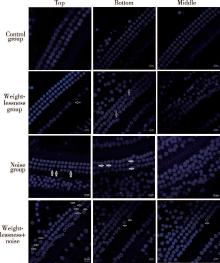 | 图1 各组大鼠耳蜗毛细胞免疫荧光(DAPI × 60)Figure 1 The immunofluorescence of rats’ cochlea hair cells in different groups (DAPI × 60) |
空白组三回结构完整, 毛细胞排列整齐, 未见明显异常。失重组底回以内毛细胞缺失为主, 中回可见毛细胞肿胀, 顶回毛细胞杂乱不清但无明显缺失。噪声组底回以外毛细胞缺失为主, 多见于最外层毛细胞, 中回毛细胞肿胀, 以中层和外层毛细胞为主, 顶回杂乱并偶有毛细胞的缺失。失重+噪声组底回以外毛细胞缺失为主, 同样多见与最外层外毛细胞, 中回多存在外毛细胞的缺失, 顶回也存在毛细胞缺失。4组的损伤程度:失重+噪声组> 噪声组> 失重组> 空白组; 三回损伤程度:底回> 中回> 顶回。
空白组三回毛细胞清晰, 排列整齐, 未见明显缺失, 偶有纤毛轻度融合。失重组顶回纤毛大片倒伏, 偶有缺失, 底中回毛细胞纤毛无明显异常。噪声组顶回纤毛大片倒伏伴缺失, 中、底回均有缺失, 底回最为严重。失重+噪声组顶回纤毛大片融合伴缺失, 中回纤毛融合、倒伏并缺失, 底回内外毛细胞纤毛大量缺失。4组的损伤程度:失重+噪声组> 噪声组> 失重组> 空白组; 三回损伤程度:底回> 中回> 顶回。
随着我国载人航天事业的飞速发展, 航天员的身体状况越发引起人们的重视, 载人飞船中存在的微重力、噪声、辐射等因素都对航天员身体有一定程度的影响[8], 其中, 噪声和微重力环境对听力影响较大, Roller等[1]通过回顾性研究, 发现单次飞行就可能诱导航天员产生较大的暂时性阈移和一个小但显著的永久性阈移, 虽然单次飞行对航天员听力影响不大, 但多次累积会使航天员产生具有明显临床症状的听力损失, 而超过135 dB的脉冲噪声则可使耳蜗 Corti 器从基底膜上剥离[9, 10]。本课题组既往已通过较多实验证实[11, 12], 微重力对听觉功能有一定的损伤作用。本研究通过ABR阈值检测、免疫荧光和扫描电子显微镜的方式, 更加直观地展示了暴露于模拟微重力和复合噪声环境下大鼠耳蜗毛细胞的变化情况, 能深入全面地了解听力损伤与毛细胞超微结构之间的关系。由于噪音、耳毒性药物等原因导致的毛细胞的不可逆性损伤和缺失是导致听力下降的首要因素, 临床上可以对毛细胞缺失或肿胀的情况进行针对性干预, 利用基因敲除等技术使毛细胞再生重建听觉系统, 尽可能恢复患者听力, 进一步指导临床预防与治疗。
本研究发现, 失重组大鼠与空白组大鼠的ABR阈值相比差异有统计学意义, 说明微重力条件会造成动物听力的缺失, 这在大鼠、豚鼠的相关实验中已得到验证[11]。免疫荧光的结果显示微重力环境下主要造成内毛细胞的缺失, 中回外毛细胞损伤以内层为主, 说明微重力所致听力损伤主要与内毛细胞的缺失及内层外毛细胞的损伤有关。在微重力环境下血流动力学和体液分布发生的变化不利于听觉器官保持正常的生理结构和功能, 内毛细胞与外毛细胞间的支持细胞由于微重力作用失去原有的结构, 其支持作用受到影响, 影响到内毛细胞的稳态结构, 导致内毛细胞损伤较重, 其详细机制尚待对支持细胞进行进一步研究。
本实验采用的模拟噪声环境是持续2周的(72± 2)dB SPL的稳态噪声及之后的3次160 dB SPL的脉冲噪声, 通过观察噪声组大鼠的免疫荧光和电子显微镜下形态结果, 发现噪声所致大鼠毛细胞损伤主要是以外毛细胞为主, 内毛细胞损伤较小, 此结果与周灿[13]的实验结论相符。本研究免疫荧光结果显示噪声组大鼠基底膜底回毛细胞缺失多见于最外层外毛细胞, 与孙建和等[14]的研究一致。本研究发现噪声暴露后毛细胞损伤程度以底回最重, 其次为中回, 顶回损伤最轻, 说明外毛细胞对噪声性损伤最为敏感, 可能的机制为声刺激对耳蜗基底膜中部的震动幅度最大, 外毛细胞尤其是最外层外毛细胞靠近耳蜗基底膜中部, 受到的机械性损伤最为严重, 而内毛细胞位于耳蜗基底膜内侧, 靠近骨螺旋板, 振动幅度小, 受到一定的保护, 不易受到损伤[15]。声音在基底膜上是以声波的方式传播, 在基底膜上的振动波从蜗底向蜗顶传播的过程中, 振幅逐渐增大, 高频声波主要引起蜗底靠近前庭窗附近的基底膜振动, 低频声波则主要引起靠近顶周的基底膜振动。本研究持续8周的稳态噪声主要影响蜗顶区, 随后的3次高频脉冲主要影响蜗底区, 蜗顶比蜗底损伤大, 说明复合噪声对听觉的损伤主要是由高频脉冲引起的, 而微重力和噪声的复合因素对毛细胞的影响更大, 两者对听觉系统的损伤有一定程度的协同作用。
综上所述, 在不同的暴露条件下, 毛细胞超微结构也有不同位置和程度的变化, 实验中毛细胞核的变化比较明显, 但其是否与神经调节或支持细胞的变化有关, 尚待进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|



