目的 研究牙源性角化囊性瘤(keratocystic odontogenic tumour, KCOT)中 PTCH1基因突变与上皮细胞中bcl-2、丝聚合蛋白和兜甲蛋白表达的关系,探讨 PTCH1基因突变对肿瘤上皮细胞增殖、分化的影响。方法 采用PCR直接测序法筛选出有 PTCH1基因突变的KCOT患者及无突变者各20例,用免疫组织化学方法检测上皮细胞增殖相关蛋白bcl-2、丝聚合蛋白、兜甲蛋白在KCOT上皮细胞中的表达情况。结果 20例 PTCH1基因发生突变的KCOT患者中,bcl-2强阳性12例(12/20, 60%)、中度阳性4例(4/20, 20%)、弱阳性4例(4/20, 20%),非突变组中强阳性4例(4/20, 20%)、弱阳性10例(10/20, 50%)、阴性6例(6/20, 30%),两组之间差异有统计学意义( U=72, P=0.001)。丝聚合蛋白表达于上皮浅层1~4层细胞,突变组中丝聚合蛋白表达弱阳性11例(11/20, 55%)、阴性9例(9/20, 45%),未见强阳性和中度阳性表达,非突变组中丝聚合蛋白表达中度阳性6例(6/20, 30%)、弱阳性8例(8/20, 40%)、阴性6例(6/20, 30%),无强阳性表达病例,两组之间差异无统计学意义( U=182, P=0.48)。兜甲蛋白在突变组和非突变组KCOT衬里上皮细胞全层均呈阳性表达,两组差异无统计学意义。结论 PTCH1基因突变与KCOT肿瘤上皮细胞中bcl-2蛋白的表达水平相关,提示 PTCH1基因突变可能促进肿瘤上皮细胞的增殖和分化。
Objective: To explore the relationship between the PTCH1 mutation and the expression of bcl-2, filaggrin, and loricrin in the keratocystic odontogenic tumour (KCOT), as well as the effects of the mutated PTCH1 on the epithelial proliferation and differentiation.Methods: The samples were collected from 20 cases of KCOT with mutated PTCH1, as well as 20 cases without mutation. All the samples were analyzed with immunohistochemical staining, for the purpose of investigating the expression of bcl-2, filaggrin, and loricrin.Results: In the samples with mutated PTCH1, the epithelia of 60% (12/20) cases expressed intensively positive bcl-2 staining, 20% (4/20) expressed moderate staining, and 20% (4/20) weak staining, but no negative bcl-2 staining samples were investigated; it was significantly different from the samples without PTCH1 mutation, in which 20% (4/20) expressed intensive staining, no moderate staining, 50% (10/20) weak staining, and 30% (6/20) negative staining were investigated ( U=72, P=0.001). For the expression of filaggrin, 55% (11/20) of samples with PTCH1 mutations were stained weakly and 45% (9/20) showed negative staining, while in the samples not harboring PTCH1 mutations, 30% (6/20) cases showed moderate positive staining, 40% (8/20) weak staining and 30% (6/20) negative staining, no intensive staining was investigated ( U=182, P=0.48). The loricrin expressed in all the layer of the epithelia in all the samples, while the filaggrin was mainly loca-lized within 1-4 layer cells of the epithelia. The differences of the expression of filaggrin and loricrin between the samples with mutated PTCH1 and without mutated PTCH1 displayed no significance.Conclusion: In the epithelia of KCOT, the bcl-2 expression was significantly associated with the PTCH1 mutation, which suggested that the mutated PTCH1 gene perhaps promotes the proliferation of KCOT epithelium.
牙源性角化囊性瘤(keratocystic odontogenic tumour, KCOT)是颌骨常见的牙源性肿瘤, 约占牙源性肿瘤的38.7%[1], 组织学表现为较薄的复层鳞状上皮衬里, 不全角化, 上皮细胞具有较强的增殖能力, 纤维囊壁薄, 手术常不能完整摘除。KCOT的生长缺乏自限性, 易复发, 常沿抗力较弱的骨小梁呈浸润性生长, 造成大面积颌骨吸收。KCOT常单发, 也可与痣样基底细胞癌综合征(nevoid basal cell carcinoma syndrome, NBCCS)伴发, 伴发者往往表现为多发性KCOT, 病程迁延反复, 给患者造成极大的负担[2, 3]。
PTCH1是高度保守的抑癌基因, 位于9q22-31, 全长51 kb, 编码全长为1 447个氨基酸的12次跨膜蛋白patched。PTCH1的突变可能引起patched蛋白功能丧失或异常, 从而导致SHH信号通路异常激活或紊乱, 进而引起发育异常和细胞异常增殖[4]。有文献报道, PTCH1是KCOT重要的致病基因, 约84%的单发型KCOT和约85%伴发NBCCS型KCOT携带有PTCH1基因的突变。
已有的研究表明, SHH信号通路的异常激活可促进角质形成细胞的增殖[5], bcl-2基因是bcl-2家族重要的抗凋亡基因, 是上皮细胞增殖的重要分子标志之一, 然而关于KCOT衬里上皮细胞的增殖和分化与PTCH1突变的联系, 目前的研究报道不多[6, 7]。
丝聚合蛋白(filaggrin)又称为微丝凝聚蛋白, 是一种广泛存在于皮肤表皮的碱性蛋白质, 主要功能是与角蛋白中间丝相互作用, 协同角蛋白的聚集, 从而起到维护皮肤屏障的功能[8]。兜甲蛋白(loricrin)是表皮细胞分化复合物和角化细胞被膜的主要成分, 也是表皮细胞抵御外环境物理刺激的主要屏障[9]。两者是正常皮肤分化相关蛋白, 其在KCOT衬里上皮细胞中的表达模式, 以及是否与PTCH1的突变有关尚缺乏相关研究。
本研究根据KCOT上皮衬里是否携带PTCH1基因突变将患者分组, 分析KCOT衬里上皮细胞增殖相关蛋白bcl-2和分化相关的丝聚合蛋白、兜甲蛋白的表达与上皮细胞PTCH1基因突变的关系, 探讨PTCH1突变对KCOT衬里上皮细胞增殖和分化的意义。
纳入北京大学口腔医院2011年9月至2015年9月收治的KCOT患者肿瘤组织标本共40例, 纳入标准:(1)经北京大学口腔医院病理科诊断为KCOT, (2)原发病例, (3)无炎症浸润。通过PCR直接测序将KCOT患者分为突变组(KCOT-PTCH1+/-)和非突变组(KCOT-PTCH1+/+), 其中突变组最小年龄13岁, 最大年龄73岁, 中位年龄30岁, 非突变组最小年龄20岁, 最大年龄71岁, 中位年龄34岁。
将KCOT冰冻组织厚度为10 μ m的切片5~6片置于显微切割机专用载玻片上, 进行KCOT衬里上皮的切割, 迅速将切下的衬里上皮组织切片放入1.5 mL离心管中, 根据Qiagen DNA提取试剂盒提供的方法, 加入1 mL二甲苯, 旋涡振荡10 s, 14 000 r/min 离心2 min, 弃上清液, 加入1 mL无水乙醇, 充分混匀后, 14 000 r/min离心2 min, 弃上清液, 室温静置10 min, 加入180 μ L 组织蛋白裂解液(tissue total protein lysis buffer solution, ATL)缓冲液重悬沉淀, 再加入20 μ L蛋白酶K, 充分混匀, 56 ℃过夜孵育直至完全溶解。分别加入200 μ L Buffer 碱性裂解液(alkaline lysis solution, AL)和200 μ L无水乙醇, 充分混匀, 将样品转移至QIAamp吸附柱内, 8 000 r/min离心1 min, 清洗2次, 加入20~100 μ L Buffer DNA电泳缓冲液TAE至膜中央位置, 室温孵育1 min, 14 000 r/min离心1 min。Nanodrop2000检测DNA的浓度并记录, 保存于-20 ℃冰箱。
PTCH1基因22个外显子行PCR扩增, 采用30 μ L体系, 包括:10× buffer, Taq聚合酶, dNTP mix, Mg2+, 正、反向引物和DNA模板。反应程序为:94 ℃预变性5 min, 94 ℃变性30 s, 65 ℃退火30 s, 72 ℃延伸30 s, 35个循环, 72 ℃延伸10 min。Exon 2、14a、14b、20、23a、23b采用touch-down PCR。取5 μ L PCR产物进行1.5 g/L琼脂糖凝胶电泳, 用凝胶成像仪观察。将PCR反应产物送上海英骏生物技术有限公司(ABI 3700测序仪)进行测序, 正向测序发现异常的样本进行反向测序和2次以上独立PCR产物测序验证比对, 测序反应所用的引物与PCR反应所用引物相同。
将40例KCOT石蜡组织标本进行组织切片(厚度0.4 μ m), 55 ℃烤片4 h, 二甲苯脱蜡, 水化, 3%(体积分数)的H2O2孵育30 min以阻断内源性过氧化物酶的活性, 柠檬酸盐缓冲液(pH 6.0)微波修复30 min, 孵育一抗bcl-2(ZM-0221, 北京中衫金桥生物制品有限公司)、filaggrin (Abcam, USA)、loricrin (Abcam, USA) 4 ℃过夜, 二抗为超敏型二步法检测试剂盒(PV-9000, 北京中衫金桥生物制品有限公司), DAB显色10 s至1 min, 苏木素复染, 封片。以人正常上皮细胞作为对照。
高倍视野下, 每个病例随机取5个视野, 不少于1 000个细胞, 利用IPP软件计算阳性细胞的百分率, 进行分级评定:阳性细胞数< 25%为阴性(-), ≥ 25%、< 50%为低表达(+), ≥ 50%、< 75%为中等表达(++), ≥ 75%为高表达(+++)。实验数据采用SPSS 19.0统计软件, 运用Mann-Whitney秩和检验方法统计分析, 以 P< 0.05为差异有统计学意义。
对KCOT衬里上皮细胞中PTCH1基因的22个外显子片段进行扩增并且直接测序, 根据临床病理表现和测序结果, 20例KCOT-PTCH1+/-组中包括6处无义突变、8处移码突变、2处框内复制、3处错义突变、1处框内缺失(表1)。
| 表1 KCOT患者中PTCH1基因的突变 Table 1 Summary of PTCH1 mutations in KCOT |
Bcl-2阳性表达于KCOT衬里上皮的基底层和基底上层细胞, 胞质和胞膜可见阳性染色。20例KCOT-PTCH1+/-中高表达12例(12/20, 60%), 中度表达4例(4/20, 20%), 低表达4例(4/20, 20%); 20例KCOT-PTCH1+/+中高表达4例(4/20, 20%), 低表达10例(10/20, 50%), 阴性6例(6/20, 30%), 两组间差异有统计学意义(U=72, P=0.001, 图1、2, 表2)。
| 表2 KCOT-PTCH1+/-和KCOT-PTCH1+/+肿瘤上皮细胞中bcl-2蛋白的表达(n=20) Table 2 Relationship of bcl-2 expression between KCOT-PTCH1+/-and KCOT-PTCH1+/+(n=20) |
丝聚合蛋白表达于衬里上皮表层1~4层细胞及角化物, 胞质呈阳性染色。突变组的染色强度稍弱于非突变组, 阴性比率相对稍高。对染色结果进行统计分析显示, 两组间差异没有统计学意义(P> 0.05, 表3, 图2)。
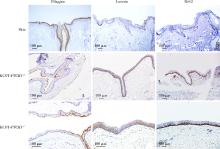 | 图2 KCOT-PTCH1+/+、KCOT-PTCH1+/-和人正常皮肤中bcl-2、filaggrin、loricrin的表达(免疫组织化学染色 × 10)Figure 2 Expression of bcl-2, filaggrin, loricrin in the KCOT-PTCH1+/+, KCOT-PTCH1+/- and the human normal skin (immunohistochemistry × 10) Abbreviations as in Table 2. |
| 表3 KCOT-PTCH1+/-和KCOT-PTCH1+/+肿瘤上皮细胞中丝聚合蛋白的表达(n=20) Table 3 Relationship of filaggrin expression between KCOT-PTCH1+/- and KCOT-PTCH1+/+(n=20) |
兜甲蛋白阳性表达于衬里上皮的全层, 胞质、胞核均阳性染色, 但表层1~2层细胞阳性染色减弱, 两组KCOT衬里上皮均呈现全层或几乎全层的阳性表达, 统计学分析显示组间差异没有统计学意义(图2)。
目前认为, KCOT可能来源于牙板上皮剩余, 在受到外界刺激后这些上皮剩余可获得较高的增殖潜能, 从而导致颌骨囊性/实性肿瘤的发生。有文献报道, KCOT具有特殊的生长方式和骨破坏能力, 术后容易复发, KCOT特殊的临床病理表现与其衬里上皮细胞具有较高的增殖潜能密切相关[10]。
PTCH1是SHH信号通路的抑制基因, PTCH1基因突变可异常激活下游信号通路, 参与调控细胞的增殖和分化, 是KCOT的致病基因。
Bcl-2基因是bcl-2家族中重要的抗细胞凋亡基因, 能够抑制细胞凋亡、延长细胞寿命, 对人体细胞的凋亡过程有着明显的控制作用, 且bcl-2蛋白的过表达与磷酸化也参与人体组织细胞的增生调控过程, 与多种肿瘤(如淋巴瘤、乳腺癌、头颈部鳞状细胞癌等)的发生、发展密切相关[11, 12]。本研究结果表明, bcl-2在发生PTCH1突变的KCOT衬里上皮细胞中呈现更高的阳性表达率, 差异有统计学意义, 说明bcl-2的表达与PTCH1突变高度相关, bcl-2的高表达表明基底层及基底上层细胞不仅被突变的PTCH1赋予了较强的增殖能力, 该突变还很可能通过异常激活了SHH信号通路, 赋予了KCOT上皮细胞抗凋亡的功能。
在正常表皮中, 丝聚合蛋白仅分布在紧靠角化层的颗粒细胞层中, 棘细胞层、基底层均无表达[13]。本研究在KCOT衬里上皮中观察丝聚合蛋白的表达模式, 发现其表达于衬里上皮的浅层1~4层, 尽管突变组和非突变组间差异无统计学意义, 但该蛋白仍提示KCOT衬里上皮细胞的分化程度低, 处于较早期的分化状态, 可能与肿瘤容易手术种植复发相关。
正常颊黏膜中兜甲蛋白均呈阴性表达, 有关口腔黏膜纤维化的研究发现, 兜甲蛋白主要表达于黏膜上皮棘层上部和角化层[14, 15]。本研究显示, 兜甲蛋白在KCOT衬里上皮中全层均有表达, 组间差异无统计学意义, 提示KCOT衬里上皮细胞分化过程紊乱, 与丝聚合蛋白的表达一致, 但与PTCH1基因突变并无相关性, 可能由于受PTCH1基因调控的SHH信号通路并非维持上皮细胞正常分化的唯一通路, 其他许多通路(如notch信号通路等)在正常上皮细胞的增殖、分化过程中也有重要意义[16, 17], 且细胞的生物学活动并非由简单的某个或某些分子所支配和调控。丝聚合蛋白和兜甲蛋白的表达调控模式有待于进一步研究。
本研究对KCOT衬里上皮细胞的增殖和分化情况进行了研究分析, 丝聚合蛋白和兜甲蛋白的表达提示KCOT衬里上皮细胞分化较低, 而bcl-2的高表达说明该上皮细胞缺乏正常的凋亡过程, 这种抗凋亡的功能与PTCH1突变相关, 提示PTCH1突变除了导致细胞异常增殖, 对细胞抗凋亡能力也有一定作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|



