目的:结节性硬化症是由于 TSC1和 TSC2基因突变导致累及多个器官、系统的常染色体显性遗传疾病, TSC2突变更为常见而且临床表型更为严重。为探讨结节性硬化症细胞株TSC2-/- MEFs与正常细胞株TSC2+/+ MEFs中微小RNA(microRNA,miRNA)表达谱的差异,以进一步研究相关miRNA在结节性硬化症发病机制中的作用奠定基础。方法:体外培养结节性硬化症细胞株TSC2-/- MEFs和正常细胞株TSC2+/+ MEFs,各选取3个样本分别作为实验组和对照组。用TRizol法提取细胞的总RNA,以紫外吸收测定法和变性琼脂糖凝胶电泳对RNA进行质量检测。采用miRNA芯片筛选两者之间差异表达的miRNA,样品间表达变化标准以上调至原2倍或下调至原1/2作为阈值范围,并以实时定量PCR验证miRNA芯片结果的可靠性。CCK-8法测定细胞增殖活性。结果:在结节性硬化症细胞株TSC2-/- MEFs中,上调≥原2倍差异表达的miRNA分子有14个,下调≤原1/2差异表达的miRNA分子有26个。miRNA-199a-5p在TSC2-/- MEFs显著低表达,过表达miRNA-199a-5p可显著抑制TSC2-/- MEFs细胞增殖。结论:结节性硬化症细胞株TSC2-/- MEFs和正常细胞株TSC2+/+ MEFs存在差异表达miRNA分子。miRNA-199a-5p参与结节性硬化症的发生、发展,可能是防治结节性硬化症的重要分子靶点。
Objective:Tuberous sclerosis complex (TSC) is a multisystem genetic disorder caused by mutations in the TSC1 and TSC2 genes, but the molecular events contributing to TSC are not well understood. However, little is known about the role of microRNAs in TSC. To explore the microRNA differential expression profile between tuberous sclerosis complex cell line TSC2-/- MEFs and normal type cell line TSC2+/+ MEFs, and to provide new clues to study the mechanism of microRNA function in tuberous sclerosis complex.Methods:TSC2-/- MEFs and TSC2+/+ MEFs cell lines were cultured in vitro, each with three samples chosen as the experimental group and the control group respectively. Total RNA was isolated using TRizol and purified with RNeasy mini kit according to manufacturer’s instructions. RNA quality and quantity were measured by using nanodrop spectrophotometer and RNA integrity was determined by gel electrophoresis. Total RNAs were extracted by TRizol, followed by RNA quantification and quality control. MicroRNA profiles were analyzed by microarray and the threshold value used to screen up-regulated more than 2-fold change or down-regulated less than 0.5-fold change compared with controls. Real-time PCR was used to validate the reliability of microarray. Cell counting kit-8 (CCK-8) assay was performed to evaluate the proliferation.Results:Fourteen microRNAs, including miR-18a-5p, miR-376c-3p, miR-136-5p, miR-467c-5p, miR-467b-5p, miR-5104, miR-3098-3p, miR-30a-3p, miR-302b-3p, miR-18a-3p, miR-19b-1-5p, miR-19a-5p, miR-20a-5p, miR-155-5p, were up-regulated, while twenty-six microRNAs, including miR-200b-3p, miR-450a-1-3p, miR-542-5p, miR-199b-5p, miR-10a-5p, miR-466c-5p, miR-450a-5p, miR-450b-5p, miR-542-3p, miR-351-5p, miR-322-3p, miR-199a-3p, miR-335-5p, miR-10b-5p, miR-351-3p, miR-155-3p, miR-497a-5p, miR-503-5p, miR-148a-3p, miR-1843a-5p, miR-199a-5p, miR-490-5p, miR-450a-2-3p, miR-322-5p, miR-214-3p, miR-450b-3p, were down-regulated in tuberous sclerosis complex cell line TSC2-/- MEFs compared with normal type cell line TSC2+/+ MEFs ( P<0.05). Real-time PCR confirmed the expressions of miR-136-5p, miR-30a-3p, miR-302b-3p, miR-10b-5p, miR-148a-3p, miR-199a-5p consistent with the microarray data ( P<0.05). Furthermore, the overexpression of miR-199a-5p significantly inhibited cell proli-feration ( P<0.05).Conclusion:There are differences in the expression of miRNA between the tube-rous sclerosis complex cell line TSC2-/- MEFs and normal cell line TSC2+/+ MEFs. MiRNA-199a-5p plays an important role in tuberous sclerosis complex, which may be developed as an important molecular target for the treatment of tuberous sclerosis complex.
结节性硬化症(tuberous sclerosis complex, TSC)是一种罕见的多个器官、系统受累及常染色体显性遗传疾病, 累及肾可表现为肾血管平滑肌脂肪瘤、多发肾囊肿和肾细胞癌[1]。肾血管平滑肌脂肪瘤可见于70%~90%的TSC患者, 是导致成年TSC患者死亡的首要原因[1, 2]。TSC的致病基因为TSC1和TSC2基因, 分别定位于染色体9q34和16p13.3, 各自编码相对分子质量约为130× 103的错构瘤蛋白和相对分子质量约为200× 103的马铃薯蛋白[3, 4]。TSC2基因突变更为常见, 约占 80%~90%, TSC1或TSC2基因突变可激活其下游哺乳动物雷帕霉素靶蛋白信号通路(mammalian target of rapamycin, mTOR)[1]。mTOR抑制剂西罗莫司和依维莫司先后进入临床试验, 但最新的临床试验结果显示, mTOR抑制剂治疗TSC的效果有一定局限性, 并存在耐药及不能停药的问题, 还可能导致部分患者出现胃肠道及呼吸系统的严重不良反应[5]。
微小RNA(microRNA, miRNA)是一类长约为23 nt的非编码单链小分子RNA, 它们可以在转录后水平对目标基因的表达进行调控, 参与细胞的多项生命活动调控及疾病的发生、进展[6]。miRNA在TSC疾病发生、发展过程中的机制仍不清楚, 对miRNA认识的深入为TSC研究提供了新的思路。本研究拟应用miRNA芯片技术, 建立TSC2-/- MEFs结节性硬化症细胞株和TSC2+/+ MEFs正常细胞株miRNA的差异表达谱, 探讨miRNA在TSC发生、发展中的作用机制, 分析其潜在临床价值。
结节性硬化症细胞株TSC2-/- MEFs和正常小鼠胚胎成纤维细胞TSC2+/+ MEFs由北京协和医学院基础医学研究所张宏冰教授馈赠, 由北京协和医院中心实验室保管。DMEM培养基、胎牛血清购自美国Hyclone公司, 青链霉素购自华北制药股份有限公司, EDTA购自天津市化学试剂一厂, 胰蛋白酶、二甲基亚砜、琼脂糖和DTT购自美国Sigma公司, TRizol试剂、Lipofectamin RNAi MAX转染试剂购自美国Invitrogen公司, miR-199a-5p双链类似物及其阴性对照、Hairpin-itTM miRNAs定量聚合酶链反应试剂盒均购自上海吉玛公司, 细胞计数试剂盒(CCK-8)购自日本同仁化工公司, miRCURYTM Array Power Labeling kit、miRCURYTM LNA Array (v.18.0)和Wash buffer kit购自丹麦Exiqon公司, 生物芯片扫描仪GenePix 4000B为美国Axon公司产品。
TSC2-/- MEFs和TSC2+/+ MEFs培养于10%(体积分数)胎牛血清的DMEM培养基, 加入100万单位的青链霉素混合液, 在37 ℃、5%(体积分数)CO2条件下培养, 实验用细胞均处于对数生长期。MiR-199a-5p mimics和对照(negative control, NC)以50 nmol/L终浓度按Lipofectamin RNAi MAX转染试剂说明书进行操作。
选取TSC2-/- MEFs和TSC2+/+ MEFs细胞系各3个样本, 分别标记为TSC2-/- 1、TSC2-/- 2、TSC2-/- 3和TSC2+/+ 1、TSC2+/+ 2、TSC2+/+ 3, 进行miRNA芯片筛选及后续验证实验。使用TRizol法提取细胞总RNA, 并用RNasey Mini Kit (QIAGEN)纯化。使用NanoDrop ND-1000测量纯化后的RNA浓度, 用变性琼脂糖凝胶电泳检测RNA的纯度及完整性。
RNA标记和杂交根据Exiqon提供的方法进行, 首先, 抽提的RNA通过质检后, 使用miRCURYTM Array Power Labeling kit对miRNA进行标记, 标记完成后, 将样品与miRCURYTM LNA Array (v.18.0)芯片杂交, 根据Exiqon的实验方法进行, 然后使用Axon GenePix 4000B芯片扫描仪扫描芯片, 应用GenePix Pro 6.0读取芯片扫描图像, 并提取探针的信号值, 相同的探针取中值合并, 保留在所有样品中均≥ 30.0的探针, 对全部芯片进行中值标准化, 筛选差异表达探针, 使用倍数变化和P值筛选两组样品间的差异表达miRNA, 最后对差异表达miRNAs进行聚类并绘制聚类图。
TRizol法提取细胞总RNA后, 用Hairpin-itTM miRNAs定量PCR试剂盒进行检测, 此试剂盒包含了目标miRNAs及内参U6的特异性引物, 在ABI7500 Fast上完成, 结束后以Step One软件分析反应曲线, 结果分析采用2-Δ Δ CT方法计算表达倍数。
以5 000个/孔将不同处理组的细胞接种于96孔培养板, 每组设5孔, 另设对照组调零, 72 h行CCK-8检测, 各孔加入10 μ L CCK-8, 避光培养3 h, 用全自动酶标仪于450 nm波长测定各孔光密度值(D)。
应用SPSS 17.0软件对数据进行统计分析, 计量资料以
应用NanoDrop ND-1000型微量紫外分光光度计对样本总RNA进行质量检测, 6个样本
 | 图1 TSC2+/+ MEFs和TSC2-/- MEFs 细胞株组间和组内microRNAs表达散点图Figure 1 Scatter plot of microRNAs expression between TSC2+/+ MEFs and TSC2-/- MEFs cell strain |
应用GenePix 4000B对杂交后的芯片进行图像扫描, 与正常小鼠胚胎成纤维细胞TSC2+/+ MEFs相比, 结节性硬化症细胞株TSC2-/- MEFs中上调≥ 原2倍差异表达的miRNA分子有14个, 下调≤ 原1/2差异表达的miRNA分子有26个。对筛选出的差异表达miRNA进行聚类, 通过t检验对差异表达miRNA绘制分层聚类图(图2)。
选取3个在TSC2-/- MEFs 细胞株中差异表达上调的miRNA(分别为miR-136-5p、miR-30a-3p和miR-302b-3p)和3个在TSC2-/- MEFs 细胞株中差异表达下调的miRNA(分别为miR-10b-5p、miR-148a-3p和miR-199a-5p), 应用实时定量PCR检测, 与miRNA芯片结果比较见表1, 实时定量PCR的检测结果与miRNA芯片结果具有良好的一致性, 验证了miRNA芯片的可靠性。
| 表1 实时定量PCR检测差异表达的microRNAs Table 1 Real-time PCR detected the differentially expressed microRNAs |
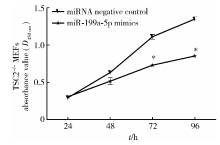
为进一步明确miR-199a-5p在结节性硬化症中的作用, 在结节性硬化症细胞株TSC2-/- MEFs中转染miR-199a-5p mimics和对照miRNA NC, 应用CCK-8法检测细胞增殖, 72 h和96 h后, 转染miR-199a-5p mimics组的
本研究通过miRNA芯片筛选结节性硬化症细胞株TSC2-/- MEFs差异表达miRNA, 建立了TSC2-/- MEFs和TSC2+/+ MEFs miRNA的差异表达谱, 进一步应用实时定量PCR验证了miRNA芯片的可靠性, 在TSC2-/- MEFs中初步探讨了miR-199a-5p对细胞增殖的影响, 为进一步深入研究miRNA在结节性硬化症中的发病机制奠定了基础。
20世纪90年代前后, 有研究分别发现了位于染色体9q34.3和16p13.3的两个结节性硬化症的致病基因, 被命名为TSC1和TSC2基因, 根据基因突变将结节性硬化症分为TSC1型与TSC2型, 其中TSC2基因突变更为常见, 约占70%, 而且TSC2型患者的临床表型相对更加严重[3, 4]。TSC1和TSC2基因分别编码错构瘤蛋白和马铃薯蛋白, 两者组成TSC1/TSC2蛋白复合物, 抑制其下游mTOR蛋白的活性, 这是临床应用mTOR抑制剂治疗结节性硬化症的理论依据。最新的临床试验结果显示, mTOR抑制剂治疗TSC的效果有一定局限性, 存在部分耐药及不能停药的问题, 还可能导致部分患者出现胃肠道及呼吸系统的严重不良反应, 临床亟需新的分子靶点和深入研究TSC1或TSC2基因突变后下游分子及信号转导的变化情况。TSC2缺失的小鼠胚胎成纤维细胞作为一种理想的细胞模型, 已被广泛用于结节性硬化症及mTOR信号通路异常相关疾病的研究[7]。
miRNA是一类长约为23 nt的非编码单链小分子RNA, 主要通过碱基互补与mRNA结合, 在转录后水平对目标基因的表达进行调控, miRNA的突变、缺失或表达异常会导致疾病的发生[6]。van Scheppingen等[8]的研究发现, 在结节性硬化症相关皮质结节中, miR-21、miR-146a和miR-155显著高表达, 炎症因子白细胞介素(interleukin IL)-1β 可上调细胞内miR-21、miR-146a和miR-155, 在结节性硬化症相关皮质结节中发挥重要作用。Dombkowski等[9]的研究发现, 在结节性硬化症相关癫痫病灶中, miR-23a、miR-34a、miR-34b和miR-532-5p显著高表达, 进一步研究发现, miR-23a和miR-34a可靶向结合TSC1基因的3'-UTR端, 可能是治疗结节性硬化症相关癫痫的重要分子靶点。Trindade等[10]发现miRNA-21在mTOR抑制剂雷帕霉素治疗结节性硬化症的细胞株中发挥转录后调控作用。miR-199a-5p是常见的也是最保守的miRNA之一, 在体内参与多种生物学功能, 如血管生成、侵袭转移和细胞自噬等[11, 12]。miR-199a-5p在肾细胞癌、乳腺癌、前列腺癌等恶性肿瘤组织中显著低表达, 发挥抑癌miRNA的作用, 且与恶性肿瘤临床预后密切相关[11, 12, 13]。本研究应用miRNA芯片筛选结节性硬化症细胞株TSC2-/- MEFs差异表达miRNA, 进一步通过实时定量PCR检测证实miR-199a-5p在TSC2-/- MEFs中的表达显著下调, 进一步通过在TSC2-/- MEFs细胞中过表达miR-199a-5p, 发现其可显著抑制TSC2-/- MEFs细胞的增殖。Trelinska等[14]的研究发现, 结节性硬化症患者血清miR-199a-5p的表达水平要显著低于健康人群, 因此推测miR-199a-5p在结节性硬化症的发生、发展中扮演着抑癌miRNA的重要角色。应用miRNA靶标预测软件TargetScan、miRanda和miRDB分析发现, miR-199a-5p下游存在多个与细胞增殖及肿瘤血管生成相关的靶基因, 如丝裂原活化蛋白激酶激酶11(mitogen-activated protein kinase kinase kinase 11, MAP3K11)、Wnt家族成员2(Wnt family member 2, WNT2)及血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)等, 提示其可能通过调控下游靶基因的表达调控结节性硬化症细胞的增殖。
尽管本研究结果显示了一定的临床应用前景, 但仍存在许多不足之处, 首先, 本研究是在小鼠结节性硬化症细胞模型上展开的研究, 考虑种属之间的差异, 仍需进一步在结节性硬化症的临床标本上进一步验证, 考虑miRNA的种属之间的高度保守性, 因此本研究结果应该具有一定潜在的临床价值; 其次, 本研究初步探讨了miR-199a-5p对结节性硬化症细胞株TSC2-/- MEFs生物学功能的调控作用, 但其下游具体通过哪一个或那些靶点基因调控尚待进一步深入研究。
综上所述, 本研究建立了TSC2-/- MEFs结节性硬化症细胞株和TSC2+/+ MEFs正常细胞株miRNA的差异表达谱, 发现miR-199a-5p可抑制TSC2-/- MEFs的细胞增殖, 下一步将深入研究miR-199a-5p通过调控下游靶点参与结节性硬化症发生、发展的机制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|