目的:构建并改进前列腺癌(prostate cancer,PCa)体内股骨及脊柱转移动物模型,为不同部位的PCa骨转移的诊治及骨应力改变的研究提供工具。方法:将不同浓度的PCa细胞(RM-1)注射到小鼠(C57BL/6)股骨骨髓腔和腰椎内,观察记录小鼠活动变化、成瘤情况,测定瘤体大小及记录存活时间。取模型的双侧股骨组织,进行影像学检查后测算灰度值(骨密度), 并行组织病理学检查,确定建模情况及成瘤类型。结果:各细胞浓度梯度小鼠均成瘤,各股骨转移模型的肿瘤发生时间、生长速度同组间无差别( P>0.05),病理学检测结果证实所有股骨骨髓腔和腰椎内PCa骨转移模型构建成功,且较低RM-1细胞浓度构建的PCa骨转移动物模型生存时间较前期构建的动物模型明显延长(约1倍,至少2周)。结论:成功用同一PCa细胞株构建了不同部位(四肢骨和中轴骨)的PCa骨转移体内动物模型,经股骨骨髓腔穿刺注射肿瘤细胞建立PCa骨转移动物模型成瘤率高,肿瘤生长迅速,且可稳定复制,为进一步PCa骨转移的骨应力改变及防治的研究提供平台。
Objective:To provide an important tool for the study of diagnose and treatment of prostate cancer (PCa) osseous metastasis and change of bone stress force on prostate cancer (PCa) osseous metastasis and a platform, which is more congruous to clinical process, for prevention and cure of neoplastic bone metastases, and to carry out the construction and improvement of animal models of PCa with different positional osseous metastasis in vivo.Methods:Different gradient concentrations of RM-1 cells were inoculated into the cavity of left femoral bone or lumbar vertebra of mice (C57BL/6) respectively. The change of mouse activity, tumor formation, tumor size and survival time were observed respectively. And the femur tissue and spinal tissue were obtained from the mice after death. The gray value of iconography were measured by imageological examination of femur tissue, and the final histopathological examination were taken to determine the tumor type in both femur and spinal tissue.Results:The tumor growth could be touched at the puncture site in all the mice after inoculated for 7 days. There were no obvious differences in the time of tumorigenesis, the rate of tumor growth and tumor size among the mice in the same group ( P>0.05). As the result, the construction femoral bone and lumbar vertebra metastatic models of PCa had been confirmed by iconography and pathology detection. At the same time, the survival time of the mice inoculated with low concentrations of PCa cells was obviously longer than that of high concentrations of PCa cells ( at least 2 weeks longer).Conclusion:The animal models with different positional osseous metastasis (limbs and axial skeleton) of PCa using the same PCa cells (RM-1) had been first constructed successfully in our study. At the same time, a high success rate of construction of PCa animal model with bone metastasis was obtained by femoral bone marrow cavity injection of PCa cells. The rate of tumor growth was rapid, animal survival time was appropriate, and the PCa animal model with bone metastasis can be stably reproduced by our method. These animal models can be used to explore the pathogenesis of different positional PCa bone metastasis and provide a new platform, which were more congruous to clinical process, for prevention and cure of neoplastic bone metastases.
前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统最常见的恶性肿瘤之一[1, 2], 也是欧美国家男性常见的恶性肿瘤, 位居美国男性恶性肿瘤发病率榜首[3]。根据世界卫生组织GLOBOCAN 2008数据(全球流行病统计数据)显示, 至2008年, PCa发病率仅次于肺癌, 在全球男性恶性肿瘤中位居第二, 其发病例数占所有癌症的14%[4] , 近年我国男性PCa发病率也呈持续快速增长的趋势。PCa患者就诊时常已伴有转移, 骨是最常见的转移部位[5], 约80%的PCa患者和几乎所有的进展期PCa患者都会出现骨转移[6, 7], 这明显增加了PCa的致残、病死率, 已成为当今PCa治疗上最为棘手的问题[8, 9]。动物模型是研究肿瘤发病机制、进展和探讨治疗方案的重要工具, 建立简便且实用的动物模型在肿瘤疾病的研究中具有重要意义。前期研究中[10, 11], 本课题组利用小鼠PCa细胞株RM-1直接穿刺注射入C57BL/6小鼠股骨骨髓腔构建了PCa四肢骨转移的动物模型, 具有成瘤周期短、操作简单、重复性好、成功率高以及便于及时观察等优点。本实验结合前期工作的建模经验, 利用小鼠PCa细胞株RM-1直接穿刺注射入C57BL/6小鼠股骨骨髓腔和小鼠腰椎, 用同一种PCa细胞株构建不同部位(四肢骨和中轴骨)的PCa骨转移体内动物模型, 以期为进一步进行不同骨密度的PCa转移骨的骨应力改变的研究提供工具, 也为PCa骨转移的防治研究提供更符合临床进程的平台。
实验所使用动物为C57BL/6小黑鼠, 近交系小鼠, 6周龄, 体重约16~22 g, 平均(20.0± 0.8) g, 购自北京华阜康生物科技股份有限公司, 经过中国医学科学院医学实验动物研究所质量检测, 小鼠等级为SPF级, 生产许可证号:SCXX(京)2014- 0004, 饲养于云南省第一人民医院实验动物房, 全部为雌性, 避免雄激素的干扰, 更符合非雄激素依赖性PCa生物学特性。
RM-1细胞为本课题组保存, 中山大学泌尿外科惠赠, 用体积配比为RPMI-1640培养基(GIBCOBRL公司)90%+胎牛血清(fetal bovine serum, FBS)10%再加入双抗(penicillin-streptomycin solution)1%的完全培养基进行培养。
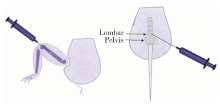
依据前期研究实验方法[10, 11], 取64只小鼠随机分为4组进行前列腺癌股骨转移模型构建, 分别为GA、GB、GC、GD 4组, 每组16只。另取16只小鼠, 构建前列腺癌脊柱转移模型, 分别记为JC、JD两组, 每组8只。使用1%(质量分数)戊巴比妥钠按60 mg/kg进行腹腔注射麻醉。将呈对数生长的RM-1细胞制成细胞悬液稀释为以下4个浓度组:高浓度组为25× 105/mL, 中浓度组为10× 105/mL, 低浓度组为3× 105/mL, 极低浓度组为1× 105/mL。用1 mL注射器从膝关节股骨下端, 沿股骨长轴方向旋转进针, 分别接种20 μ L至GA、GB、GC、GD 4组小鼠的左后肢(a), 右后肢(b)穿刺注入同等体积的RPMI 1640培养基作为自身对照; JC、JD组穿刺第5腰椎分别接种低浓度和极低浓度细胞悬液20 μ L(图1)。
RM-1细胞接种至小鼠股骨后, 每日观察小鼠的活动情况、肿瘤生长情况、小鼠活动能力、精神状态、毛色、摄食情况等的变化, 称量体重, 待肿瘤生长后测量肿瘤大小, 绘制肿瘤生长曲线, 直至小鼠死亡或被处死为止。
死亡小鼠解剖后观察腹腔脏器, 心、肺有无明显转移, 如有转移, 应取材保存并记录。取双侧股骨组织, 观察并记录接种部位肿瘤大小, 周围侵犯情况。取材股骨组织后将其置于2 mL EP管中, 加适量10%(体积分数)多聚甲醛溶液浸泡固定; 未死亡小鼠待肿瘤生长4周后处死并完整取出双侧股骨固定。所得股骨标本进行影像学检测及组织病理学检测。脊柱组将脊柱及双侧股骨均取出, 以适量10%多聚甲醛溶液浸泡固定, 并进行标记、组织病理学检测。
采用SPSS20.0软件, 计量资料以均数± 标准差表示, 两组间比较采用t检验, 多组间比较采用单因素方差分析, 多组间两两比较用LSD-t检验。
2.1.1 接种RM-1细胞至股骨 1周后小鼠接种肢侧膝关节处陆续出现皮下包块, 10 d内全部出现, 同组各小鼠皮下包块生长速度一致, 接种14~20 d内小鼠出现不同程度的反应稍迟钝, 食欲减退, 体重减轻, 活动减少, 跛行等一系列表现, 3周后小鼠开始形体消瘦。对侧后肢均未见皮下包块, 所有小鼠均未出现穿刺部位感染的情况(表1~5)。
| 表1 不同RM-1细胞浓度骨转移成瘤情况 Table 1 Bone metastasis in different concentrations of RM-1 cell |
| 表2 不同浓度细胞成瘤类型 Table 2 Types of bone metastasis with different concentrations of tumor cells |
| 表3 骨转移模型各组接种RM-1细胞后精神状态比较 ( |
| 表4 骨转移模型各组接种RM-1细胞后活动情况比较 ( |
| 表5 骨转移模型各组最终成瘤大小比较 (n=16, |
2.1.2 脊柱组接种RM-1 4~5 d出现小鼠双下肢活动受影响而跛行, 7 d可见腰部皮下包块生长, 且生长迅速, 小鼠逐渐出现食欲减退, 体重减轻, 活动减少, 反应迟缓, 10 d后出现弓背, 16 d开始出现小鼠死亡, 至28 d全部死亡。解剖见13只腰椎有肿瘤浸润, 3只为腰椎旁肿块, 双下肢均未见肿瘤生长, 亦未见腹腔脏器及心肺发生明显肿瘤转移。
2.1.3 肿瘤测量参数 待肿瘤生长至肉眼明显可见后开始测量, 每3天测量1次, 测量肿瘤的最长径(a)和横径(b), 并记录结果。长径 ≥ 2 mm判定为成瘤, 肿瘤体积平均大小按公式计算:V(mm3)=a· b2/2, 以生长时间为横坐标, 以肿瘤大小为纵坐标即可绘制肿瘤生长曲线(图2)。
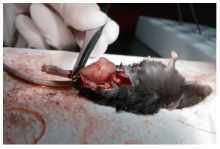
自接种RM-1细胞后开始计算, 接种后第7天左右在小鼠穿刺部位即可触及皮下小结节。随后瘤体逐渐增大, 2周后可见肿瘤明显隆起, 3周后呈团块状影响宿主活动甚至瘫痪。解剖荷瘤小鼠, 肉眼大体观察肿瘤细胞的转移情况, 未发现肝、肾、肺及淋巴结转移。切开皮肤暴露肿瘤, 肿瘤外观呈不规则团块状, 肿瘤无包膜, 表面有血管分布, 与周围正常组织紧密相连并包绕股骨组织(图3、4)。肿瘤切面呈鱼肉样。
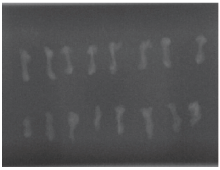
将各组小鼠双侧股骨进行X射线检查(图5)后, 用Photoshop软件测算其灰度值, 可知接种肿瘤细胞一侧股骨总体灰度较对照侧低, 差异有统计学意义(P< 0.05, 表6)。
| 表6 各组双侧股骨X射线灰度值比较 (n=16, |
大体病理:大体解剖发现股骨组接种PCa肿瘤细胞侧股骨以及脊柱组的腰椎有肿瘤生长, 肿瘤呈灰白色团块状隆起于腰椎表面。
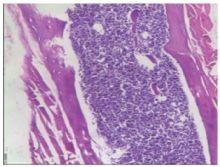
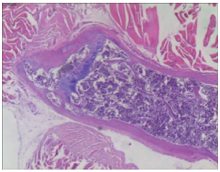
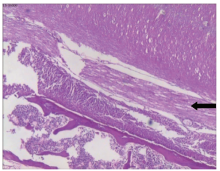
显微镜下观察(图6~11):接种肿瘤细胞一侧股骨骨髓腔内和骨皮质外均可见大量分化程度低的上皮细胞, 成群密集分布, 片状排列, 排列紊乱, 异形性明显, 胞浆红染, 核大深染, 大小不一, 部分可见核仁, 核内染色质多形、数目不均(图6、8)。绝大部分为成骨性改变, 骨皮质可见明显破坏、缺损, 骨髓腔内骨皮质边缘可见大量肿瘤性成骨, 骨髓腔可见骨髓与肿瘤细胞混杂, 部分可见坏死、死骨等改变, 而对照一侧股骨未见明显骨质破坏(图7、9)。脊柱转移瘤标本切片中, 肿瘤细胞亦侵犯周围肌肉组织, 在骨膜和周围肌纤维形成肿瘤性成骨(图10、11), 证实脊柱转移模型构建成功。
 | 图6 股骨内外均密集分布肿瘤细胞(HE × 40), 箭头所示为前列腺癌Figure 6 The tumor cells are densely distributed both inside and outside the femur (HE × 40), the arrow shows prostate cancer |
 | 图10 脊柱模型肌纤维内肿瘤性成骨, 箭头所示(HE × 40)Figure 10 Neoplastic osteogenesis in muscle fibers of spinal models, as the arrow showing (HE × 40) |
肿瘤的发生、发展受多种因素的调控, 过程机制繁杂, 研究该类机制及疾病防治必须依靠相应的动物模型, 理想的动物模型应能模拟疾病发生的病理生理过程, 具有较高可重复性, 疾病的发生、发展迅速而规律, 并便于观测研究[12], 啮齿类动物模型属于较理想的选择。目前常用的肿瘤转移动物模型包括自发肿瘤模型、同系移植自发肿瘤模型、化学诱导肿瘤模型以及转基因模型等。啮齿类极少能有自发的骨转移模型, 而相对于人类而言啮齿类前列腺癌自发病率就更低[13, 14], 而多数同系基因型的模型PCa也不易转移到骨骼。既往报道中[15], 在转基因动物模型和化学诱导模型中偶有PCa转移到淋巴结和肺部, 但极少转移至骨骼。就常用的经心内注射模型而言, 其缺点是注射后不能确定是否发生骨转移, 部分实验鼠早期出现截瘫或在骨转移尚不明显时死于其他转移灶的全身播散[16, 17]。目前肿瘤动物模型实验研究中较常用的是移植型肿瘤模型, 通常利用免疫缺陷动物, 将已稳定培养且生长旺盛的肿瘤细胞株移植于其体内, 制作简便, 肿瘤生长较一致, 能够保留肿瘤原有的生物学特性, 对宿主影响亦较为一致, 耗时短, 可控性强, 建模成功率高。骨内注射已被用于构建成骨性或成骨/破骨性骨转移模型[18], 如能利用同一PCa细胞株构建不同类型的动物模型无疑是研究同一种肿瘤的最佳选择, 可充分保证研究的客观性、科学性, 但目前除本课题组的前期报道外[10, 11], 罕见利用同一PCa细胞株同时构建成骨性和破骨性骨转移模型的报道。
本实验通过将呈对数生长的PCa细胞(RM-1)按照4种不同浓度, 直接穿刺注射的方式接种到4组C57BL/6小鼠的股骨骨髓腔和腰椎, 成功地建立了PCa的股骨转移模型, 4个不同接种浓度组均成瘤, 成瘤率为100%; 而脊柱组模型亦取得了较大的成功, JC、JD两组共16只小鼠, 有14只病理证实发生脊柱转移, 建模成功率达87.5%, 同既往报道一致, 且因属于鼠源性肿瘤细胞, 无需使用裸鼠或免疫缺陷鼠, 购买和饲养的费用更低廉, 条件更简易, 易于复制和推广[19]。在建模操作方面, 脊柱转移模型与股骨转移模型有所不同, 主要表现在构建过程的难度上。相对来说, 小鼠腰椎穿刺则难度较大, 不易掌握, 这也是建立PCa脊柱转移模型较为困难的原因之一。而深入了解小鼠的脊柱解剖结构, 熟悉小鼠腰椎位置, 多进行腰椎穿刺练习, 提高穿刺技巧有助于解决这一难题。此外, 如条件允许, 可利用X线等影像学方法进行辅助定位, 但操作者必然面临放射线暴露, 仍有待改进。
本研究所选肿瘤细胞接种浓度(1× 105/mL~25× 105/mL)都可成功建模, 不同肿瘤细胞浓度在模型建立过程中对小鼠肿瘤生长、出现跛行的时间以及发生下肢瘫痪的时间的影响差异无统计学意义; 不同接种浓度对小鼠出现食欲下降、消瘦和精神萎靡的时间的影响差异也无统计学意义; 不同接种浓度对小鼠肿瘤生长速度及肿瘤的大小的影响差异无统计学意义, 即本实验中记录的各组PCa骨转移小鼠模型稳定, 可重复性高。病理HE染色切片在显微镜下观察后证实, 绝大部分标本为成骨性改变, 部分标本发现有死骨、坏死改变, 认为是混合性成瘤。不论接种何种浓度的细胞, 肿瘤生长速度都很快, 对小鼠股骨破坏严重, 穿透骨膜向外侵犯周围肌肉组织, 侵犯股骨头, 刺激骨膜出现成骨反应, 而脊柱组肿瘤侵犯外周肌肉, 形成肌纤维内成骨, 可用于研究前列腺肿瘤细胞与微环境的相互作用[19]。在前期研究的基础上, 本研究用同一种PCa细胞株构建了不同部位(四肢骨和中轴骨)的PCa骨转移体内动物模型, PCa是源自前列腺上皮的恶性肿瘤, 本实验制作的PCa骨转移标本用X线检测后运用Photoshop软件进行灰度检测、转化计算, 可知接种肿瘤细胞一侧股骨总体灰度较对照侧低(P< 0.05), 说明本实验所得PCa股骨转移模型绝大部分为成骨性转移, 只有少部分灰度值较对照侧稍高, 为混合溶骨性改变, 与既往研究相符。经标本切片显微镜下观察, 可见接种PCa细胞一侧股骨骨髓腔内和骨皮质外均可见大量分化程度低的上皮细胞, 排列紊乱, 异形性明显, 核大深染, 大小不一, 部分可见核仁, 核内染色质多形、数目不均。病理分型绝大部分为成骨性改变, 但骨皮质可见明显破坏、缺损, 骨髓腔内骨皮质边缘可见大量肿瘤性成骨, 骨髓与肿瘤细胞混杂, 部分可见到死骨、坏死等改变; 而对照一侧股骨未见明显骨质破坏。椎体转移瘤标本切片中, 肿瘤细胞亦侵犯周围肌肉组织, 在骨膜和周围肌纤维形成肿瘤性成骨, 病理结果证实了影像学检测结果。
本实验直接将小鼠PCa细胞RM-1注射入C57BL/6小鼠股骨骨髓腔内, 成功构建了PCa骨转移的动物模型, 通过X射线检查后测算灰度值和病理切片检查皆证明肿瘤细胞在骨组织内生长并对骨质造成明显破坏, 模拟了PCa细胞在骨组织中的生长过程及此过程中肿瘤对骨组织的侵蚀和破坏, 建立了成骨性及破骨性骨转移模型, 为更深入地研究PCa骨转移提供了更符合临床进程的研究模型。此外, 将本研究动物生存时间结果对比前期研究报道可以看出[10, 11], 降低骨髓腔穿刺注射的肿瘤细胞数量(极低浓度组, 1× 105/mL细胞)所建立的PCa骨转移动物模型生存时间较前期构建的动物模型明显延长(1倍, 至少4周), 按6周龄鼠与人类老化比(约1 ∶ 25)计算, 动物带瘤生存期相当于人类2.1年, 更符合人类PCa的临床进程, 在PCa骨转移的研究应用范围也得以明显扩大。
综上所述, 本研究用同一种PCa细胞株构建了不同部位(四肢骨和中轴骨)的PCa骨转移体内动物模型, 模型大部分为成骨性转移, 少部分为混合溶骨性改变。研究证实, 经股骨骨髓腔穿刺注射肿瘤细胞建立PCa骨转移动物模型成瘤率高, 肿瘤生长迅速, 动物模型生存时间较前期构建的动物模型明显延长, 该骨转移动物模型可稳定复制, 可进一步用于探索PCa不同部位、不同转移性质骨转移的发病机制, 更为PCa骨转移的防治, 尤其病理性骨折的防治, 提供一个更符合临床进程的平台。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|