目的:探讨后腹腔镜联合经腰小切口“杂交”手术在复杂肾肿瘤保留肾单位手术中的临床疗效和安全性。方法:回顾性分析2015年4月至2016年12月在北京大学人民医院泌尿外科进行“杂交”保留肾单位手术的复杂肾肿瘤患者的临床资料, 其中男性10例,女性6例,年龄(50.2±10.7)岁,肿瘤位于左侧9例,右侧7例,肿瘤直径(6.1±1.0) cm, R.E.N.A.L.评分平均(9.3±1.3)分。患者均采用后腹腔镜联合经腰小切口的“杂交”手术方式进行保留肾单位手术,即在后腹腔镜下完全游离肾和肾蒂血管,预置肾动脉,然后取12肋下长约10~12 cm的切口进行开放手术,阻断肾动脉,直视下切除肿瘤、缝合创面。记录手术时间、肾缺血时间、术中出血量、术后并发症等围手术期资料以及术后肾功能随访情况。结果:16例均全部成功完成手术。手术时间 (164.9±23.6) min,肾缺血时间(32.4±6.2) min,术中出血量(204.0±125.1) mL,引流管拔除时间(4.1±1.0) d,术后平均住院时间(6.9±1.5) d。术后发生Clavien Ⅲ级以上并发症2例:1例集合系统损伤;1例患者因术后出血,再次急诊手术探查止血。术后第1天平均血肌酐水平为(126.3±26.4) μmol/L ,与术前(74.3±16.9) μmol/L比较, 差异有统计学意义( P<0.05)。术后1个月平均血肌酐水平为(92.6±18.2) μmol/L、术后3个月平均血肌酐水平为(80.8±18.4) μmol/L,与术前比较差异无统计学意义( P>0.05)。随访3~20个月,均未见肿瘤复发和转移。结论:后腹腔镜联合经腰小切口“杂交”保留肾单位手术能够降低手术难度,提高手术安全性,适用于部分经过选择的复杂肾肿瘤患者,有一定的临床推广价值。
Objective:To evaluate the clinical effect and safety of retroperitoneal laparoscopic surgery combined with mini-flank incision “hybrid surgery” for partial nephrectomy of complex renal tumors.Methods:Between April 2015 and December 2016, the clinical data from 16 patients with complex renal tumors who underwent the “hybrid surgery”, including 10 males and 6 females, were retrospectively reviewed. The average age was (50.2±10.7) years, 9 cases were located in the left side and 7 cases in the right side, the mean tumor size was (6.1±1.0) cm, and the mean R.E.N.A.L. nephrometry score was 9.3±1.3. All the patients received the “hybrid surgery”, the first step was to adequately mobilize the kidney and tumor, prepared the renal artery by retroperitoneal laparoscopy, and then the incision about 10-12 cm was done under the twelve rib to convert to open surgery. After the renal artery was clamped, the tumor was removed and the wound was closed under direct vision. The operative time, ischemia time, estimated blood loss, intraoperative and postoperative complications and short-term renal function were recorded.Results:All the 16 patients’ “hybrid surgeries” were successfully performed. The mean operative time was (164.9±23.6) min, mean ischemia time was (32.4±6.2) min, and mean estimated blood loss was (204.0±125.1) mL. The mean drainage tube removal time was (4.1±1.0) d, and the mean postoperatively hospital stay was (6.9±1.5) d. There were 2 patients with Clavien Ⅲ grade complications. One patient was injured with collecting system, and 1 patient received a second emergency surgery for acute postoperative bleeding. The mean 1 day postoperative serum creatinine level was (126.3±26.4) μmol/L, which was statistically significant ( P<0.05) compared with the preoperative serum creatinine level(74.3±16.9)μmol/L. There were no significant differences ( P>0.05) in comparing the 1 month postoperative serum creatinine level(92.6±18.2) μmol/L, 3 months postoperative serum creatinine level (80.8±18.4) μmol/L with the preoperative serum creatinine level. During 3 to 20 months follow-up periods, no local recurrence or distant metastasis occurred.Conclusion:This “hybrid surgery” combined retroperitoneal laparoscopic surgery with mini-flank incision for partial nephrectomy is safe and effective. It could decrease the operative difficulty and be worthy of further application for some selected complex renal tumor patients.
本文回顾性分析北京大学人民医院泌尿外科采用后腹腔镜联合经腰小切口的“ 杂交” 手术方式治疗16例复杂肾肿瘤的临床资料, 探讨该术式在复杂肾肿瘤的保留肾单位手术(nephron sparing surgery, NSS)中的应用价值。
2015年4月至2016年12月, 北京大学人民医院泌尿外科共完成271例肾肿瘤NSS手术。对于肿瘤较大(T1b及以上)、部位特殊(肾门部)或者肿瘤以囊性成分为主的患者, 考虑到完全腔镜下完成NSS手术有一定难度, 采用后腹腔镜联合经腰小切口的“ 杂交” 手术方式进行。本组共16例, 男性10例, 女性6例, 年龄(50.2± 10.7)岁, 肿瘤位于左侧9例, 右侧7例, 肿瘤直径(6.1± 1.0) cm, 平均R.E.N.A.L.评分(9.3± 1.3)分, 术前肌酐水平(74.3± 16.9) μ mol/L。患者术前均行泌尿系增强CT或磁共振检查。
所有患者均采用气管插管全身麻醉方式, 体位取健侧折刀位, 升高腰桥, 于12肋下与腰大肌夹角处切开皮肤约2 cm(考虑后续需联合开放手术, 切口沿12肋走行)。用血管钳钝性刺破腰背筋膜后分开, 确认进入腹膜后间隙后, 用手指钝性分离后腹膜间隙, 经此切口置入自制手套球囊, 连续充入500~800 mL空气扩张后腹膜腔隙, 然后在手指引导下分别于腋前线11肋尖及腋中线髂前上棘处建立穿刺通道。成功建立气腹后, 首先在腹腔镜下游离腹膜外脂肪, 打开肾周筋膜, 于腰大肌前方找到肾动脉, 打开肾动脉鞘, 完全游离肾动脉, 用自制橡皮条将肾动脉预置出来, 方便开放手术时寻找并阻断肾动脉。超声刀切开肾脂肪囊, 暴露肾肿瘤后继续沿肾表面充分游离肾上极、肾下极, 肾背侧、腹侧以及输尿管上段, 使肾仅剩肾蒂附着, 利于后续联合开放手术时移动和翻转肾。游离肾上极及肾内侧时, 注意防止损伤肾极支血管。关闭气腹, 将术者左右手穿刺通道(12肋下与11肋尖部穿刺通道)的连线切开, 切口长约10~12 cm, 用开胸器牵开切口, 移动或者翻转肾使肾肿瘤暴露于直视下位置, 牵起预置的橡皮条用动脉阻断夹将肾动脉阻断, 将冰屑覆盖于肾表面, 直视下离肿瘤边缘0.5 cm切除肿瘤及部分正常肾组织。完整切除肿瘤后, 瘤床基底采用5/8弧度、3-0倒刺线连续缝合一层, 切缘关闭采用1号倒刺线连续缝合后收紧缝线, 线尾夹闭Hem-o-lok。肾门部肿瘤在切除过程中如果损伤肾血管, 需用4-0 滑线缝合血管破损处, 创面关闭时如果张力较大, 可以采用环形缝合肾门部切缘。解除肾动脉阻断, 检查创面是否渗血, 必要时可用倒刺线加强缝合创面。术毕留置腹膜后引流管一根, 关闭切口。
所有患者均记录手术时间、术中出血量、肾缺血时间、术后引流量、引流管拔除时间、术后住院天数、并发症发生情况, 术后病理等。所有患者随访至2016年12月31日, 观察肾功能变化情况(术后第1天、术后1月和术后3月血肌酐水平)及肿瘤控制情况。
采用SPSS 19.0统计软件进行分析, 计量资料采用均数± 标准差表示。患者手术前和术后第1天、术后1月、术后3月的血肌酐水平比较, 采用组间方差分析(F检验), P< 0.05认为差异具有统计学意义。
16例后腹腔镜联合经腰小切口“ 杂交” 保留肾单位手术均获得成功, 平均手术时间(164.9± 23.6) min, 肾缺血时间(32.4± 6.2) min, 术中出血量(204.0± 125.1) mL。引流管拔除时间为(4.1± 1.0) d, 术后平均住院天数(6.9± 1.5) d。术后发生Clavien Ⅲ 级以上并发症2例:集合系统损伤1例, 术中采用4-0可吸收线修补, 手术结束时留置DJ管, 保留1个月后拔除, 患者未出现尿瘘; 1例患者术后3 h发生急性出血性休克, 再次急诊手术探查止血。其他并发症:输血3例, 发热2例, 伤口感染1例, 肝酶升高1例。本组病例无其他并发症发生。术后病理:肾透明细胞癌10例、乳头状肾癌1例、囊性肾瘤1例、肾囊肿1例、肾错构瘤2例、嗜酸细胞瘤1例。
术后第1天平均血肌酐水平(126.3± 26.4)μ mol/L, 术后1个月平均血肌酐水平(92.6± 18.2)μ mol/L, 术后3个月平均血肌酐水平(80.8± 18.4)μ mol/L。术后第1天血肌酐水平与术前(74.3± 16.9) μ mol/L比较差异有统计学意义(P< 0.05), 术后1个月、术后3个月平均血肌酐水平与术前相比差异无统计学意义(P> 0.05)。随访3~20个月, 未出现肿瘤复发或远处转移。
NSS已经被证实了在肾癌治疗中的作用和地位, 《中国泌尿外科疾病诊断治疗指南》推荐将NSS作为T1a 期肾肿瘤的一线治疗手段。对于临床分期T1b(肿瘤直径4~7 cm)的肾肿瘤行NSS术, 国内外文献报道仍然可以取得与肾根治性切除相当的肿瘤控制效果和较好的肾功能保护[1, 2], 但在一些复杂肾肿瘤患者中完全在腹腔镜下实施NSS手术存在巨大挑战。腹腔镜手术虽然能够实现精细解剖与良好的显露, 但对于肿瘤较大(T1b及以上)、部位特殊(肾门部)或者肿瘤以囊性成分为主时, 腹腔镜下无论切除还是缝合都存在相当的难度。相对腹腔镜手术而言, 传统开放手术虽然能够精准切除和确切缝合, 但一般需要较大切口来实施手术, 术中也很难在直视下游离肾蒂血管, 并且, 对于肾上极肿瘤需要经11肋间或者切断12肋进行手术, 手术创伤较大, 患者恢复时间较长。
有鉴于此, 我们采用后腹腔镜联合经腰小切口的“ 杂交” 手术方式来实施一些复杂肾肿瘤的NSS手术。该术式结合了腹腔镜解剖精细、创伤小和开放手术能精准切除和确切缝合的优点, 一方面能降低手术难度, 另一方面能使患者获得较快的术后康复。北京大学人民医院泌尿外科于2015年4月实施第一例“ 杂交” 手术以来, 现已成功完成16例复杂肾肿瘤的“ 杂交” NSS手术。本组病例临床分期均为T1b及以上, R.N.E.A.L评分≥ 9分, 术前影像学提示9例肿瘤临近肾门血管(图1、2), 5例肿瘤以囊性成分为主。本组所有患者均通过“ 杂交” NSS手术成功保留了患侧肾, 随访至2016年12月无一例患者出现肿瘤复发和转移, 术后肾功能恢复良好。
 | 图1 左肾上极6.5 cm囊实性肿物(R.E.N.A.L.评分10p), 紧邻肾动脉Figure 1 A 6.5 cm solid-cystic mass located on upper pole of left renal and closed to left renal artery (R.E.N.A.L. score 10p) |
 | 图2 左肾8.8 cm错构瘤(R.E.N.A.L.评分10x), 紧邻左肾静脉Figure 2 A 8.8 cm renal angiomyolipoma closed to left renal vein (R.E.N.A.L. score 10x) |
后腹腔镜游离肾动脉具有明显优势, 通过辨认膈肌的内侧弓状韧带等解剖标志, 能够在腰大肌前方对肾动脉进行快速定位和寻找。游离肾动脉后, 可将自制的橡皮条作为血管约束带套住肾动脉(图3), 方便开放时阻断肾动脉; 由于腹腔镜的放大作用以及各种能量设备的广泛使用, 使得腹腔镜下完全游离肾、充分显露肾肿瘤变得十分快捷; 开放手术时, 仅需将术者左右手穿刺通道的连线切开, 切口位于12肋下, 通常长10~12 cm。这种“ 杂交” 手术的切口较传统开放NSS手术的切口要小5~10 cm, 利于患者早期康复; 通过腹腔镜将肾完全游离后, 肾活动度明显增加, 即使在不离断12肋情况下, 也能很便利地显露肾上极肿瘤; 由于腹腔镜下已经将肾和肾动脉充分游离, 仅仅有肾蒂附着, 方便开放时将肾及肿瘤移动至切口外, 直视下切除肿瘤和缝合创面, 大大降低了手术难度; 同时, 腹腔镜手术转成开放手术后, 也能减少气腹对老年患者心肺功能的影响, 提高了手术安全性。
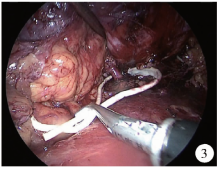 | 图3 用自制橡皮条套住肾动脉方便开放手术时阻断Figure 3 A handmade rubber string entangled into renal artery which was easy to be clamped during open surgery |
值得注意的是, NSS术后患肾功能的恢复受到诸多因素的影响, 例如术前肾功能、基础疾病、患者性别、年龄、肿瘤大小、残留肾组织以及热缺血时间等[3, 4], 其中最重要的因素就是残留肾组织及热缺血时间。开放手术时采用冰屑充分对肾表面进行降温, 一定程度上可改善热缺血及再灌注损伤[5]。Lane等[6]对660例行NSS的孤立肾肿瘤患者进行非随机对照研究发现, 虽然冷缺血组的缺血时间明显长于热缺血组[(45 vs. 22) min, P< 0.001], 但两组患者在术后3个月随访时, 平均肾小球滤过率降低程度差异并无统计学意义(21% vs. 22%, P=0.7)。本组16例“ 杂交” NSS手术患者, 转开放手术时全部对肾周围进行冰屑降温, 肾缺血时间平均为(32.4± 6.2) min, 虽然缺血时间大于30 min, 但通过冰屑降温可有效减少缺血造成的肾功能损害。在切除肿瘤过程中, 直视下操作可以明显缩短手术时间, 同时尽可能多地保留正常肾组织, 有利于创面的缝合以及术后肾功能的恢复。本组病例中, 虽然术后第1天患者肌酐水平较术前升高(P< 0.05, 差异有统计学意义), 但随访至术后3个月时, 患者肌酐水平与术前相比差异已经没有统计学意义(P> 0.05), 说明本组病例通过“ 杂交” NSS手术降低手术难度、缩短肾缺血时间, 最终使患者术后仍能维持较好的总肾功能状态。
关于肿瘤学控制方面, Sundaram 等[7]发现NSS术后病理切缘阳性的患者占约3%, 但只有7%的阳性切缘患者再次手术证实存在肿瘤残余。多项研究显示[8, 9], 只要肿瘤包膜完整, 实施肿瘤剜除术与根治性肾切除术, 均可获得相似的肿瘤学预后[10]。“ 杂交” NSS手术的优势在于, 即使肿瘤较大, 也可以在直视下寻找肿瘤包膜与肾实质之间的平面进行肿瘤剜除, 避免腹腔镜操作时切开肿瘤包膜导致肿瘤残留甚至种植, 尤其是在处理复杂肾囊性病变时采用“ 杂交” NSS术更为有利。临床实践中, 完全腹腔镜下处理复杂肾囊性肿瘤时, 操作过程中极易导致肿瘤包膜破裂, 造成肿瘤种植扩散。本组病例中, 有5例患者术前影像学检查提示肿物以囊性成分为主, 因担心完全腹腔镜下操作切破囊性组织而采用“ 杂交” NSS手术。转成开放手术时可用手指轻柔托起囊性肿物, 剪刀紧邻肿物包膜剪开肾实质, 最大限度地防止包膜破裂造成肿瘤扩散。术后病理证实5例囊性肿物中:透明细胞癌2例、乳头状肾癌1例、囊性肾瘤1例、肾囊肿1例。另外, 本组16例病例中, 术后病理提示5例为良性肿瘤, 除2例错构瘤外, 其余3例术前从影像学上均不能排除恶性肿瘤可能, 通过实施“ 杂交” NSS手术成功为患者保留了肾。实践证明, “ 杂交” NSS手术能安全地处理较大肾肿瘤或者复杂肾囊性病变, 最大限度地保留患肾残存肾组织, 降低肿瘤包膜破裂造成的肿瘤种植和播散。
对于体积较大(T1b及以上)的肾肿瘤, 通常基底较深, 如果术前评估完全腹腔镜下操作有困难, 可以采用“ 杂交” NSS手术在直视下切除肿瘤和缝合创面。在切除肾肿瘤过程中, 要最大限度地保留正常肾组织, 这对后续肾重建以及远期肾功能的恢复尤为重要。缝合创面时, 我们建议分两层缝合, 创面底部使用5/8弧度、3-0倒刺线, 其优势在于:(1) 5/8弧度针弧度大, 能够在较为局限的创缘底部有效地进针和出针, 缝合效果确切; (2)创面基底连续缝合后, 能够将创缘拉拢, 方便肾实质创面的连续无张力缝合。
本组患者发生Clavien Ⅲ 级以上并发症2例:1例集合系统损伤, 术中及时修补后留置DJ管, 术后未出现尿瘘; 1例患者出现术后出血, 急诊手术探查止血, 术中发现紧邻肾门部的肾实质创缘处持续渗血, 在不阻断情况下用倒刺线间断8字缝合出血处, 收紧缝线后渗血停止。其余相关并发症均较轻, 采取对症治疗后均得到良好恢复。
通过对上述16例病例的回顾性分析我们发现, 对于肿瘤直径较大(T1b及以上)、R.E.N.A.L.评分较高(≥ 9分)、肿瘤部位特殊(肾门部)或者肿瘤以囊性成分为主时, 术前评估完全腹腔镜下操作困难, 如果患者有NSS的手术适应证或者保肾意愿强烈, 通过合理的手术方案设计, 采用后腹腔镜联合经腰小切口的“ 杂交” NSS手术能够降低手术难度, 有效地保留患侧肾, 从而使一部分患者获益, 具有一定的临床推广价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|


