目的:探索前列腺癌经内分泌治疗后进入去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)的预测因素,以更好地指导临床和提高患者预后。方法:回顾性分析了2003年1月至2014年12月在北京大学第一医院泌尿外科确诊前列腺癌并且初始治疗为内分泌治疗的患者共185例,收集并整理分析的临床信息包括患者年龄、前列腺癌TNM分期、前列腺癌病理Gleason评分(Gleason score, GS)、前列腺癌危险度、内分泌治疗开始时前列腺特异性抗原(prostate-specific antigen, PSA)水平、经过内分泌治疗后的PSA最低值、PSA下降速率以及降到PSA最低值的时间。应用Kaplan-Meier生存分析和log-rank检验比较不同分组间CRPC进展时间的差异,应用Cox风险比例回归模型来分析评估这些因素对CRPC进展时间的影响。结果:185例患者平均年龄(71.02±8.67)岁,CRPC进展的中位时间为38个月(4~158个月)。单因素分析中,前列腺癌T分期、N分期、前列腺癌危险度、内分泌治疗前是否发生远处转移、PSA下降速率和PSA最低值均与CRPC进展时间显著相关( P值均小于0.01)。在多因素分析中,内分泌治疗前已发生远处转移( HR=6.030,95% CI:3.229~11.263, P=0.001)、较高的PSA最低值( HR=1.185,95% CI:1.080~1.301, P=0.001)、PSA下降速率>11 μg/(L·month)( HR=2.124,95% CI:1.195~3.750, P=0.001)以及到达PSA最低值的时间≤9个月( HR=3.623,95% CI:1.640~4.817, P=0.004)均是CRPC进展时间较短的危险因素。结论:前列腺癌患者经过内分泌治疗后,PSA下降速率越快,进入CRPC时间越短。
Objective:To explore risk factors including prostate-specific antigen (PSA) kinetics for the prediction of castration-resistant prostate cancer (CRPC), and to build a practical model for predicting the progression to CRPC after androgen deprivation therapy(ADT) so as to facilitate clinicians in decision-making for prostate cancer patients receiving ADT.Methods:A total of 185 patients with prostate cancer who had received ADT as the primary therapy in Department of Urology of Peking University First Hospital from 2003 to 2014 were enrolled retrospectively. All the patients were diagnosed with prostate cancer via prostate biopsy and followed up every four weeks from the initiation of ADT. All the patients received ADT with luteinizing hormone-releasing hormone agonists (LHRH-A) or surgical castration accompanied with an antiandrogen (bicalutamide or flutamide, combined androgen blockade). The clinical information of the patients were collected including age, clinical TNM stage, Gleason score (GS), risk groups of prostate cancer, PSA at the initiation of ADT, PSA nadir after ADT, PSA decline velocity, and the time to PSA nadir. The end point of this study was the diagnosis of CRPC, which was based on the European Association of Urology (EAU) Guideline 2016. Cox proportional hazards regression models were established to analyze and estimate their effects on the time of progression to CRPC.Results:In this study, 185 patients with prostate cancer who had received ADT as the primary therapy were included. The mean age was (71.02±8.67) years. The median time to progression to CRPC in this cohort was 38 months (ranging from 4 to 158 months). On univariate analysis, we found clinical T stage, N stage, the metastasis state before ADT, risk groups of prostate cancer, PSA decline velocity, and PSA nadir were all related to the time to CRPC progression, P<0.01 for all the above variables. And on multivariate analysis, the presence of distant metastasis before ADT ( HR=6.030, 95% CI: 3.229-11.263, P=0.001), higher PSA nadir ( HR=1.185, 95% CI: 1.080-1.301, P=0.001), higher PSA decline velocity>11 μg/(L·month) ( HR=2.124, 95% CI: 1.195-3.750, P=0.001), and time to PSA nadir ≤ 9 months ( HR=3.623, 95% CI: 1.640-4.817, P=0.004) were found to be significantly associated with an increased risk of progression to CRPC.Conclusion:Patients with rapid decreasing of PSA in the initial ADT were more likely to progress to CRPC.
无论是局限性晚期前列腺癌还是转移性前列腺癌, 内分泌治疗都是最重要的治疗方式。虽然在内分泌治疗的初期针对前列腺癌的治疗效果较为显著, 但是绝大多数患者在经过一定时间的内分泌治疗后都会从激素敏感性前列腺癌(hormone sensitive prostate cancer, HSPC)进入去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)阶段[1, 2]。
目前尚无针对CRPC进展时间的确切、统一的预测模型。前列腺特异性抗原(prostate-specific antigen, PSA)作为前列腺癌诊疗过程中一项重要的血清学指标一直以来被普遍认为是能预测CRPC进展时间的重要预测因素之一。有些研究发现, 较低的PSA最低值和到达PSA最低值的时间较短(time to PSA nadir, TTN)提示进入CRPC的时间较短[3, 4, 5, 6]。但是, 近期更多的研究结论与之相反, 即PSA最低值越低、TTN越长, 进入CRPC时间也越长。Kuo等[7]认为前列腺癌患者在接受间歇内分泌治疗时第一个间歇期内出现PSA升高的时间与其进入CRPC时间的关系呈正相关, 此外, 也有学者发现在开始内分泌治疗之前已有骨转移提示更早进入CRPC[8, 9, 10]。
毋庸置疑, 如何更好地预测前列腺癌患者在接受初始内分泌治疗后进入CRPC的时间对于指导晚期前列腺癌的诊疗工作具有重要意义。针对较易进展为CRPC的高危前列腺癌患者进行密切合理的随访工作能够为患者及时提供个体化的前列腺癌诊疗策略。本研究旨在利用PSA动态变化指标来预测CRPC进展时间, 以便更好地指导接受内分泌治疗的前列腺癌的临床诊疗工作。
回顾性分析2003年1月至2014年12月在北京大学第一医院泌尿外科就诊的并以内分泌治疗作为初始治疗的前列腺癌患者的临床病理资料。所有患者均由前列腺穿刺组织病理检查确诊为前列腺癌, 并从开始内分泌治疗后每月定期随访, 均接受药物去势治疗, 同时服用抗雄激素药物(如比卡鲁胺、氟他胺等), 患者生存时间预期> 6个月。除外在内分泌治疗前已发生脑转移、肝功能不全或感染性疾病等患者。本研究已经过北京大学第一医院生物医学研究伦理委员会批准。
本研究终点事件为CRPC, 诊断标准依据欧洲泌尿外科协会(European Association of Urology, EAU)2016年发布的指南[11], CRPC定义为血清睾酮达到去势水平(血清睾酮< 50 ng/dL或1.7 nmol/L) , 并且发生生化复发(连续3次、每次间隔至少1周, PSA连续升高且至少有两次PSA比最低值升高50%以上), 或有影像学进展(骨扫描发现有2处及2处以上新发骨转移灶, 或较内分泌治疗前骨转移灶从无到有, 或磁共振提示前列腺癌软组织浸润范围扩大[12])。
收集分析的临床数据资料包括患者年龄、肿瘤临床TNM分期、前列腺癌Gleason评分、前列腺癌危险度(EAU 2016年发布的指南[11])、内分泌治疗前的PSA水平、内分泌治疗过程中的PSA最低值、到达PSA最低值的时间、PSA下降速率[(PSA基线值-PSA最低值)/到达PSA最低值的时间]。根据最新的病理评分系统将所有患者的Gleason评分分成以下5组:grade group 1=Gleason score≤ 6, grade group 2=Gleason score 3+4=7, grade group 3 = Gleason score 4+3=7, grade group 4 = Gleason score 4+4=8, grade group 5 = Gleason score为9和10。CRPC进展时间为从内分泌治疗开始到CRPC的时间间隔。
使用SPSS 22.0统计软件进行统计分析, 用Kaplan-Meier 生存分析和log-rank检验比较不同分组间CRPC进展时间的差异, 用多因素Cox风险比例回归模型评估各危险因素对CRPC进展时间的影响。多因素分析变量纳入单因素分析结果中差异有统计学意义和有临床意义的变量, 模型筛选方法采用Wald卡方后退法进行多因素筛选, 标准为P< 0.05的变量进入模型, P> 0.1的变量予以剔除。P< 0.05定义为差异有统计学意义。
本研究共纳入以内分泌治疗为初始治疗方式的前列腺癌患者185例, 平均年龄(71.02± 8.67)岁, CRPC进展中位时间为38个月(4~158个月)。患者的详细临床信息资料见表1。
| 表1 接受去势治疗的患者基本信息和CRPC进展时间 Table 1 Baseline clinical characteristics of patients treated with androgen deprivation therapy and median time to CRPC |
在单因素分析中, PSA最低值和PSA下降速率均与CRPC进展时间显著相关(P值均< 0.01)。根据到达PSA最低值的时间将所有患者分成PSA下降到最低值时间≤ 9个月和> 9个月两组, CRPC进展时间分别为23个月和57个月(χ 2=22.569, P=0.001)。根据约登指数(Youden index, 敏感性+特异性-1)确定临界值将PSA下降速率分为≤ 11 μ g/(L· month) 和> 11 μ g/(L· month)两组, CRPC进展时间分别为44个月和24.5个月(χ 2=26.922, P=0.001)。根据前列腺癌危险度分组, 低危、中危和高危组CRPC进展时间分别为68个月、56个月和28个月(χ 2=12.705, P=0.001)。与内分泌治疗前无远处转移的患者相比, 已发生远处转移的患者CRPC进展时间明显较短, 分别为62个月和23个月(χ 2=51.763, P=0.001)。临床T分期、N分期以及病理评分分级也均与CRPC进展时间明显相关(P=0.001, P=0.002, P=0.001), 具体见表2。
| 表2 影响去势治疗后患者CRPC进展时间的变量的单因素和多因素分析 Table 2 Univariable and multivariable analyses of risk factors of progression to CRPC after androgen deprivation therapy |
PSA最低值、PSA下降速率、前列腺癌危险度以及内分泌治疗前是否有远处转移与CRPC进展时间的生存曲线见图1。
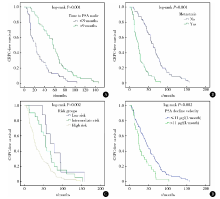 | 图1 不同分组CRPC进展时间的生存曲线分析 A, time to PSA nadir (≤ 9 months vs. > 9 months); B, with or without metastasis; C, risk groups (low risk, intermediate risk, and high risk); D, PSA decline velocity [≤ 11 μ g/(L· month) vs. > 11 μ g/(L· month)]. Abbreviations as in Table 1.Figure 1 Kaplan-Meier CRPC-free survival in various groups |
在多因素分析结果中, 内分泌治疗前已发生远处转移(HR=6.030, 95% CI:3.229~11.263, P=0.001)、较高的PSA最低值(HR=1.185, 95% CI:1.080~1.301, P=0.001)、PSA下降速率较快(HR=2.124, 95% CI:1.195~3.750, P=0.001)以及PSA下降到最低值时间≤ 9个月(HR=3.623, 95% CI:1.640~4.817, P=0.004)都是CRPC进展时间的危险因素(表2)。
目前, 尚缺乏能够有效预测CRPC进展时间的分子标志物, PSA的动态变化指标是目前预测CRPC进展时间最常见的指标, 而且现阶段普遍接受的观点是PSA下降速率越快提示预后越好[6]。Yu等[13]发现, 接受间歇内分泌治疗的第一个间歇期的时间长短与CRPC进展时间以及患者的总生存相关, 此外, 在第一个间歇期内PSA升高的时间越长也预示CRPC进展时间也较长[7]。Kim等[14]的研究认为, 前列腺癌患者在接受间歇内分泌治疗之后PSA下降到最低值后会出现PSA波动期, 在此期间如果PSA的下降速率每个月≥ 0.048 μ g/L, 提示进展为CRPC的时间相对较长, 然而, Teoh等[15]在对接受初始内分泌治疗的转移性前列腺癌患者的研究中发现, PSA下降到最低值的时间越快即PSA下降速率越快, 无进展生存期和总生存期越短。既往的各项研究表明, PSA可以作为预测CRPC进展时间的重要生化指标。
PSA最低值也一直被认为是评估前列腺癌内分泌治疗后预后的一项重要指标。Svatek等[16]构建了包括内分泌治疗开始前PSA水平、PSA增倍时间和PSA最低值等指标来评估前列腺癌无去势抵抗性生存期的模型。相似的研究还有关于前列腺癌放疗后是否联合内分泌治疗后PSA最低值和PSA下降速率与预后的关系[17]。
本研究发现, 内分泌治疗前已发生远处转移、PSA最低值较高、PSA下降速率较快以及下降到PSA最低值的时间≤ 9个月均提示CRPC进展时间较快。简而言之, 就是在经过内分泌治疗后, 前列腺癌患者PSA下降速率越快, 进展为CRPC的时间也就越早。
相较于国外其他学者的研究, 本研究最显著的发现在于PSA下降速率较快是CRPC进展时间的重要危险因素, 其具体机制尚不清楚, 其中一个原因可能是内分泌治疗后引起PSA的下降仅能说明PSA表达水平的下调, 而并非是促进了前列腺肿瘤细胞的死亡。另外, 由于前列腺癌细胞的肿瘤异质性特点, 包括激素敏感性前列腺癌细胞和激素抵抗性前列腺癌细胞, PSA的快速下降有可能是由于内分泌治疗抑制了激素敏感性前列腺癌细胞中雄激素受体介导的PSA表达水平所导致的[18], 而激素敏感性前列腺癌细胞的快速死亡有可能诱导激素抵抗性前列腺癌细胞的生长增殖, 从而进展为CRPC[18]。
Thomas等[19]在接受化疗的转移性CRPC患者中发现了相似的结果, 从开始内分泌治疗到PSA下降到最低值的时间小于16周是反应持续时间较短和无进展生存期较短的独立预测因素, 快速地杀死化疗敏感性前列腺癌细胞有可能为化疗耐受性前列腺癌细胞提供更有利的生存环境。
在本研究中, 相较于未转移的前列腺癌患者, 转移性前列腺癌更容易也更快进入CRPC, 其CRPC进展时间分别为23个月和62个月(P=0.001)。Sureka等[9]也发现, 印度人群中转移性前列腺癌患者的CRPC进展时间从0~16个月不等。此外, Koo等[10]证实了伴有疼痛的骨转移比单纯的骨转移症状能更准确地预测CRPC进展时间。肿瘤转移与CRPC形成的相关性有可能与具有侵袭性前列腺癌细胞从原发灶逃逸至转移部位有关, 同时肿瘤转移灶微环境中的一些炎症因子(如白细胞介素8、肿瘤坏死因子α 、胰岛素样生长因子和基质金属蛋白酶8)等都会促进CRPC的进展[20], 所以, 对于转移性前列腺癌患者, 针对原发灶和转移灶进行多学科综合治疗可能有助于延长患者的生存期。
本研究结果表明, 在单因素分析中不同的前列腺癌危险度、肿瘤T分期和病理评分分级中, CRPC进展时间均有显著不同, 然而, 在多因素分析中, 前列腺癌危险度、肿瘤T分期以及年龄分组不再是CRPC进展时间的影响因素, 所以不难理解与其他指标相比, PSA的动态参数变化与CRPC进展时间的关系更为紧密。
此外, 有研究表明放疗对于治疗残存的激素敏感性前列腺癌有显著疗效。Shi等[17]也发现在粒子植入后早期, PSA的快速下降与前列腺癌死亡风险增加有关, 该结论与接受内分泌治疗的前列腺癌患者预后相似, 然而, 该研究中的放化疗患者人数有限, 其对CRPC进展时间的影响无法得出有效的统计分析结果。
本研究尚存在一定的局限性和不足, 其中最主要的一点是因回顾性研究无法避免一些未知混杂因素所造成的偏倚, 再者, 基于有研究称内分泌治疗或放疗有可能诱导雄激素受体的表达, 本研究缺乏其他生物标志物的检测(如AR-V7等), 本研究样本量也有待进一步扩大, 需要更多的病例进一步更深入研究。
综上所述, 前列腺癌患者开始内分泌治疗前已发生远处转移、内分泌治疗过程中PSA最低值较高、PSA下降速率较快以及到达PSA最低值的时间小于9个月的患者进展为CRPC的风险更高、时间较短, 其机制可能与快速降低的PSA激活雄激素受体介导的信号转导通路有关。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|


