目的:探讨一线应用奥沙利铂联合氟尿嘧啶、亚叶酸钙(FOLFOX)方案化疗的晚期结直肠癌患者中性粒细胞减少(chemotherapy-induced neutropenia,CIN)与预后的关系。方法:回顾性分析一线应用FOLFOX方案化疗的晚期结直肠癌患者158例,根据患者化疗后3周期内最低中性粒细胞数与化疗前比较分为CIN程度大的组(较化疗前降低大于等于1.0×109)和程度小的组(较化疗前CIN降低小于1.0×109)以及无明显变化组,分析其与预后的关系。结果:CIN降低程度是患者预后指标无进展生存(progression free survival, PFS)和总生存(overall survival, OS)的独立影响因素。根据COX多因素回归分析,CIN程度大的组(large,L)较无明显变化组(absent,A)死亡风险降低31%( HR=0.687,95% CI: 0.381~0.812, P=0.016);CIN程度小的组(slight,S)较无明显变化组死亡风险降低18%( HR=0.817,95% CI: 0.527~0.939, P=0.027)。无明显变化组 (A)患者的中位OS为12.9个月,CIN程度少的组(S)患者的中位OS为17.3个月,CIN程度大的组(L)患者的中位OS为20.8个月(S vs. L, P=0.018; L vs. A, P=0.009; S vs. A, P=0.011)。结论:CIN程度是晚期结直肠癌化疗判断预后的独立影响因素,监测并根据CIN程度及时调整化疗药物剂量,或许有助于改善预后。
Objective:To evaluate the prognostic value of chemotherapy-induced neutropenia (CIN) in metastatic colon cancer undergoing first-line chemotherapy with FOLFOX.Methods:Data were collected from a retrospective survey of 158 consecutive metastatic colon cancer patients who had undergone FOLFOX chemotherapy. The clinicopathological characteristics and chemotherapy features of the patients were analyzed as potential prognostic factors. The patients were stratified by the decreased level of CIN to three groups: large decreased level (the number of neutrophil decreased more than 1.0×109 compared with that before chemotherapy),small decreased level (the number of neutrophil decreased less than 1.0×109 compared with that before chemotherapy) and the absence of neutropenia.Results:According to a multivariate COX model, decreased level of CIN was a independent prognostic factor of colon cancer patients. Hazard ratios of death were 0.687 (95% CI: 0.381-0.812, P=0.016) for patients with large decreased level of CIN and 0.817 (95% CI: 0.527-0.939, P=0.027) for those with small decreased level of CIN compared with those of absent neutropenia patients. Median overall survival was 12.9 months (95% CI: 10.4-15.4) for patients without neutropenia (A) compared with 20.8 months (95% CI: 18.3-23.1) for patients with large-decreased level of CIN (L) and with 17.3 months (95% CI: 16.2-18.8) for those with small-decreased level of CIN (S vs. L, P=0.018; L vs. A, P=0.009; S vs. A, P=0.011).Conclusion:Our results demonstrate that the decreased level of CIN is a predictor of prognosis in patients with metastatic colon cancer undergoing FOLFOX chemotherapy. Patients who have experienced large decreased level of CIN haave longer survival time than small decreased level of CIN or absent patients. To monitor CIN decreased level timely and adjust chemotherapy drug dose may help improve the prognosis.
随着人口老龄化的加重和人们生活水平的提高, 以及饮食结构的调整, 结直肠癌发病率和死亡率呈逐年上升趋势, 以化疗为主的综合治疗在结直肠癌患者的治疗中占重要地位, 研究证实在多种肿瘤中化疗引起的中性粒细胞减少往往与较好的预后相关[1, 2, 3], 然而, 关于中性粒细胞减少的标准, 不同学者有着不同的分析, 较常见的分组方法有按照CTCAE 4.0标准将患者分为G0、G1、G2、G3、G4组, 将G1和G2合并称为轻度减少, 将G3和G4合并称为重度减少[4]。本研究尝试采取一种新的分组方法, 即以对比化疗前和化疗后3周期内中性粒细胞减少程度进行分组, 探讨化疗引起的中性粒细胞降低级别和减少程度与预后的关系, 以期调整化疗药物剂量, 达到更好的疗效。
选择2012年6月至2013年8月在中国人民解放军总医院肿瘤科住院的晚期结直肠癌患者158例为研究对象进行回顾性分析, 所有病例均经病理学诊断为结直肠癌。
纳入标准: (1)按照TNM标准分期均为Ⅳ 期患者, 无手术指征; (2)年龄≤ 75岁; (3)治疗前卡氏(Karnofsky, KPS)评分≥ 80分; (4)无化疗禁忌; (5)骨髓造血功能正常:外周血白细胞总数> 4× 109/L, 粒细胞总数> 2× 109/L, 血小板计数> 100× 109/L, 血红蛋白(hemoglobin, Hb) > 65 g/L。(6) 预计生存期大于3个月。
排除标准:(1)既往肿瘤病史; (2)既往接受过化疗和放疗; (3)骨髓转移; (4)脑转移; (5)接受靶向治疗; (6)接受生物治疗。
患者接受奥沙利铂联合氟尿嘧啶(5-Fu)、亚叶酸钙方案(FOLFOX)化疗: 第1天奥沙利铂85 mg/m2和亚叶酸钙135 mg/m2, 5-FU 400 mg/m2入小壶; 5-Fu 2 400 mg/m2泵入46 h, 14 d为1个周期。出现Ⅲ ~Ⅳ 度中性粒细胞减少时使用粒细胞集落刺激因子治疗, 不预防性使用。患者均至少接受3周期FOLFOX方案化疗, 评估3周期内中性粒细胞计数。
每个化疗周期的前1日, 以及化疗后第7、14天检验血常规。根据CTCAE(common terminology criteria for adverse events)4.0的标准, 中性粒细胞减少分为G1级:1.5× 109~2.0× 109; G2级:1.0× 109~1.5× 109; G3级:0.5× 109~1.0× 109; G4级:< 0.5× 109。目前研究较多的分组方式, 是按照中性粒细胞减少级别分组。评估3周期内中性粒细胞降低级别, 将G1和G2组合并为轻度减少组, G3和G4组合并为重度减少组, 由此将患者分为无CIN组(absent, A), 轻度减少组(mild, M)和重度减少组(severe, S)。本文采用新的分组方式, 对比患者化疗后3周期内出现的最低中性粒细胞数与化疗前中性粒细胞数得出差值, 若减少> 1.0× 108则为减少程度大的组(large decreased level, L), 若小于1.0× 108则为减少程度小的组(small-decreased level, S), 若未出现CIN或增多则为无CIN组(absent, A)。
患者无进展生存(progression-free survival, PFS)定义为从化疗开始至疾病进展或死亡的时间间隔, 总生存(overall survival, OS)定义为化疗开始至死亡的时间间隔, 按照WHO实体肿瘤近期客观疗效评定标准(RECIST 1.0)分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)和进展(progressive disease, PD), 以CR+PR计算有效率(objective response rate, ORR), 以CR+PR+SD计算疾病控制率(disease control rate, DCR)。
患者化疗第1年内每3个月随访1次, 以后每6个月随访1次, 全组患者随访至2014年6月20日建立完整的随访档案, 本组资料的随访率为96%。
采用SPSS19.0软件进行统计分析, 使用卡方检验进行相关性分析, 采用Kaplan-Meier乘积极限法进行生存描述, 选择Log-rank法进行单因素分析, 采用COX比例风险回归模型验证各因素对PFS和OS的预后价值, P< 0.05认为差异具有统计学意义。
共纳入158例晚期结直肠癌患者, 中位年龄59岁(27~72岁)。其中肝转移87例, 均无骨髓转移, 所有患者均接受至少3周期FOLFOX方案化疗。
158例患者中无CIN者34例(21%), 轻度CIN者86例(55%), 重度CIN者38例(24%)。卡方检验显示CIN级别与年龄、性别、有无肝转移、组织学分级、KPS(Karnofsky performance status)评分无显著相关性(P> 0.05)。
158例患者中CIN程度大的患者为61例(39%), 减少程度小的患者为65例(41%), 未出现CIN的患者为32例(20%)。卡方检验显示CIN程度与年龄、性别、有无肝转移、组织学分级、KPS评分无显著相关性(P> 0.05)。
单因素分析显示:性别、年龄、体表面积、病理分级、有无肝转移不是PFS和OS的显著影响因素(P> 0.05), 而KPS、骨髓抑制程度、骨髓抑制级别等因素是PFS和OS的显著影响因素(P< 0.05)。
将不同CIN级别组内进行比较, 可见轻、重度CIN组的PFS、OS均与未出现CIN者差异有统计学意义, 但轻度和重度之间差异并无统计学意义。CIN程度大的组、减少程度小的组和未出现CIN的组PFS、OS差异均有统计学意义, 且CIN程度大的和减少程度小的组间差异亦有统计学意义(表1)。
| 表1 晚期结直肠癌患者各临床特征与OS、PFS的单因素分析 Table 1 Univariate analysis for the association between clinical characteristics with and survival |
经COX多因素分析, 患者KPS评分、有无肝转移、组织分级不是OS和PFS的独立影响因素, CIN降低级别和CIN程度均是PFS、OS的独立影响因素。CIN程度大的组较无明显变化组进展风险降低24%(HR=0.736, 95% CI: 0.326~0.918, P=0.014); CIN程度小的患者较无明显变化组进展风险降低18%(HR=0.821, 95% CI: 0.516~0.935, P=0.009)。CIN程度大的组较无明显变化组死亡风险降低31%(HR=0.687, 95% CI: 0.381~0.812, P=0.016); CIN程度小的患者较无明显变化组进展风险降低18%(HR=0.817, 95% CI: 0.527~0.939, P=0.027)。CIN降低级别中, 轻、重度组均较未出现CIN组死亡风险和进展风险降低(表2)。
| 表2 晚期结直肠癌患者各临床特征与OS、PFS的多因素分析 Table 2 Multivariate analysis for the association between clinical characteristics with survival |
截止至随访终点2014年6月, 患者中位随访时间为25个月, 整体中位无进展生存时间(median progress-free survival, mPFS)为6.6 个月, 中位总生存时间(median over survival, mOS)为16.8个月。
2.5.1 出现CIN患者的各级别组间患者PFS、OS对比 对于CIN降低各组间的生存分析, 未出现CIN(A)患者的中位OS为12.9个月, 轻度CIN(M)患者的中位OS为18.9个月, 重度CIN(S)患者的中位OS为17.6个月(S vs. M, P=0.32; M vs. A, P=0.015; S vs. A, P=0.021)。未出现CIN(A)患者的中位PFS为3.7个月, 轻度CIN(M)患者的中位PFS为6.3个月, 重度CIN(S)患者的中位PFS为6.7个月(S vs. M, P=0.450; M vs. A, P=0.023; S vs. A, P=0.028)。生存曲线显示(图1和图2), 轻度和重度CIN患者PFS、OS均较未出现者明显延长, 但轻度和重度之间差异并无统计学意义。
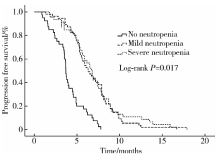 | 图1 晚期结直肠癌患者CIN各级别组间PFS曲线比较Figure 1 PFS by development of neutropenia in mild, severe and absent group analysis |
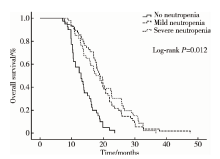 | 图2 晚期结直肠癌患者CIN各级别组间OS曲线比较Figure 2 OS by development of neutropenia in mild, severe and absent group analysis |
2.5.2 根据中性粒细胞在化疗过程中降低的程度分组, 对比降低不同程度的组别中PFS、OS的区别 未出现CIN(A)患者的中位OS为12.9个月, CIN程度少的组(S)患者的中位OS为17.3个月, CIN程度大的组(L)患者的中位OS为20.8个月(S vs. L, P=0.018; L vs. A, P=0.009; S vs. A, P=0.011)。未出现CIN(A)患者的中位PFS为3.6个月, CIN程度少的组(S)患者的中位PFS为5.7个月, CIN程度大的组(L)患者的中位PFS为7.8个月(S vs. L, P=0.014; L vs. A, P=0.002; S vs. A, P=0.017)。生存曲线显示(图3和图4), CIN程度大和程度小患者PFS、OS均较未出现者明显延长, 但减少程度大和减少程度小组之间差异有统计学意义。
 | 图3 晚期结直肠癌患者CIN程度组间PFS曲线比较Figure 3 PFS by development of neutropenia in large, small decreased level and absent group analysis |
158例患者化疗3周期内中获得CR的患者为0例, PR为89例, SD为30例, PD为39例。总体 ORR为56.0%, DCR为75.0%。3周期内中性粒细胞减少程度大的组治疗有效率为69%, 疾病控制率为92%, 均高于减少程度小的组和未出现中性粒细胞减少组, 差异有统计学意义(表3)。
| 表3 疗效分析 Table 3 The efficacy analysis |
以化疗为主的综合治疗是延长晚期结直肠癌患者生存的有效治疗方法, 患者在化疗期间出现中性粒细胞减少是常见的, 也是严重的毒副作用之一, 往往成为其主要的剂量限制性毒性[5]。化疗导致中性粒细胞减少与药物的种类、用量和治疗周期数等相关[6], 因此本研究统一选取接受FOLFOX方案化疗的晚期结直肠癌患者, 评估3周期内中性粒细胞水平进行研究分析。
上世纪90年代初, 一些研究首先在乳腺癌治疗中发现CIN与较好的疗效及预后相关[7, 8, 9]。相继在肺癌、胃癌、卵巢癌中也发现了类似结论[10, 11, 12]。2005年Di Maio等[13]分析了1 265名非小细胞肺癌患者, 发现出现化疗引起的中性粒细胞减少(CIN)预示着更好的预后, 而多因素分析轻度和重度CIN患者之间生存差异并无统计学意义(P=0.520)。2006年Banelji 等[14]分析了173例小细胞肺癌, 得出获得G3和G4级即重度CIN患者组较G1和G2即轻度CIN组获得更长OS的结论(60 weeks vs. 47 weeks, P=0.008)。2012年Han等[2]分析了355例早期乳腺癌患者, 得出轻度CIN患者获得更高的治疗有效率的结论。尽管CIN在多项临床研究中预示着较好的预后, 但是, 如何分组以及何种级别CIN能够获得更好的预后, 依然有待分析探讨。
本回顾性分析中, 未出现CIN(A)患者的中位OS为12.9个月, 轻度CIN(M)患者的中位OS为18.9个月, 重度CIN(S)患者的中位OS为17.6个月(S vs. M, P=0.32; M vs.A, P=0.015; S vs.A, P=0.021)。多因素分析亦显示CIN降低级别是独立预后因素, 但轻度减少和重度减少组间差异并无统计学意义, 与国外临床研究结论一致[13]。
进行数据搜集分析时, 我们发现化疗前后中性粒细胞降低程度较大的患者, 倾向于更好的预后, 进行多次尝试后, 提出了化疗前后中性粒细胞减少程度这一新的分组方式, 患者化疗前中性粒细胞计数与患者化疗3周期内最低中性粒细胞计数进行对比, 若中性粒细胞减少差值≥ 1.0× 109则分至减少程度大的组内, 若中性粒细胞减少差值< 1.0× 109则分至减少程度小的组内, 若未发生中心粒细胞减少甚至增多则分至未出现中性粒细胞减少组。未出现CIN(A)患者的中位OS为12.9个月, CIN程度少的组(S)患者的中位OS为17.3个月, CIN程度大的组(L)患者的中位OS为20.8个月(S vs. L, P=0.018; L vs. A, P=0.009; S vs. A, P=0.011), 减少程度大的组患者可能化疗前白细胞处于正常范围内高值, 化疗后仅为G1和G2, 亦可能化疗前白细胞处于正常范围内低值, 化疗后获得G3和G4级CIN, 此组患者预后好于减少程度小的组, 亦好于未出现CIN的组, 且治疗有效率以及疾病控制率均高于其他两组。对此3组患者平均化疗药物浓度进行分析对比, 3组之间差异并无统计学意义。分析其机制, 化疗药物疗效与作用于细胞的有效药物剂量相关。有效药物剂量与两方面相关, 一方面是机体对药物的代谢, 进入细胞的药物浓度不同; 另一方面是细胞对药物的敏感性不同。第一方面, 由于不同患者肝、肾药物代谢水平不同, 化疗药物在患者体内的血药浓度往往不同, 仅通过体表面积计算化疗药物剂量是不充分的[15, 16]; 第二方面, 药物在机体细胞内的代谢与其基因类型、DNA修复酶等相关[17]。机体全身细胞具有相同基因类型和相似的修复酶, 推测患者骨髓细胞对药物的敏感性与肿瘤组织对药物的敏感性是类似的, 因此可将中性粒细胞减少作为衡量个体化有效药物浓度的间接监测指标。化疗过程中出现中性粒细胞的减少或许间接提示有足够有效的化疗药物到达肿瘤细胞, 并产生杀伤作用, 未出现中性粒细胞减少患者, 可能与药物剂量不足相关, 不能达到有效血药浓度。目前也有一些学者认为, 化疗所致的中性粒细胞减少、血小板减少等与肿瘤干细胞的杀伤存在相关性。化疗所致的骨髓抑制可以一定程度上反映药物对肿瘤干细胞的杀伤作用, 从而影响患者的预后, 这一理论尚需进一步的研究证实[16, 17]。
评价中性粒细胞减少, 患者化疗前骨髓状态理应考虑在内, 对比化疗前中性粒细胞数值与化疗3周期内中性细胞数值能够更精确地反映由化疗引起的中性粒细胞变化, 更有效地监测化疗对中性粒细胞的作用, 进而间接反映化疗药物对肿瘤细胞的作用, 因此, 化疗前白细胞处于正常范围内高值, 化疗后仅为G1和G2, 亦或化疗前白细胞处于正常范围内低值, 化疗后获得G3和G4级CIN患者均属于化疗前后中性粒细胞减少程度大的组, 此组患者预后好于减少程度小的组, 提示其化疗敏感性好, 药物可达到有效治疗浓度。
医生常根据化疗后中性粒细胞减少来降低化疗药物剂量, 反之, 对于没有出现中性粒细胞减少的患者, 并未增加药物剂量, 推测这些患者可能没有获得有效的药物浓度。通过监测化疗前后中性粒细胞水平变化进行临床药物剂量调整, 使现有的药物得到更合理充分的应用, 或许能够使更多的患者得到有效治疗。
综上所述, 肿瘤患者的化疗过程中, 化疗后较化疗前出现中性粒细胞减少是一个独立预后因素。中性粒细胞减少程度大的患者往往具有更好的预后, 提示未出现中性粒细胞减少患者化疗药物可能未达到最佳有效剂量。监测并根据中性粒细胞减少程度及时调整化疗剂量, 或许有助于提高化疗疗效及改善预后。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|



