目的:研究人重组转化生长因子β1(recombinant human transforming growth factor β1, rhTGF-β1)对牙髓干细胞生物学性能的影响,包括确定促进牙髓干细胞增殖的最佳作用浓度和该浓度下对牙髓干细胞分化的作用。方法:分离培养人健康第三磨牙牙髓干细胞,分别加入1 μg/L、6 μg/L、10 μg/L的rhTGF-β1,CCK-8(cell counting kit-8)法检测对牙髓干细胞增殖的影响,选择出最佳浓度在成骨/成牙本质诱导条件下连续培养,酶标仪检测碱性磷酸酶(alkaline phosphatase, ALP)光密度值,二喹啉甲酸(bicinchoninic acid, BCA)蛋白质定量试剂盒计算总蛋白含量,两者比值作为ALP相对活性的指标。茜素红染色观察矿化结节形成能力,染色液洗脱后检测光密度值,比较rhTGF-β1对牙髓干细胞增殖和分化的作用。结果:牙髓干细胞具有体外形成矿化结节的能力,6 μg/L rhTGF-β1可促进牙髓干细胞增殖;连续培养7 d后,6 μg/L rhTGF-β1组细胞ALP的光密度值为0.31±0.03,显著高于对照组0.02±0.01( P<0.05);6 μg/L rhTGF-β1组总蛋白含量为(2 775.46±83.54) mg/L,对照组为(1 432.20±110.83) mg/L ( P<0.05);ALP相对光密度值,6 μg/L rhTGF-β1组较对照组提高了6倍。茜素红染色下显示矿化结节形成增加,洗脱液光密度值6 μg/L rhTGF-β1组和对照组分别为0.83±0.02和0.55±0.05, P<0.05。结论:6 μg/L rhTGF-β1具有促进牙髓干细胞增殖和促进体外成牙本质分化的作用。
Objective:To explore suitable concentration of recombinant human transforming growth factor β1 (rhTGF-β1) usage and study the effect of rhTGF-β1 on differentiation of dental pulp stem cells (DPSCs).Methods:DPSCs were isolated from the undiseased third molars of people aged 18-25 years and cultured according to instructions in vitro. Different concentrations (1 , 6 , 10 μg/L) of rhTGF-β1 were added to the culture medium to examine DPSCs proliferation by CCK-8 (cell counting kit-8) assay.The suitable concentration was then selected. For differentiation, the DPSCs were incubated for 7 or 14 days with rhTGF-β1 supplemented with osteo/odontoblastic induction medium containing 10 nmol/L dexamethasone, 10 mmol/L b-glycerophosphate, 50 g/L ascorbate phosphate, 10 nmol/L 1,25-dihydroxyvitamin D3 and 10% fetal bovine serum. The cells were then washed 3 times with phosphate-buffered saline and sonicated with 1%Triton X-100 for 30 minutes on ice. Cellular alkaline phosphatase (ALP) activity was assayed with p-nitrophenyl phosphate as the substrate. The enzyme activity was expressed as p-nitrophenyl produced per milligram of protein [bicinchoninic acid (BCA) protein assay kit]. To examine mineral nodule formation, the cultured cells were fixed in 4% paraformaldehyde and washed in water, and the mineralization of the extracellular matrix was assayed by 1% alizarin red S staining and elution of staining was examined as optical density (D) under microplate reader. The mean difference was considered significant at 0.05 and 95% confidence interval.Results:The DPSCs had ty-pical fibroblast morphology and could form mineral nodules after being cultured with osteo/odontoblstic induction medium for 14 days. 6 μg/L rhTGF-β1 significantly promoted the DPSCs proliferation on the 3rd and 5th days. After the incubation of osteo/odontoblastic induction medium, the DPSCs with the 6 μg/L rhTGF-β1 increased ALP activities compared with the control; D values in the 6 μg/L rhTGF-β1 group was 0.31±0.03, while the control group was 0.02±0.01( P<0.05). The total protein content in the 6 μg/L rhTGF-β1 group was (2 775.46±83.54) mg/L, and the control group was (1 432.20±110.83) mg/L ( P<0.05). To eliminate the cells proliferation influence, relative ALP activities, which was defined as the total ALP divided by the total protein content, the 6μg/L rhTGF-β1 group was 6 times higher than the control group. Alizarin red S staining showed increased mineral nodule formation in the rhTGF-β1 group. The elution of staining under microplate reader also showed more optical density in the 6 μg/L rhTGF-β1-treated cells (0.83±0.02) than that in the control groups (0.55±0.05, P<0.05).Conclusion:6 μg/L rhTGF-β1 could significantly promote DPSCs proliferation and odontoblastic differentiation in vitro.
牙髓干细胞(dental pulp stem cells, DPSCs)自Gronthos等[1]于2000年从人健康第三磨牙牙髓中分离以来, 其性质和临床应用一直是口腔内科学研究的热点, 与其他类型的成体干细胞一样, DPSCs具有自我复制的能力和在一定条件下定向分化成终末细胞的能力[2]。成牙本质细胞是形成牙本质的前体细胞, 也是牙髓组织中的终末分化细胞。在牙齿的正常发育过程中, 成牙本质细胞由牙髓干细胞分化而来, 单层排列于牙本质内层, 不断分泌形成牙本质; 牙齿萌出后, 因龋病等造成成牙本质细胞死亡后, 牙髓内部生活的干细胞分化为成牙本质细胞样细胞, 形成修复性牙本质, 可见, 牙本质的形成与这些细胞的存在具有密切关系。
在牙髓干细胞的成牙本质分化中, 已知多种因子[如转化生长因子β (transforming growth factor β , TGF-β )、骨形态发生蛋白、成纤维细胞生长因子等]可能起到促进分化的作用[3]。正常情况下, TGF-β 存在于牙本质基质中, 当牙齿因龋病等因素出现脱矿, 基质中TGF-β 释放, 促进成牙本质细胞的分化和介导牙体组织的修复。TGF-β 主要有1~3 三种分型, 本文主要研究TGF-β 1对牙髓干细胞增殖、矿化能力的诱导分化作用, 探索其对成牙本质分化的影响, 为临床上牙髓再生、诱导牙本质形成和恢复牙齿结构完整性做准备。
于北京大学口腔医学院口腔颌面外科获取18~25岁、因正畸或阻生拔除的人健康第三磨牙, D-Hanks液冲洗牙齿表面, 在牙颈部将牙齿离断, 拔髓针取出牙髓, D-Hanks液冲洗数次, 置于含消化酶(4 g/L分散酶+3 g/L Ⅰ 型胶原酶, 美国Sigma公司)的培养皿中, 无菌弯剪剪成小于1 mm3的组织块, 收集并转移至15 mL离心管中, 37 ℃恒温振荡器中消化约40 min至组织块疏松, 加入等体积培养基终止消化, 1 200 r/min离心5 min, 弃去上清液, 加入培养基轻柔吹打均匀, 转移至培养皿中, 细胞培养于含10%(体积分数)胎牛血清(美国Hyclone公司)、1%(质量分数)青霉素钠(美国GIBCO公司)、1%(质量分数)链霉素(美国GIBCO公司)、2 mmol/L-谷氨酰胺(美国GIBCO公司)的α -MEM培养基(α -modification of Eagle’ s medium, 美国GIBCO/BRL公司), 恒温培养箱(37 ℃, 5%CO2)中培养。每3天换液, 至相邻细胞克隆集落汇合, 开始传代。
当细胞生长至80%~90%汇合时开始传代, 首先用D-Hanks液冲洗2遍, 加入0.5~1 mL 0.25%(质量分数)胰蛋白酶+ 0.04%(质量分数)乙二胺四乙酸(ethylene diaminetetraacetic acid, EDTA, 美国Sigma公司)消化液, 倒置显微镜下观察, 当细胞收缩成圆形时加入培养基终止消化, 吸管反复吹打培养皿底壁, 形成细胞悬液, 1 200 r/min离心5 min, 弃上清液, 加入少量培养液轻柔吹打均匀, 分3~5份进行传代, 接种于新的培养皿中。用第2代细胞进行实验。
取第2代生长良好的细胞, 以4 000个细胞/孔接种于96孔板中。次日, 向孔中分别加入100 μ L含1 μ g/L、6 μ g/L、10 μ g/L人重组转化生长因子β 1(recombinant human transforming growth factor β 1, rhTGF-β 1, 美国Peprotech公司)的培养基进行诱导, 对照组加入100 μ L α -MEM培养基, 每个浓度设6个复孔。分别于诱导后第1、3、5天避光条件下加入新鲜配制含10 μ L CCK-8 (日本WST公司)的100 μ L 培养基, 37 ℃孵箱孵育1.5 h, 酶标仪(ELX808IU, 美国Biotek公司)测定450 nm下光密度值(optical density, D)。实验重复3次。
取第2代生长良好的细胞, 以50 000个细胞/孔接种于6孔板中。待细胞80%汇合时, 加入成骨/成本质诱导液[含10%(体积分数)胎牛血清、10-8 mol/L地塞米松、1.8 mmol/L磷酸二氢钾、100 U/mL青霉素钠/链霉素、0.1 mmol/L L-抗坏血酸、2 mmol/L L-谷氨酰胺的α -MEM培养基], 每3天换一次液。对照组采用细胞培养液连续培养。
取第2代生长良好的细胞, 以50 000细胞/孔接种于6孔板中, 待细胞汇合80%后, 加入含6 μ g/L rhTGF-β 1的成骨/成牙本质诱导液。连续诱导7 d后, 磷酸盐缓冲溶液 (phosphate buffer saline, PBS)冲洗3遍。每个样本加入200 μ L 1%(体积分数)Triton X-100(美国Sigma公司), 4 ℃裂解30 min。收取细胞, 超声破碎, 12 000 r/min, 4 ℃离心15 min。取60 μ L上清液至96孔板, 加入60 μ L对-硝基苯磷酸盐(p-nitrophenyl phosphate, p-NPP, 美国Sigma公司), 37 ℃孵育15 min, 用30 μ L 3 mol/L NaOH中止反应, 酶标仪测定405 nm下光密度值, 记为碱性磷酸酶光密度值。离心后的样本取20 μ L上清液, 应用BCA蛋白质定量试剂盒(武汉博士德生物工程公司), 酶标仪测定570 nm下光密度值, 记为总蛋白光密度值。倍比稀释的不同浓度标准蛋白光密度值绘制标准曲线, 计算样本中总蛋白含量。将ALP 光密度值与总蛋白含量相比, 作为相对ALP活性的检测指标, 并计算两组间倍增差异。
矿化诱导14 d后, PBS洗3遍, 4%(质量分数)多聚甲醛固定30 min, 蒸馏水洗3遍, 1%(质量分数)茜素红(美国Sigma公司)染色10 min, 蒸馏水充分冲洗, 肉眼及镜下观察棕红色染色颗粒。半定量方法采用每孔加入500 μ L 10 mmol/L磷酸钠和10%(质量分数)西吡氯铵的洗脱液, 摇床洗脱3 h, 取100 μ L样本置于96孔板, 酶标仪检测570 nm波长下光密度值。
使用统计软件SPSS 13.0进行分析, 细胞增殖采用单因素方差分析(组间比较采用LSD法), ALP活性检测和茜素红染色洗脱结果采用独立样本t检验, P< 0.05为差异有统计学意义。
酶消化法进行原代培养后, 第2天可见未贴壁细胞和少量细小纤维悬浮于培养皿中, 换液后可见散在贴壁生长的细胞。约5 d后, 单个细胞呈集落生长, 细胞形态为纺缍形、梭形(图1A)。10 d左右, 细胞数量增加明显, 相邻集落开始汇合, 此时进行细胞的传代培养。
 | 图1 牙髓干细胞原代和第2代细胞形态 A, primary cultured DPSCs, colony was formed(× 4); B, passage 2 were fibroblast-like cells(× 4).Figure 1 Morphology of primary and passage 2 cells |
1~4代人牙髓干细胞状态良好, 细胞形态均一, 后续实验均采用第2代细胞(图1B)。
将牙髓干细胞在成骨/成牙本质诱导条件下, 连续培养14 d, 显微镜下观察细胞呈复层生长, 局部形成漩涡样结构。固定细胞后, 1%(质量分数)茜素红染色, 可见实验组有红染的钙化结节产生(图2A), 阴性对照组未见钙化结节产生(图2B)。
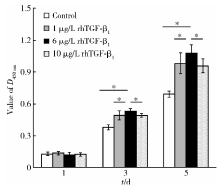
在牙髓干细胞培养液中, 分别加入1 μ g/L、6 μ g/L、10 μ g/L的rhTGF-β 1, 观察对细胞增殖的作用, 结果显示, 加样后第1天不同浓度间细胞数量没有明显差异, 第3天开始, 6 μ g/L rhTGF-β 1具有促进DPSCs生长的作用, 至第5天其促进作用更加明显, 细胞增殖的差异具有统计学意义(P< 0.05, 图3)。
实验组加入6 μ g/L rhTGF-β 1, 7 d后测量细胞表达ALP的情况。检测ALP总量发现, 在6 μ g/L rhTGF-β 1的作用下细胞表达ALP总量明显升高, 差异有统计学意义(图4A)。为了排除细胞数量增多引入的ALP含量升高, 采用BCA法提取细胞总蛋白, 结果显示6 μ g/L rhTGF-β 1组总蛋白含量较对照组升高, 间接反映了细胞数量增加(图4B)。将每组ALP含量除以总蛋白比值计算相对ALP活性, 显示6 μ g/L rhTGF-β 1组相对对照组提高了6倍, 差异有统计学意义(P< 0.05, 图4C)。
在牙髓干细胞矿化诱导体系中, 加入6 μ g/L rhTGF-β 1, 连续培养14 d后行茜素红染色, 与对照组相比形成的矿化结节数量增加, 着色程度加深。染色液洗脱后, 采用酶标仪测定光密度值进行比较, rhTGF-β 1组洗脱液光密度值较溶剂对照组升高(图5)。
TGF是调控细胞生长的肽类物质之一, 可由体内诸多细胞产生, 具有重要的生理病理和治疗作用, 迄今所分离的TGF主要分为TGF-α 和TGF-β 。TGF-α 主要在创伤愈合中发挥作用, 介导上皮和组织结构发生。TGF-β 家族在牙齿发生中是成牙本质细胞分化和牙本质基质生成中的重要信号分子, 通常由成牙本质细胞分泌, 沉积于牙本质基质中, 具有抗炎、促进创伤愈合、抑制巨噬细胞和淋巴细胞增殖的作用, 可促进牙髓组织矿化, 作用机制是与受体结合导致胞内信使如Smad-2、3 磷酸化, 从而引起一系列的信号传导。TGF-β 主要有1~3 三种分型, 其中与成牙本质细胞分化和牙本质基质形成密切相关的是TGF-
本文主要研究临床上易于获取、组织量大的人健康第三磨牙DPSCs在rhTGF-β 1诱导条件下的增殖和分化作用, 通过CCK-8法得出6 μ g/L rhTGF-β 1在体外对牙髓干细胞具有促进增殖的作用, 与Li等[5]的研究未能促进鼠牙髓细胞增殖结果不同, 这可能是细胞来源不同所致。
成牙本质细胞的主要功能是形成牙本质, ALP是参与骨等矿化组织代谢和再生的重要物质, 它在硬组织形成中可促进钙化, 成牙本质细胞具有较高的ALP水平, ALP表达是牙髓细胞向成牙本质细胞分化的指标。本文结果显示, 6 μ g/L rhTGF-β 1诱导DPSCs 7 d后细胞中碱性磷酸酶总量明显上升, 细胞中总蛋白含量相应增加(BCA法), 这是细胞增殖的结果。为了排除细胞增殖的影响, 计算ALP相对含量结果显示, rhTGF-β 1诱导后细胞表达ALP能力显著增加, 差异有统计学意义(P< 0.05), 提示rhTGF-β 1诱导了细胞的成牙本质分化。
牙髓细胞在体外培养诱导分化时, 首先形成细胞结节, 继而矿化形成矿化结节, 经检测这种矿化结节主要为牙本质样的矿化基质, 具有牙本质的特性, 因此, 矿化结节的出现在某种程度上表明了牙髓干细胞的存在, 并作为牙髓细胞向成牙本质细胞分化的标志。本研究茜素红染色的结果也表明, rhTGF-β 1提高了干细胞的体外矿化能力, 表现为矿化结节形成量多于对照组, 与Li等[5]的结果一致, 提示rhTGF-β 1具有促进牙髓干细胞矿化的作用。
本研究分离培养的牙髓细胞具有干细胞的特性, rhTGF-β 1作为细胞分化的重要生长因子, 可促进牙髓干细胞体外增殖和成牙本质分化。生长因子是组织工程学研究中的一个重要部分, 后续研究利用rhTGF-β 1的这一性能, 能够更好地应用于牙齿硬组织再生和牙髓再生。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|