目的 探讨类风湿关节炎(rheumatoid arthritis,RA)患者髓系来源的抑制细胞(myeloid-derived suppressor cells,MDSC)对自身B细胞增殖的影响,揭示MDSC在RA发病中的作用。方法 健康对照15例,RA患者38例,按28-关节疾病活动度分值(28-joint disease activity score,DAS28)分为高疾病活动度组(DAS28>5.1)、中疾病活动度组(3.2<DAS28≤5.1)和低疾病活动度组(2.6<DAS28≤3.2), 流式细胞术检测其外周血MDSC细胞的比例;同时分选10例高疾病活动度RA患者外周血B细胞和MDSC细胞体外共培养,羟基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester,CFSE)法检测B细胞的增殖。结果 高疾病活动度RA外周血MDSC比例(7.13%±2.17%)相对于健康成年人(4.79%±1.02%)、中活动度患者(5.35%±1.36%)和低活动度患者(4.72%±1.08%)明显增加( P<0.05),而中、低疾病活动度RA之间及其二者与健康成年人之间差异皆无统计学意义( P>0.05);MDSC比例与患者DAS28分值成正相关( P<0.05),与年龄、病程、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸多肽(cyclic citrullinated peptide,CCP)抗体等无相关性;MDSC共培养不抑制反而促进B细胞的增殖( P<0.01)。结论 MDSC在高疾病活动度RA患者外周血中明显增加,与疾病活动度呈正相关,并可在体外促进自身B细胞的增殖,提示MDSC可能通过调节B细胞的功能参与RA的疾病进程。
Objective: To investigate the effect of myeloid-derived suppressor cells (MDSC) on pro-liferation of B lymphocytes in rheumatoid arthritis (RA) patients.Methods: The peripheral blood specimens were collected from 15 healthy adults and 38 RA patients who were divided into high disease activity group, medium activity group and low activity group according to their 28-joint disease activity score (DAS28). And the frequencies of MDSC were determined by flow cytometry. Then, B cells and MDSC were isolated by flow cytometry, respectively. B cells were labeled with carboxyfluorescein diacetate succinimidyl ester (CFSE) and then were co-cultured with MDSC in the presence of 3 mg/L anti-CD40 antibody and 10 mg/L CpG, for 3 days. Flow cytometry was performed to investigate the proliferation of B cells.Results: MDSC expanded markedly in high disease activity patients (7.13%±2.17%) compared with medium (5.35%±1.36%) and low disease activity patients (4.72%±1.08%) or healthy controls (4.79%±1.02%) ( P<0.05), and there were no statistical differences between healthy controls, medium and low disease activity RA ( P>0.05). Moreover, the frequencies of MDSC were positively correlated with the DAS28 ( P<0.05). After co-culture, MDSC significantly promoted B cell proliferation ( P<0.01).Conclusion: Our studies showed that MDSC expanded obviously in high disease activity RA patients, and their frequencies were positively correlated with the disease activities. Furthermore, MDSC could promote autologous B cell proliferation remarkably in vitro. These findings suggest that MDSC might be involved in RA pathogenesis through regulating B cell functions.
类风湿关节炎(rheumatoid arthritis, RA)是一种临床常见自身免疫疾病, 其确切发病机制至今尚未完全阐明[1]。研究表明, B细胞在RA病理过程中具有重要作用。RA患者体内B细胞不仅产生自身抗体, 如类分湿因子(rheumatoid factor, RF)、抗环瓜氨酸多肽(cyclic citrullinated peptide, CCP)抗体等, 还可分泌多种细胞因子参与RA的病理进程[2]。
髓系来源的抑制细胞(myeloid-derived suppressor cells, MDSC)是由髓系前体细胞和未成熟髓细胞组成的异质细胞群, 在肿瘤、炎症和感染中数量明显增加[3, 4]。近年来的研究表明, MDSC在自身免疫病患者体内具有重要作用[5], 但关于MDSC在RA中的确切作用及机制尚不清楚。最近, Guo等[6]研究发现, MDSC在RA中可驱动Th17分化, 具有明显的促炎效应, 但关于MDSC对B细胞功能的作用和影响, 目前尚未见报道。本研究通过分离RA患者MDSC, 观察其在体外对自身B细胞增殖的影响, 旨在探明MDSC在RA中的确切作用, 为进一步阐明RA的病理机制提供实验基础。
选择2014年9月至2015年6月于北京大学人民医院风湿免疫科住院的RA患者, 所有纳入患者均符合ACR1987修订的诊断标准, 并按28-关节疾病活动度分值(28-joint disease activity score, DAS28)评分分为高疾病活动度组(DAS28> 5.1)、中疾病活动度组(3.2< DAS28≤ 5.1)和低疾病活动度组(2.6< DAS28≤ 3.2), 选择15名健康志愿者作为对照组。血液标本为无菌采集的清晨空腹静脉血, 乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)钠盐抗凝。本研究通过北京大学人民医院医学伦理委员会审批(2016PHB169), 并获得所有患者和志愿者的知情同意。
鼠抗人CD40抗体, 荧光标记的鼠抗人CD19(APC-cy7标记)、CD33(PE标记)、CD11b(PerCP-eFluor710标记)抗体均购自美国Ebioscience公司; RPMI-1640培养基、胎牛血清(fetal bovine serum, FBS)与细胞羟基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester, CFSE)增殖试剂盒购自美国Life Technology公司; CpG寡聚脱氧核苷酸(CpG-oligodeoxynucleotides, CpG-ODN)由生工生物工程有限公司(上海, 中国)合成; 红细胞裂解液和4%(质量分数)多聚甲醛(paraformaldehyde, PFA)购自杭州联科生物技术股份有限公司(杭州, 中国); OlympusIX71倒置显微镜由Olympus株式会社制造; 流式细胞仪FACSAria Ⅱ 由美国BD公司制造。
取新鲜血样125 μ L, 分别加入5 μ L荧光标记的抗人CD33、CD11b抗体, 避光, 室温摇床震荡孵育30 min后, 加入红细胞裂解液至2 mL, 混匀, 避光, 室温静置10 min; 1 800 r/min离心5 min, 倒掉上清, 加磷酸盐缓冲液(phosphate buffered saline, PBS)2 mL悬浮, 1 800 r/min离心5 min, 洗涤1次, 倒掉上清, 加300 μ L含2%(质量分数)PFA的PBS溶液固定, 流式细胞仪检测CD11b+CD33+细胞比例。
收集10例高疾病活动度RA患者新鲜抗凝血进行分选。加入荧光抗体CD19、CD33和CD11b, 避光, 室温摇床震荡孵育30 min; 加入红细胞裂解液, 避光室温静置10 min; 1 800 r/min离心5 min, 倒掉上清, 然后加生理盐水, 1 800 r/min离心5 min, 洗涤1次, 小心吸去上清; 细胞沉淀用分选液[含2%(体积分数)FBS的PBS]悬浮过滤; 流式分选细胞, 其中B细胞通过CD19阳性鉴定, 而MDSC则通过CD11b和CD33双阳性鉴定。采用最高纯度模式, 同步分选收集两种细胞。
CFSE标记B细胞:分选细胞经1 800 r/min离心8 min后收集, MDSC细胞4 ℃保存待用。B细胞则加入适量37 ℃预热的专用悬浮液悬浮, 使细胞浓度为1× 106/mL, 按1× 106个细胞/2 μ L加入CFSE, 混匀, 37 ℃孵育10 min, 加5倍体积冰冷的无血清RPMI-1640混匀以终止反应, 混合液冰育5 min, 1 800 r/min离心5 min, 去上清, 加5倍体积无血清RPMI-1640培养基, 按上述方法离心洗涤两次, 收集细胞备用。
共培养:标记好的B细胞用适量完全RPMI-1640培养基液悬浮, 细胞计数, 然后调整浓度为1× 106/mL。MDSC则用适量完全培养基液悬浮, 使其浓度为5× 105/mL。取圆底96孔细胞培养板, 单独组加入1× 105个B细胞(100 μ L)和100 μ L完全培养基, 共培养组则加入1× 105个B细胞(100 μ L)和5× 104个MDSC细胞(100 μ L)。然后每孔分别加适量CD40抗体(3 mg/L)和CpG-ODN(10 mg/L), 封口膜绑定, 于37 ℃ 5%(体积分数)CO2中培养3 d待用。每天倒置光学显微镜下观察, 拍照。另外, 留取适量标记的B细胞作对照。
培养结束后收集细胞于流式管, 1 800 r/min离心5 min, 弃上清, 细胞沉淀100 μ L PBS悬浮, 加3 μ L 荧光标记的CD19抗体, 室温孵育30 min, 中间振荡1次, 然后加2 mL PBS, 1 800 r/min离心5 min, 洗涤1次, 细胞沉淀用300 μ L含2%(质量分数)PFA的PBS悬浮, 固定, 流式细胞仪检测。
所有实验数据均采用SPSS 20.0软件进行分析处理, 检测结果以± s表示。健康正常人和RA患者MDSC比例差异采用One-way ANOVA分析, 组间两两比较采用LSD法; MDSC比例与RA患者临床指标的相关性采用Pearson分析(双侧检验); B细胞单独培养和共培养组间比较采用paired-t检验, 以P< 0.05为差异有统计学意义。
RA患者共计38例, 其中女性32例、男性6例; 年龄19~79岁, 平均(56.61± 13.73)岁; 病程0.25~30.00年; DAS28评分4.7± 1.8; 红细胞沉降率(erythrocyte sedimentation rate, ESR)4~107 mm/h, 平均(45.8± 32.7) mm/h; C反应蛋白(C-reaction protein, CRP)1.97~81.90 mg/L, 平均(36.72± 63.87) mg/L。健康志愿者15例, 其中女性9例、男性6例; 年龄20~35岁, 平均(24.80± 4.31)岁(表1)。
| 表1 RA患者和健康对照的临床特征 Table 1 Clinical characteristics of the healthy controls and RA patients |
流式细胞检测显示, 健康成年人和RA患者外周血MDSC比例存在明显差别(P< 0.001); 高疾病活动度RA患者外周血MDSC比例为7.13%± 2.17%, 相对于健康成年人(4.79%± 1.02%)显著增加(P< 0.05), 也明显高于中活动度(5.35%± 1.36%)和低活动度患者(4.81%± 1.03%)(P< 0.05); 而中、低活动度患者之间及其二者与健康成年人之间差异均无统计学意义(P> 0.05, 图1)。
相关性分析结果显示, MDSC比例与疾病活动度成正相关(P< 0.05), 但与患者年龄、病程、RF、抗CCP抗体等无相关性(表2)。
| 表2 MDSC比例与RA患者临床指标的相关性 Table 2 Correlation of MDSC frequencies with RA patient clinical manifestations |
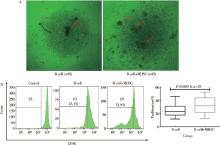
光学显微镜下观察发现, B细胞单独培养和共培养(B细胞+MDSC)皆有增殖克隆出现, 但共培养增殖克隆明显多于单独培养(图2A)。流式细胞仪检测结果显示, 单独组和共培养组皆有细胞增殖, 但共培养组增殖显著高于单独组(P< 0.01), 即MDSC明显促进B细胞增殖(图2B)。
RA是一种慢性、进行性的自身免疫疾病, 多发于中老年女性, 其发病率和致残率高, 而发病机制至今尚未完全清楚[1]。大量研究表明, 各种先天和后天因素所致的免疫异常, 致使自身耐受破坏, 是RA发病的关键所在。而B细胞作为免疫系统的组成成分, 在RA病理过程中具有重要作用[2], 临床采用B细胞清除疗法(B cell depletion therapy, BCDT)治疗RA具有肯定疗效, 从反向确证了B细胞的病理作用[7]。
MDSC 1987年发现于荷瘤小鼠[8], 其免疫功能近年来被重新认识。MDSC不仅可抑制T细胞应答, 促进肿瘤的发生、发展, 在生理或病理条件下, 还具有重要的免疫调节作用[3, 4]。近来研究发现, MDSC参与了自身免疫病的病理进程[5]。最近有研究报道, 在RA中MDSC可驱动Th17分化, 产生促炎作用[6], 但关于RA中MDSC与B细胞间的相互作用, 目前尚不清楚。
本研究首先检测了健康成年人和RA患者外周血中MDSC的比例, 结果显示, 高疾病活动度患者的MDSC比例显著高于健康人和低疾病活动度患者, 这与许为民等[9]的研究结果一致。进一步的相关性分析发现, MDSC比例与RA的疾病活动度成正相关, 而与年龄、病程、RF、抗CCP抗体等无相关性, 提示MDSC可能参与RA的病理进程。我们从RA患者外周血分选出B细胞和MDSC, 添加抗人CD40抗体和CpG作为刺激剂进行共培养, 观察在体外MDSC对B细胞增殖的影响。镜下的观察结果和流式细胞检测结果皆显示, MDSC共培养可显著促进B细胞增殖。而Li等[10]在实验性重症肌无力研究中发现, 肝星细胞诱导的MDSC能够明显抑制B细胞的增殖, 最近Crook等[11]在胶原诱导的关节炎(collagen-induced arthritis, CIA)模型鼠的研究中发现, 单核细胞型MDSC可抑制CD40L与白细胞介素4(interleukin 4, IL-4)共同诱导的B细胞增殖, 而粒细胞型MDSC作用则相反。这两者的研究结果皆与本实验存在差异, 分析其原因, 可能是我们使用的是RA患者来源的总MDSC, 而前者的MDSC是正常小鼠骨髓细胞诱导而成, 后者仅用单核细胞型MDSC, 也可能是人鼠物种不同或刺激试剂差异所致, 确切原因有待后续探讨。
本研究显示, MDSC在高疾病活动度RA患者外周血数量明显增加, 并与疾病活动度呈正相关, 且在体外可显著促进自身B细胞增殖, 提示MDSC可能是RA的病理因子, 通过促进B细胞功能, 加重RA的发病。但关于MDSC与B细胞相互作用的机制, 以及MDSC在RA发病中的确切作用, 还有待进一步的研究阐明。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|