目的 探究肿瘤来源的IgG是否对T细胞活化具有抑制作用。方法 首先从卵巢癌肿瘤组织纯化了肿瘤来源的IgG(tumor derived IgG, tIgG),并从脐带血中分离出单个核细胞(cord blood mononuclear cells,CBMC)及淋巴细胞(cord blood lymphocyte,CBL),用植物血球凝集素(phytohaemagg lutinin,PHA)刺激单个核细胞和淋巴细胞,使单个核细胞与淋巴细胞处于增殖状态,用荧光染料羟基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein succinimidyl amino ester,CFSE)染色,CFSE对细胞无毒性,可以穿透细胞膜,在活细胞内与胞内蛋白结合,其荧光强度会随着细胞的分裂增殖而逐级递减,从而可以检测细胞增殖的情况。把从卵巢癌肿瘤组织中纯化得到的tIgG分为1 mg/L、10 mg/L和100 mg/L组,分别加入到单个核细胞和淋巴细胞中,静脉注射用免疫球蛋白(intravenous immunoglo-bulin,IVIG)作为阳性对照,也分为1 mg/L、10 mg/L和100 mg/L组,磷酸缓冲盐溶液(phosphate buffer saline,PBS)作为阴性对照,用细胞流式术检测CD4+及CD8+ T细胞的增殖能力,并分别在64 h和86 h两个时间点检测细胞的增殖情况。结果 在CBMC体系中加入的tIgG可以明显地抑制CBMC中T细胞的增殖,发挥免疫抑制作用;同样,在CBL体系中加入的tIgG对T细胞也有抑制作用,且加入tIgG刺激的T细胞比加入IVIG刺激的T细胞的抑制增殖作用更强;在CBL体系中,tIgG的1 mg/L组和10 mg/L组对T细胞发挥的抑制增殖作用比100 mg/L组弱。结论 tIgG可以抑制T细胞的增殖,促使肿瘤发挥肿瘤免疫逃逸效应。
Objective: To explore the function of tumor derived IgG (tIgG) and whether the tIgG can inhibit T cells activity.Methods: The tIgG was purified from ovarian cancer tissue. The cord blood monocyte cells (CBMC) and cord blood lymphocyte (CBL) were isolate from human umbilical cord blood. The CBMC and CBL were stimulated with phytohaemagg lutinin (PHA) in order to let the CBMC and CBL in the state of proliferation. Carboxyfluorescein succinimidyl amino ester (CFSE) was cultured with CBMC and CBL. CFSE had no cell toxicity, which could penetrate through the cell membrane and combine the intracellular protein. The fluorescence intensity decreased with the proliferation of cells step by step, so the proliferation of these cells could be detected in flow ctytometry. The tIgG which was purified from ovarian cancer tissue was divided into three groups, 1 mg/L group, 10 mg/L group, and 100 mg/L group, and the intravenous immunoglobulin (IVIG) was also divided into three groups too. The CBMC and CBL were treated by tIgG with 1 mg/L, 10 mg/L, and 100 mg/L in order to observe the proliferation of T cells. The cells were treated with IVIG as a positive control group, and the cells were treated with phosphate buffer saline (PBS) as a negative control. The proliferation of CD4+ or CD8+ T cells were detected in CBMC and CBL. The proliferation of the T cells in CBMC and CBL after 64 h and 86 h were detected.Results: In the system of CBMC, the tIgG could suppress the proliferation of CD4+ or CD8+ T cells. The results could also be found in the system of CBL. The CD4+ or CD8+ T cells in the group which were treated with PBS were more active than those in the group which were treated with tIgG and IVIG. The suppression in the group which were treated with tIgG, was stronger than that in the group treated with IVIG. In addition, the suppression of T cells in the group which were stimulated with tIgG as 100 mg/L was more effective than that in the group which were stimulated with tIgG as 10 mg/L. This could prove that tIgG had the function of immunomodulation.Conclusion: The tIgG can be involved in immune escape of cancer.
免疫球蛋白(immune globulin, Ig)是生物体内重要的生物大分子, 可分为不同的类别以及不同的亚类, 在生物体内发挥不同的功能, 其中, IgG是体内含量最多的Ig分子, 一直被认为行使抗体的活性。IgG的可变区可以识别抗原, 通过恒定区激活补体, 发挥补体介导的细胞毒作用(complement dependent cytotoxicity, CDC), 也可以与树突状细胞(dendritic cells, DC)、巨噬细胞以及自然杀伤细胞(natural killer cell, NK)表面的Fc受体结合, 介导抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC), 在获得性免疫应答的过程中发挥最为重要的免疫防御作用[1]。
静脉注射用免疫球蛋白(intravenous immunoglobulin, IVIG)是从1 000人份血清中纯化得来的IgG, 原本主要用于免疫缺陷病的治疗, 以代替患者缺失的IgG。然而, 近年来发现, IVIG具有免疫负性调控作用, 即可以抑制T淋巴细胞的活化及增殖, 故更多地被用于治疗炎症及自身免疫性病[2]。
本组的前期研究工作表明, 多种肿瘤细胞都可以高水平产生IgG, 并在肿瘤组织中大量沉积[3]; 肿瘤来源的IgG可以促进肿瘤细胞的增殖、生存、发生及转移[4]。本研究的目的是探讨肿瘤来源的IgG是否也具有免疫抑制效应, 并可能参与肿瘤免疫微环境的维持。我们从卵巢癌肿瘤组织中提取及纯化出肿瘤来源的IgG, 以IVIG作为对照, 探讨肿瘤来源的IgG对脐带血中T细胞的免疫抑制效应。
脐带血由北京积水潭医院妇产科提供, 卵巢癌肿瘤组织由北京大学人民医院妇产科提供, 所有患者均已签署书面知情同意书。
人淋巴细胞分离液购自上海华精高科技有限公司, RPMI 1640培养基购自Invitrogen公司, 胎牛血清购自HyClone公司, 植物血球凝集素(phytohae-magg lutinin, PHA)及羧基荧光素二醋酸盐琥珀酰亚胺酯[5(6)-carboxyfluorescein diacetate N-succinimi-dyl ester, CFSE]购自Sigma公司。
荧光素标记抗体PE-抗人CD4、PE-抗人CD-206、PerCP/Cy5.5-抗人CD8均购自eBioscience公司, FITC-抗人CD33购自美国BD公司。
蛋白纯化相关试剂Protein G购自GE公司, 透析袋购自Pierce公司, 超滤管购自Millipore公司。
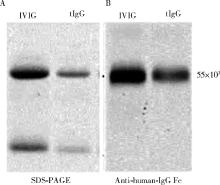
把肿瘤组织在液氮中研磨至粉末, 用RIPA裂解液[50 mmol/L Tirs pH=7.4, 150 mmol/L NaCl, 1%(体积分数)Triton X-100, 1%(体积分数)sodium deoxycholate, 0.1%(体积分数)十二烷基硫酸钠(sodium dodecyl sulfate, SDS)]室温裂解2 h, 超滤, 4 ℃ 20 000 r/min离心20 min, 取上清液, 用磷酸缓冲盐溶液(phosphate buffer saline, PBS)稀释至原溶液体积的4倍, 与protein G 4 ℃孵育过夜, 之后穿过液自然流出, 用100~200 mL的PBS洗涤, 洗至基线, 再用0.1 mol/L甘氨酸-盐酸缓冲液(pH=2.4)洗脱, 洗脱下的IgG立即以0.1 mol/L Tris-盐酸(pH=9.0)中和至pH 7.0左右。得到的IgG蛋白超滤浓缩, 加入20%(质量分数)的麦芽糖(质量浓度为1 g/L), 保存于-20 ℃。
十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)及Western blot方法分析纯化IgG的纯度, 蛋白样品在10%(质量分数)的SDS-PAGE中分离, 之后电转移至硝酸纤维素膜上, 用5%(体积分数)牛血清白蛋白(bovine serum albumin, BSA)室温封闭2 h, 然后用抗人IgG抗体进行检测。
把脐带血用RPMI-1640培养基稀释至原溶液体积的2倍后, 加在淋巴细胞分离液上, 采用密度梯度离心法从脐带血中分离出CBMC(2 000 r/min, 制动调整为0, 离心20 min)。得到的CBMC用含有10%(体积分数)FBS的RPMI-1640培养基重悬, 在37 ℃, 5% (体积分数)CO2恒温培养箱中培养 12 h。用吸管吸取出上层悬浮细胞(未贴壁的细胞), 此为脐带血淋巴细胞(cord blood lymphocyte, CBL)。
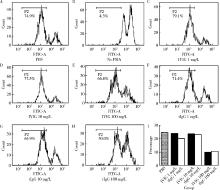
得到的细胞在96孔培养板中培养, 每个孔含有2.5× 105个细胞和200 μ L含有10%FBS的RPMI-1640培养基。用1 g/L的PHA刺激培养细胞, 每个体系加入15 μ g, 刺激CBMC或淋巴细胞的增殖。
待测细胞用含有5% FBS的PBS洗两次, 重悬成0.5× 106~5× 106/mL, 取1 mL细胞悬液待用, 在110 μ L的PBS中加入0.55 μ L CFSE(5 mmol/L), 并快速加入1 mL细胞悬液中, 混匀, 避光室温染色5 min后立即加入10倍体积的含有5% FBS的PBS中洗3次, 得到CFSE染色完毕的待测细胞, 分别在不同的时间点收取细胞用流式细胞仪检测CFSE阳性峰的变化。
收集待测细胞制备为单细胞悬液, PBS洗涤两次后, 加入合适剂量的荧光标记的不同膜分子抗体, 混匀, 4 ℃孵育40 min, 1 mL PBS洗涤1次, 用BD Calibur 流式细胞仪检测荧光信号。
对通过亲和层析的方法富集得到的肿瘤来源IgG进行Western blot和SDS-PAGE检测, 验证IgG的纯度和特异性, 以IVIG作为阳性对照, 如图1所示。
分离得到CBMC并用PHA刺激淋巴细胞的增值, 将不同质量浓度的肿瘤来源IgG(1 mg/L、10 mg/L和100 mg/L)分别加入培养体系中, 64 h后检测CD8+及CD4+T细胞的增殖能力。结果发现, 当用10 mg/L及100 mg/L的肿瘤来源IgG处理后, CD8+、CD4+T细胞及细胞增殖能力都明显降低, 并且肿瘤来源IgG的抑制作用强于IVIG(图2)。
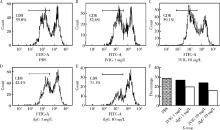
对分离的CBMC培养24 h后收取悬浮细胞, 除去大部分贴壁的单核细胞, 得到高比例的CBL。再次进行培养, 并用PHA刺激, 在CFSE染色后, 用不同质量浓度的肿瘤来源IgG刺激, 64 h后检测其增殖的情况, 结果发现, 在去除大部分单核细胞的情况下, 肿瘤来源IgG对CBL中的T细胞也有抑制增殖的作用, 其作用比IVIG更强(图3)。
非B细胞表达的Ig最初就是从上皮性肿瘤细胞获得的。本课题组以往发现Ig可以在肿瘤组织中(如乳腺癌、大肠癌、肝癌)高表达[5]。其他研究也报道了卵巢癌、胃癌等肿瘤组织存在大量的Ig, 并可以分泌IgG分子[6, 7]。目前认为IgG在脊椎动物的免疫系统中发挥最为广泛的作用, 那么恶性肿瘤中高表达的Ig在肿瘤微环境中发挥什么样的作用呢?结合IVIG在临床上作为IgG分子发挥免疫抑制作用的报道, 我们提出假设, 肿瘤来源IgG也能发挥免疫抑制作用。
本研究对肿瘤来源IgG抑制淋巴细胞的增殖效应进行了检测。首先分离纯化了肿瘤组织中的IgG, 并检测了其纯度及特异性, 随后用不同浓度的肿瘤来源的IgG作用于经过PHA刺激、CFSE染色的脐带血单个核细胞, 64 h后检测其增殖的情况, 结果显示, IVIG组和肿瘤来源IgG组中的CD4+T细胞和CD8+T细胞的增殖都受到了明显的抑制。值得说明的是, 本研究中IVIG给予的剂量并不像临床上的大剂量使用(临床IVIG用量为1~3 g/kg体重), 因而IVIG在本研究中的抗炎作用并不如以往研究报道中的那样显著[8], 但是, 在同样低剂量的情况下, 肿瘤来源的IgG对T淋巴细胞却有更强的抑制效果, 说明肿瘤组织中的IgG可能发挥更强的免疫抑制功能。
同时, 本研究还检测了肿瘤来源的IgG对CBL中T细胞的增殖抑制情况。当把脐带血单个核细胞中的大部分髓系来源的单核细胞去掉以后, 发现肿瘤来源的IgG对CBL中的T细胞也有抑制作用, 并且这种抑制作用比脐带血中含有髓系来源的单核细胞的混合体系更强, 提示肿瘤来源的IgG可能是通过淋巴细胞发挥免疫抑制作用的。
在以往对IVIG的T细胞增殖抑制效应机制的研究中, 普遍认为IVIG对T细胞的增殖是通过抑制DC的活化和抗原呈递功能实现的[9, 10, 11]。当培养体系去除DC或者单核细胞后, IVIG对T细胞的增殖抑制作用就消失了。
然而, 近年来已有报道指出, IVIG可以抑制有丝分裂原刺激的T细胞的增殖[12], 同时, IVIG也可以通过抑制IL-2的表达直接抑制T细胞的增殖[13, 14], 此外, IVIG还可直接促进Treg细胞的扩增, 并促进其分泌抑制性效应分子。目前认为发挥作用的主要是IgG的Fc段中含有Treg表位, 其能活化Treg细胞, 进而抑制T细胞[15, 16]。本研究比较了肿瘤来源的IgG对存在髓系单核细胞和没有髓系单核细胞的培养体系中T细胞的作用, 意外发现, 在没有髓系单核细胞的培养体系中, 肿瘤来源的IgG也可以明显抑制CD4+和CD8+T细胞的增殖, 为进一步发现肿瘤免疫逃逸机制提供了新的视野。
综上所述, 肿瘤来源的IgG对T淋巴细胞具有免疫抑制作用, 并且其抑制作用比IVIG更强。目前, 肿瘤来源的IgG抑制T细胞增殖的具体分子机制尚不清楚, 根据IVIG有关抗炎活性的报道, 肿瘤来源IgG的高唾液酸化[17, 18]可能是IVIG发挥抑炎作用的主要因素, 同时, 肿瘤来源IgG的亚型分类是否与正常IgG的亚型分类相同, 以及各亚型分类所含的比例是否相同都是未来有待研究的问题。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|