目的 探讨以NY-ESO-1为靶抗原、树突状细胞(dendritic cell, DCs)为抗原载体激发特异性细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)反应的能力,以明确特异性CTLs的抗肿瘤免疫功能。方法在临床前实验基础上选择2014年11月至2015年10月于中国医学科学院肿瘤医院治疗的符合入选标准的15例Ⅱ~Ⅲ期HLA-A0201+NY-ESO-1+胃癌患者外周血,分离单个核细胞 (peripheral blood mononuclear cells, PBMCs) 和外周血淋巴细胞(peripheral blood lymphocytes, PBLs), 并诱导出成熟DCs (mature dendritic cell, mDCs);将人工合成的NY-ESO-1多肽负载mDCs后通过流式细胞仪(flow cytometry,FCM)分析细胞表型,检测体外反复致敏PBLs后负载NY-ESO-1的DCs激发特异性CTLs的能力以及CTLs对NY-ESO-1+胃癌细胞的体外杀伤活性,同时患者回输CTLs细胞,每2周1次,共回输2次,检测回输前后患者外周血细胞因子和特异性CTLs水平变化。结果采用FCM分析DCs细胞表型显示HLA-DR+CD11c+细胞为93.6%±1.2%,其中CD80+细胞为87.3%±3.6%,CD83+细胞为82.8%±2.5%,CD86+细胞为93.4%±6.4%。患者外周血分离的PBLs经NY-ESO-1多肽负载的DCs反复诱导后,细胞不断增殖,其中未负载多肽的DCs也能促进PBLs增殖,但细胞增殖指数(proliferation index, PI)明显低于负载多肽的DCs,两者比较差异有统计学意义( P<0.05)。负载NY-ESO-1多肽DCs诱导的NY-ESO-1多肽特异性的CTLs比例较未负载NY-ESO-1多肽DCs诱导的对照组明显升高(5.2%±1.2% vs. 0.4%±0.1%, P<0.05),且致敏后CTLs对NY-ESO-1+胃癌细胞及负载NY-ESO-1+多肽T2靶细胞的杀伤率明显高于对照组。输注CTLs细胞后,患者体内血清中细胞因子IFN-γ、IL-2、IL-12水平较治疗前显著升高[(132.9±10.2) μg/L vs. (46.4±3.1) μg/L; (101.3±6.4) μg/L vs. (26.7±1.2) μg/L; (51.3±2.6) μg/L vs. (26.4±1.1) μg/L; P均<0.05],且患者外周血特异性CTLs细胞比例明显升高。结论 负载NY-ESO-1多肽的DCs体内外均具有激发特异性CTLs反应的能力,可诱导明显的抗肿瘤免疫效应。
Objective: To explore the potential of autologous dendritic cells (DCs) pulsed with caner/testis antigen NY-ESO-1 peptides in inducing specific cytotoxic T lymphocyte (CTLs) response and antineoplastic immune function of specific CTLs.Methods: Fifteen patients with Ⅱ to Ⅲ stage positive HLA-A0201+ and NY-ESO-1+were enrolled in the Cancer Hospital Chinese Academy of Medical Sciences on the basis of preclinical experiments from November 2014 to October 2015, and their peripheral blood mononuclear cells (PBMCs) and peripheral blood lymphocytes (PBLs) were isolated. The PBMCs were induced into DCs and pulsed with NY-ESO-1 peptide. The phenotypes of DCs were stained with antibodies against HLA-DR+CD11c+,CD80+,CD83+ and CD86+, and subsequently analyzed by multichannel flow cytometry (FCM). The killing effects of CTLs pulsed with HLA-A0201-binding peptide NY-ESO-1 and the potential of autologous DCs pulsed with NY-ESO-1 peptides in inducing specific cytotoxic T lymphocytes (CTLs) responses were determined. The patients were administered two infusions of auto-logous CTLs for 1 time every two weeks. The total infusion was with 2 times. The immunological responses and clinical responses were examined in 1 week after the final administration.Results: The immunophenotype of DCs pulsed with NY-ESO-1 peptide was analyzed, HLA-DR+CD11c+ cells (93.6%±1.2%), CD80+ cells (87.3%±3.6%), CD83+cells (82.8%±2.5%) and CD86+ cells (93.4%±6.4%). PBLs isolated from patients primed by DCs pulsed with NY-ESO-1 peptide proliferated continuously and the proliferation index (PI) of the PBLs were analyzed. There was significant difference between the DCs loaded with polypeptides and those unloaded, though it could promote the proliferation of PBLs, but the PI was significantly lower than that of the DCs loaded with NY-ESO-1 peptide ( P<0.05). The average percentage of special CTLs primed by DCs pulsed with NY-ESO-1 peptides was significantly higher than that in the control group (5.2%±1.2% vs. 0.4%±0.1%). CTLs induced by NY-ESO-1 pulsed DCs exerted a stronger killing effect on T2 cell line pulsed with NY-ESO-1 peptide than that in the control group at the ratio of E (effect) to T (target) as 30︰1, P<0.05. The cytokine levels in the patients’sera such as IFN-γ, IL-2 and IL-12 were increased after treatments [(132.9±10.2) μg/L vs. (46.4±3.1) μg/L; (101.3±6.4) μg/L vs. (26.7±1.2) μg/L; (51.3±2.6) μg/L vs. (26.4±1.1) μg/L; all P<0.05], and the percentages of antigen-specific CD8+IFN-γ+ increased in these patients ( P<0.01).Conclusion:Auto-DCs pulsed with NY-ESO-1 peptides can induce the proliferation of allogenic CTLs, which elicit specific immune responses ex vivo or in vivo, and boost anticancer immunity markedly.
胃癌是对人类健康与生命危害最大的恶性肿瘤之一, 我国胃癌患者诊断时85%处于晚期[1] , 手术、化疗等传统治疗方法虽有一定效果, 但60%的患者术后会出现局部复发和转移[2], 其5年生存率仅为25%[3], 因此寻求综合抗肿瘤治疗途径, 以延长进展期胃癌患者的生存期, 改善其生存质量, 具有非常积极的意义。目前, 随着分子生物学和医学免疫学的迅速发展, 肿瘤的免疫治疗逐渐引起人们的关注, 成为继手术、化疗、放疗后第4种治疗方案, 并发展成为当前最具潜力的治疗方法之一, 特别是以树突状细胞(dendritic cells, DCs)为基础的抗肿瘤免疫治疗可以增强机体免疫力及抗肿瘤能力, 尤其对术后化疗并发症、不良反应等具有综合治疗效果[4, 5]。
肿瘤抗原New York-esophageal-1(NY-ESO-1)属于癌/睾丸抗原(cancer/ testis antigen, CT), 相应基因称之为CT基因, 即这些基因在多种肿瘤和正常睾丸中均有表达, 而在其他正常组织中基本不表达。NY-ESO-1 是目前已知的CT 抗原中免疫原性最强的抗原, 不仅在患者体内诱发体液免疫, 还可引起较强的细胞免疫应答[6, 7], 且随着疾病发展而表达率升高。目前, 对包括NY-ESO-1在内的这类CT抗原在黑色素瘤[8] 、肺癌[9] 、肝癌[10] 、乳腺癌[11, 12]中的表达情况进行了广泛研究, Mashino等[13]也报道了部分CT 抗原在胃癌中的表达, 免疫性最强的NY-ESO-1抗原在一定比例的胃癌组织中表达, 激发患者自身体液免疫反应, 并与其临床高度恶性行为密切相关, 是一类理想的肿瘤免疫治疗候选抗原。DCs作为迄今为止已知的体内功能最为强大的专职抗原递呈细胞(antigen-presenting cell, APC), 能有效地刺激初始T细胞对异型抗原产生免疫应答, 在抗肿瘤免疫中发挥重要作用[14]。鉴于DCs在机体免疫防御系统中所处的核心作用, 基于DCs开发的抗肿瘤细胞免疫治疗已成为当前最有希望的肿瘤免疫治疗技术之一。本研究在临床前实验基础上通过采集HLA-A0201+NY-ESO-1+胃癌患者外周血, 用NY-ESO-1+多肽作为抗原负载患者自体单个核细胞制备个体化DCs细胞, 探讨其激发患者特异性细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTLs)反应的能力, 为研制治疗胃癌特异性CTLs提供实验依据。
本研究的实施根据《世界卫生组织人体细胞、组织和器官移植指导原则(草案)》的要求进行, 研究开始前已经中国医学科学院肿瘤医院伦理委员会审查批准(14-112/902), 所有参加研究的患者均签署知情同意书。
患者入选标准:(1)年龄> 18岁; (2)ECOG (eastern cooperative oncology group)体能状态0~1; (3)组织学确诊的胃/胃食管结合部腺癌; (4) 按RECIST (response evaluation criteria in solid tumors)1.1标准有可测量或可评估病灶; (5) 患者HLA-A0201分型均为阳性(流式细胞术); (6) 预期生存≥ 3个月。
排除标准:(1) 重要生命脏器(心、肝、肾)严重功能障碍者; (2) 曾接受过器官移植的患者; (3) 伴有其他恶性肿瘤, 或已发生脑转移的患者; (4) 有自身免疫性疾病史的患者; (5) 处于孕期、哺乳期的患者(育龄妇女需检查妊娠试验); (6)处于急性传染病或慢性传染病活动期; (7) 有明确药物过敏史或属过敏体质者; (8) 使用免疫抑制剂(环孢素A等)或接受其他免疫治疗的患者; (9)4周内接受其他临床试验者。
收集2014年11月至2015年10月入院治疗的符合入选标准的15例Ⅱ ~Ⅲ 期胃癌患者资料, 年龄 45~72岁。所有患者免疫细胞治疗前均经过手术治疗和化疗, 且治疗前心、肝、脑、肾等重要器官功能正常, 无自身免疫性疾病。
RPMI1640培养基和胎牛血清培养液购自美国Gibico公司; 重组人白细胞介素2(recombinant human interleukin-2, rhIL-2)、重组人白细胞介素4(recombinant human interleukin-4, rhIL-4)、重组人白细胞介素7(recombinant human interleukin-7, rhIL-7)、重组人白细胞介素1β (recombinant human interleukin-1β , rhIL-1β )、前列腺素E2(prostaglandin E2, PGE2)、重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor, rhGM-CSF)和重组人肿瘤坏死因子(recombinant human tumor necrosis factor-α , rhTNF-α )购自美国R& D Systems公司; 细胞因子检测试剂盒购自美国R& D Systems公司; 流式抗体CD3、CD8、CD80、CD83、CD86、HLA-DR、CD11c、IFN-γ 等均购自美国BD Pharmingen公司; Cell TrackerTM Fluorescent Probes工作液购自美国Invitrogen公司(货号:C34565); 细胞凋亡试剂盒购自美国BD公司(货号:559763)。淋巴细胞分离液(Ficoll)购自中国医学科学院血液病研究所; NY-ESO-1157-165优势性表位多肽氨基酸序列为SLLMWITQC, 由上海吉尔生化有限公司合成, 纯度为 97.6%。多肽用无热源水溶解, 质量浓度为20 g/L, 分装后-80℃超低温冰箱储存。T2细胞株和人胃癌细胞株SGC-7901均购自美国ATCC公司。
采集15例HLA-A0201+NY-ESO-1+胃癌患者外周血各约80 mL, 参照文献[15]方法进行Ficoll密度梯度离心, 分离并收集外周血单个核细胞(peri-pheral blood mononuclear cells, PBMCs), 用含10%(体积分数)胎牛血清的RPMI1640培养液重悬, 并调整细胞浓度为6× 106/mL, 置于37 ℃、5%(体积分数)CO2培养箱中培养2 h后, 吸取未贴壁细胞即是外周血淋巴细胞(peripheral blood lymphocytes, PBLs)。将贴壁细胞用含有100 μ g/L的rhGM-CSF和50 μ g/L的rhIL-4 RPMI1640培养基继续培养, 隔天半量换液1次, 第5天收获未成熟DCs(immature dendritic cells, imDCs), 加入终质量浓度为 20 μ g/L rhIL-1β 、5 μ g/mL PGE-2、20 μ g/L TNF-α 诱导DCs成熟, 收获成熟DCs后, 调整细胞密度为1× 106/mL, 加入NY-ESO-1157-165多肽至终质量浓度为10 mg/L, 共孵育4 h后收获负载NY-ESO-1+多肽的成熟DCs。按照《中华人民共和国药典》2005年版(生物制品)规定的方法进行细菌、病毒、内毒素及支原体检测。
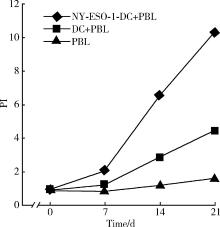
参照文献[16], 采用Ficoll常规分离单核细胞时, 吸取的PBLs用培养液调整细胞密度为1× 107个/mL, 按照DCs与PBLs数量比为1︰25的比例混合培养, 并分为3个组:(1)负载NY-ESO-1多肽DCs+PBLs组; (2)未负载NY-ESO-1多肽DCs+PBLs组; (3)空白对照组(无DCs):单独PBLs组。于培养液中加入500 IU/mL rhIL-2和50 μ g/L rhIL-7, 共孵育1周后进行细胞计数, 第2周同样处理, 期间适当补液并进行扩增, 于培养第0、7、14和21天分别计数混合淋巴细胞数量, 计算细胞增殖指数(proliferation index, PI): 收集细胞(每组> 1× 106), 分别用D-hanks液离心(1 500 r/min, 5 min)洗涤2遍, 70%(体积分数)乙醇(4 ℃预冷)固定细胞, Rnase酶消化。在4 ℃冰箱加入溴化丙啶1 mL染色30 mim, 以500目铜网过滤, 使样品呈单细胞悬液后, 采用流式细胞仪对细胞的DNA进行定量分析, 再结合 Multicycle AV分析软件对DNA细胞周期拟合分析, 计算出DNA组方图各时相分布的百分比, 以 PI表示细胞的增殖活性。
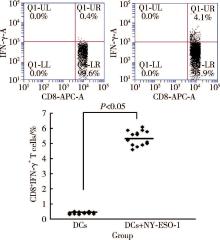
根据BD公司CD8+IFN-γ +T细胞检测试剂盒操作说明书要求, 分别检测NY-ESO-1多肽负载的DCs刺激的CTLs中多肽特异性CD8+IFN-γ +T细胞频率, 未负载多肽DCs刺激的CTLs作为对照。
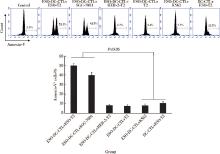
以NY-ESO-1多肽负载T2细胞株作为靶细胞1, NY-ESO-1+的胃癌细胞株SGC-7901作为靶细胞2, 以HER-2多肽负载T2细胞株作为靶细胞3, 以未负载T2细胞株作为靶细胞4, 靶细胞5为K562细胞, 效应细胞1为NY-ESO-1多肽负载DCs致敏的CTLs, 效应细胞2为未负载DCs致敏的CTLs。使用Cell TrackerTM Fluorescent Probes工作液重悬效应细胞, 在效靶比为30 :1时根据凋亡检测试剂盒检测靶细胞(CTG阴性细胞)的凋亡指数(annexin-V+细胞百分比)。
NY-ESO-1多肽负载DCs致敏的CTLs体外培养至第13天时, 经细菌、真菌及内毒素检测阴性后收集细胞, 将收集的细胞用生理盐水离心洗涤2次后, 重悬于200 mL含2%(质量分数)人血白蛋白的生理盐水中, 于第14~16天连续回输3 d, 1次/d, 1.5 h内回输完毕, 每位患者共接受2个疗程免疫细胞治疗。
每次细胞输注治疗后30 min及24 h后观察患者回输后是否出现急性过敏反应, 根据国家《抗肿瘤药物急性与亚急性毒性反应分度分级标准》观察患者是否出现不良反应。治疗开始前1周及治疗结束后1~2周进行临床疗效评价并严密观察不良反应的发生情况。
分别于治疗前及治疗结束后1周采集患者外周血检测患者血清中Th1细胞因子(IFN-γ 、IL-2、IL-12)的水平以及患者体内特异性T细胞免疫应答的激发效应。
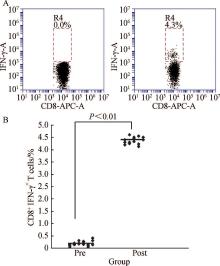
采用人类白细胞抗原(human leucocyte antigen, HLA)-肽四聚体法检测15例患者外周血NY-ESO-1表位特异性细胞毒性T淋巴细胞(CTLs)频率, 取1× 106个PBMC, 用FACS洗液[含10 g/L NaN3及1 g/L 牛血清清蛋白(bovine serum albumin, BSA)PBS缓冲液]洗1次后悬浮于50 μ L FACS洗液中, 加入负载NY-ESO-1157-165多肽-四聚体1 μ g, 以HLA-A错配的肽-四聚体为阴性对照管, 4 ℃避光孵育30 min, 加入10 μ L anti-CD3-PerCP和anti-CD8-FITC, 4 ℃避光孵育30 min, 用FACS洗液洗2次后悬浮于鞘液后上机检测, 计数CD8和四聚体双阳性细胞, 计算其在CD8+T淋巴细胞中所占百分比。
采用SPSS17.0统计学软件, 数据以均数± 标准差表示, 组间比较采用单因素方差分析及t检验, P< 0.05认为差异具有统计学意义。
采用流式细胞仪(flow cytometry, FCM)分析细胞表型显示, HLA-DR+CD11c+细胞为93.6%± 1.2%, 其中CD80+细胞为87.3%± 3.6%, CD83+细胞为82.8%± 2.5%, CD86+细胞为93.4%± 6.4%。按《中华人民共和国药典》2005年版(生物制品)规定的方法进行细菌、病毒、内毒素及支原体检测均为阴性。
患者外周血分离的PBLs经NY-ESO-1多肽负载的DCs反复诱导后, 细胞不断增殖(图1), 其中未负载多肽的DCs也能促进PBLs增殖, 但PI明显低于负载多肽的DCs, 两者比较差异有统计学意义(P< 0.05)。
NY-ESO-1多肽负载DCs激发抗原特异性CD8+IFN-γ +T细胞的扩增, 与未负载NY-ESO-1多肽的DCs对照组激发特异性CD8+IFN-γ +T细胞相比, 差异具有统计学意义[(5.2± 1.2)% vs.(0.4± 0.1)%, P< 0.05, 图2]。
NY-ESO-1多肽负载的DCs体外刺激PBLs 2周后发现, 致敏和未致敏的DCs均能诱导CTLs的产生, 获得的CTLs对负载NY-ESO-1多肽的T2细胞株及表达NY-ESO-1的胃癌细胞株SGC-7901均有明显杀伤作用, 高于对靶细胞K562的杀伤率(P< 0.05), 也高于未负载NY-ESO-1多肽的DCs诱导的CTLs对靶细胞的杀伤率(P< 0.05); 同时也发现NY-ESO-1多肽负载DCs致敏的CTLs对HER-2负载的T2细胞株杀伤能力较弱(图3), 表明NY-ESO-1多肽负载DCs致敏的CTLs具有很强的靶细胞特异性识别和杀伤能力。
在CTLs细胞回输过程中及回输后, 仅有1例患者出现发热, 体温38.2 ℃, 持续时间约3~5 h, 经对症处理后缓解; 未见胸闷、低血压、休克、过敏等不良反应; 未见明显肝、肾功能、凝血功能受损, 显示CTLs细胞治疗是安全的, 无明显毒性作用。
15例患者血清中IFN-γ 、IL-2、IL-12的水平在2个疗程治疗后与治疗前比较呈明显上升趋势[(132.9± 10.2) μ g/L vs. (46.4± 3.1) μ g/L; (101.3± 6.4) μ g/L vs. (26.7± 1.2) μ g/L; (51.3± 2.6) μ g/L vs. (26.4± 1.1) μ g/L; P均< 0.05], 表明CTLs细胞输注后能显著上调患者Th1型细胞因子水平, 明显改善患者免疫功能(图4)。
对15例患者进行了特异性CTLs细胞检测结果显示, 患者体内特异性CTLs频数(图5)及特异性CD8+IFN-γ +T细胞水平较治疗前明显升高(图6)。
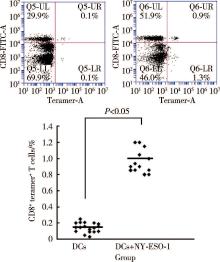 | 图5 白细胞抗原(HLA)-肽四聚体流式细胞术检测患者体内特异性CTLFigure 5 HLA-peptide tetramer/flow cytometry for detecting specific CTL in vivo |
肿瘤抗原NY-ESO-1属于“ 肿瘤特异抗原” CT抗原家族, 在多种肿瘤中广泛表达, 其具有多个表位, 可引起多种肿瘤患者的自发性体液和细胞免疫反应, 由于其强烈的免疫原性已经受到研究者的广泛关注, 在临床诊疗中显现出重要的价值和意义[17, 18, 19] 。目前已知NY-ESO-1 抗原肽有20余种, 多数以HLA-A2 分子递呈的表位为主[20, 21], 而在我国人群中, HLA-A2 阳性人群特别是HLA-A* 0201 亚型人群中占一半以上, 因此NY-ESO-1抗原在我国肿瘤免疫治疗中具有重要的应用价值。目前已在NY-ESO-1抗原中鉴定出3种HLA-A2限制性CD8+T细胞表位, 其中NY-ESO-1157-165优势性表位肽已经用于临床试验[22], 在针对一些肿瘤晚期患者进行免疫治疗的研究发现, NY-ESO-1抗原疫苗对部分转移灶有消退作用, 并发现了该抗原优势性表位NY-ESO-1157-165特异性细胞免疫应答状态与患者的生存率有着密切联系, 且多数的NY-ESO-1抗原表达阳性的胃癌患者可以检测到NY-ESO-1157-165表位特异性CTLs反应[18], 使得特异性针对NY-ESO-1157-165优势性表位肽为基础的生物治疗成为治疗NY-ESO-1+胃癌患者的一个重要的研究方向。本研究采用HLA-A2限制性多肽NY-ESO-1157-165作为抗原, 自体成熟的DCs作为抗原载体和免疫佐剂, 结果显示, NY-ESO-1157-165多肽负载的DCs能够激发针对NY-ESO-1157-165的特异性CTLs克隆, 激发CTLs对NY-ESO-1+胃癌细胞的特异性杀伤作用的同时, 可建立稳固的细胞免疫应答。
体外实验结果表明, NY-ESO-1157-165多肽负载DCs能够刺激患者自体PBLs的增殖, 其中NY-ESO-1157-165多肽负载DCs刺激患者自体PBLs的增殖指数明显高于未负载DCs; 同时采用流式细胞术检测DCs激活后CD8+IFN-γ +T的比例, 发现NY-ESO-1157-165多肽负载DCs激发的CD8+IFN-γ +T的比例明显高于未负载DCs组(图2), 表面负载NY-ESO-1157-165多肽的DCs具有激发特异性CTLs的能力。为鉴定NY-ESO-1157-165多肽负载DCs致敏的CTLs的特异性杀伤活性, 本研究采用NY-ESO-1+胃癌细胞SGC-7901及NY-ESO-1157-165多肽负载T2细胞株作为DCs致敏CTLs的靶细胞, K562作为NK效应细胞的靶细胞, 以未负载NY-ESO-1+多肽DCs致敏的CTLs作为对照, 发现负载NY-ESO-1157-165多肽DCs致敏CTLs对K562的杀伤效率较低, NY-ESO-1157-165多肽负载DCs致敏的CTLs对NY-ESO-1+胃癌细胞SGC-7901及负载NY-ESO-1157-165多肽T2细胞杀伤活性高于未负载DCs致敏的CTLs。另外, 本研究又设计了以Her-2多肽负载T2作为靶细胞, 以鉴定CTLs杀伤活性的抗原特异性, 发现负载NY-ESO-1157-165多肽负载DCs致敏的CTLs对负载Her-2多肽的T2细胞杀伤率低, 表明负载NY-ESO-1157-165多肽DCs致敏的CTLs具有抗原特异性识别能力, 对靶细胞有进行特异杀伤的功能。
本研究体内实验结果表明, 负载NY-ESO-1157-165多肽DCs致敏的CTLs是比较安全的, 15例患者均未出现明显不良反应。血清细胞因子检测结果显示, Th1类细胞因子水平(IFN-γ 、IL-2、TNF-α )明显升高。Th1类细胞因子在机体抗肿瘤免疫应答中发挥重要作用, 如IFN-γ 具有较强的抗肿瘤和免疫调节作用, IL-2和IL-12促进CTLs的增殖并提高其杀瘤活性[23]。同时, 本研究15例患者治疗后体内CD8+ IFN-γ +特异性CTLs细胞克隆数也明显增加, 提示多肽负载的DCs联合致敏的CTLs细胞免疫治疗能显著改善患者体内的肿瘤特异性细胞免疫应答, 激活机体的特异性抗肿瘤免疫功能。
综上所述, 本研究通过将负载NY-ESO-1157-165优势性表位肽的具有强大肿瘤抗原提呈能力的DCs与具有高效杀瘤活性的CTLs细胞共培养, 二者分别通过识别抗原和激活获得性免疫系统并发挥自身的细胞毒活性, 通过分泌细胞因子协同杀伤肿瘤细胞, 从而形成高效能的抗肿瘤免疫应答, 同时, 多肽负载的DCs联合致敏的CTLs细胞免疫治疗能显著改善患者体内的肿瘤特异性T细胞免疫应答, 激活机体的特异性免疫反应, 但其长期的临床效应仍需要扩大样本量做深入探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|