目的 总结后腹腔镜下活体供肾切取术193例的经验,优化改进操作技术,使其更加标准化。方法 选择北京大学第三医院2003年12月至2016年2月行后腹腔镜下活体供肾切取术共193例,全身麻醉下,取腰部3个通道操作,彻底游离肾后,在肾下极7~8 cm处切断输尿管,用endo-cut或 hem-o-lok分别夹闭切断肾动静脉,迅速取出肾用4 ℃肾保存液进行灌注,然后将离体肾保存在冰盐水中准备移植,记录手术时间、出血量、并发症发生情况、供者和受者肾功能情况。结果 193例手术均获得成功,手术时间85 min(55~135 min),1例因出血手术中转开放。术中出血量60 mL(20~200 mL),所有供者均不需输血。供肾热缺血时间2.2 min(2~5 min)。发生供者并发症3例,均为术后肾区血肿,保守治疗均自行吸收,未见不良影响,其余供者均未见异常。供者术后住院5.7 d(4~9 d)。193例供者中162例得到随访,平均随访42个月(1~58个月),均未见异常。2例受者发生移植肾输尿管吻合口漏尿,经手术修补后痊愈;3例受者发生移植肾被膜下血肿。1例受者发生移植肾功能延迟恢复,其余受者肾功能恢复良好。供、受者随访期间肾功能均未见异常。结论 后腹腔镜下活体供肾切取术安全可靠,经不断技术改良后已经成熟和标准化,其应用前景广泛,但应由有经验的医生操作以预防并发症的发生。
Objective: To summarize our experience of retroperitoneal laparoscopic living donor nephrectomy, our continuous technical improvements and refinement of this skill and standardization of each procedure of this operation.Methods: Having approved by hospital ethical committee and local government administration, a total of 193 living donors underwent retroperitoneal laparoscopic living donor nephrectomy from Dec.2003 to Feb.2016 in our department. Under general anaesthesia, the operation was performed through 3 lumbar ports. After the kidney was liberated fully and the ureter was severed 7-8 cm under the lower pole of the kidney, the renal artery and vein were blocked with endo-cut or hem-o-lok separately and then severed. Then the kidney was taken out quickly and flushed with 4 ℃ kidney preserving fluid immediately, the donor kidneys were then preserved in iced saline until kidney transplantation. Clinical data about operation time, volume of blood loss, perioperative complications, renal function of both donors and recipients before and after operation were collected.Results: The 193 retroperitoneal laparoscopic living donor nephrectomy operations were successful with only one operation was converted to open living donor nephrectomy because of hemorrhage and unclear operation field during the operation. The average operation time was 85 min (55-135 min), the average blood loss was 60 mL (20-200 mL), and no donor needed blood transfusion during or after operation. Three donors were found to have hematoma of renal fossa after operation and none of them required further treatment. The average hospital stay after operation was 5.7 days (4-9 days). In the study, 162 donors were followed up for an average of 42 months (1-58 months) and they were all healthy. Two kidney recipients had urinary bladder anastomosis leakage after operation and both needed surgical repair, a new anastomosis of ureter and bladder were made. Three kidney recipients had kidney subcapsular hematoma but required no further treatment. One kidney recipient had delayed graft function and recovered finally and the renal function of other recipients were all normal. Renal function of both donors and recipients during the follow up period were normal.Conclusion: Retroperitoneal laparoscopic living donor nephrectomy is a safe and reliable technique, it may become a standardized operation for living kidney transplantation after continuous technical improvement. Precautions must be taken to avoid complications and a skilled hand is necessary for success.
目前活体供肾切取的手术方式主要有开放供肾切取术、腹腔镜供肾切取术、手助腹腔镜供肾切取术, 以及近年出现的机器人辅助腹腔镜供肾切取术, 其中腹腔镜活体供肾切取术具有创伤小、术后恢复快等优势, 正逐步替代开放手术成为活体供肾切取的标准术式。北京大学第三医院2003年12月至2016年2月共开展后腹腔镜下活体供肾切取术193例, 效果良好, 现总结报道如下。
本组供者193例, 男148例, 女45例, 年龄21~65岁, 平均48.5岁, 体重指数(21.25± 3.5) kg/cm2, 术前血肌酐为(71.3± 12.6) μ mol/L。所有供者均为自愿无偿捐献, 供、受者关系以父母捐献给子女为主, 共158例, 其余有兄弟姐妹之间捐献、子女捐献给父母、夫妻之间捐献以及其他关系之间捐献共35例。所有供者均身体健康, 供、受者关系均属于国务院《人体器官移植条例》所规定范围内的合法亲属, 手术前均经过北京大学第三医院人体器官移植技术临床应用与伦理委员会审查通过, 并上报省级卫生行政主管部门审批通过。所有供者无腹部手术史, 无未经控制的高血压、心脏病、肺结核、糖尿病及肝肾疾病等病史。5例供者有轻度血压升高, 药物控制良好, 无高血压靶器官病变。术前查血清肌酐、尿素氮、肝功能等生化指标均正常, 无蛋白尿, 乙型肝炎表面抗原、丙型肝炎抗体、人类免疫缺陷病毒抗体定性检查均为阴性。术前常规行双肾血管计算机断层扫描三维成像了解供肾血管情况, 便于制定手术方案, 所有供者术前检查显示双肾动静脉未见异常, 泌尿系统无畸形, 同位素肾图检查肾小球滤过率> 80 mL/min, 双肾分肾肾功能均正常, 单侧肾小球滤过率> 40 mL/min。术前常规检查无手术禁忌证。193例受者均为终末期肾病尿毒症患者, 男144例, 女49例, 年龄18~36岁, 平均28岁, 血液透析时间8~25个月, 平均15个月。
因左右侧肾存在先天性解剖差异, 左肾静脉较长便于腹腔镜手术操作和肾移植手术, 原则上首选左肾, 如因肾小球滤过率及血管复杂等原因不能以左肾为供肾, 则切取右肾。实际取左肾178例, 取右肾15例(右肾肾下垂1例, 右肾单支动脉、左肾多支动脉9例, 右肾小结石2例, 右肾囊肿1例, 另2例右侧肾小球滤过率偏低, 为保护供者利益, 切取右肾)。
仪器设备:所用腹腔镜设备包含Olympus UHI-3气腹机、CLVS40冷光源、OTVS7摄像主机及30° 镜头、Olympus或强生超声刀、10 mm和12 mm的hem-o-lok夹(Weck Closure Systems, Research Triangle Park, NC, United States)以及美国强生公司配套腹腔镜穿刺器(Trocar)、吸引器、手术钳、剪刀、直线切割器(Endopath ETS35 stapler , 35 mm length, 2.5 mm staples, Ethicon Endo-Surgery)等, 后期部分手术采用了Stryker高清腹腔镜和Storz高清3D腹腔镜。
供者气管插管全身麻醉后, 插入导尿管, 侧卧位, 升高腰桥, 供肾侧在上, 采用Olympus 30° 腹腔镜、Stryker 30° 高清腹腔镜或 Storz 30° 高清3D腹腔镜。于腰部取3个穿刺点入路, 第1个穿刺点选在第12肋下缘骶棘肌交界处, 在腰背筋膜下与腹膜后脂肪间用指尖分出一腔隙, 置入用手套自制的气囊扩张器, 注入空气600 mL, 持续5 min后放气, 置入13 mm Trocar, 由此插入腹腔镜镜头并建立CO2气腹, 气腹压力维持12 mmHg(1 mmHg=0.133 kPa); 第2个穿刺点选在髂嵴上缘2 cm, 监视下穿刺置入11 mm Trocar; 第3个穿刺点选在腋前线与肋弓下2 cm处, 置入5 mm Trocar。腹腔镜操作时, 镜头移至第2个Trocar处。
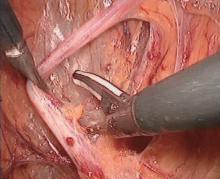
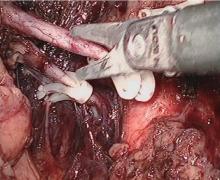
腹腔镜下首先游离输尿管(图1), 然后按解剖层次在脂肪囊内进行肾游离, 用超声刀切断肾表面与肾脂肪囊间相连的纤维组织和小血管, 游离的顺序一般为肾背侧、内侧、上下极, 将肾动脉和肾静脉血管鞘的纤维组织和淋巴管凝固切断, 肾动脉尽量向腹主动脉方向游离, 肾静脉尽量向下腔静脉方向游离, 取左肾时用超声刀分别凝固切断回流到肾静脉的生殖静脉(图2)、腰静脉(图3)和肾上腺中央静脉(图4), 将肾动脉和肾静脉骨骼化(图5)。
输尿管尽量向下游离, 在距离肾下极7~8 cm处, 用钛夹或hem-o-lok塑料夹夹闭, 并用剪刀剪断输尿管。肾血管的处理分别使用35 mm直线切割器(Endopath ETS35, Ethicon Endo-Surgery)或hem-o-lok塑料夹(Weck Closure Systems, Research Triangle Park, NC, United States), 开展本术式初期有6例供者使用了直线切割器(均为左肾), 其后的187例使用了hem-o-lok塑料夹。最后切断供肾血管, 以缩短热缺血时间, 具体为将肾游离结束后, 先做皮肤切口至肌层以缩短取出肾所需的时间, 然后使用直线切割器分别切断肾动脉和肾静脉或分别于肾动脉和肾静脉近心端血管起始部夹上2个hem-o-lok塑料夹, 远心端不用hem-o-lok塑料夹, 剪断肾血管(图6~8), 再切开切口取出肾, 用4 ℃的肾保存液灌注肾至肾颜色灰白, 肾静脉流出液转清, 以4 ℃低温保存。在切断肾血管以前, 常规静脉给予肝素50 mg, 切断肾血管后, 再给予鱼精蛋白50 mg中和肝素。取出肾以后, 仔细检查手术区域有无出血, 留置乳胶引流管, 缝合切口。
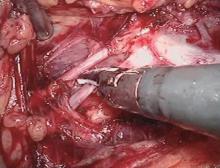 | 图2 超声刀凝固切断生殖静脉Figure 2 Handle of renal vessel tributaries: gonadal vein was coagulated and transected using harmonic scalpels |
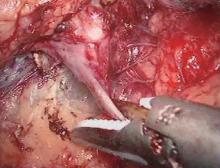 | 图3 超声刀凝固切断腰静脉Figure 3 Handle of renal vessel tributaries: lumbar vein was separated and transected using harmonic scalpels |
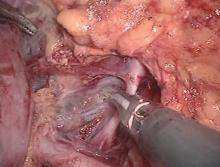 | 图4 超声刀凝固切断肾上腺中央静脉Figure 4 Handle of renal vessel tributaries: adrenal vein was coagulated and transected using harmonic scalpels |
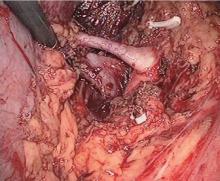 | 图5 将肾动脉和肾静脉游离至骨骼化, 避免直接刺激肾动脉Figure 5 Renal artery and renal vein were skeletonized completely, avoid direct stimulation to renal artery |
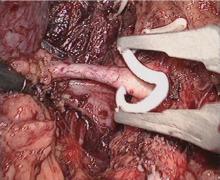 | 图6 用两枚hem-o-lok塑料夹在肾动脉起始部夹闭肾动脉Figure 6 Renal artery was clipped by two hem-o-lok clips at proximal end as close as possible to the origin from the abdominal aorta |
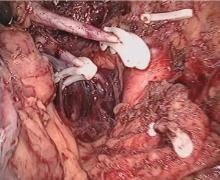 | 图7 各用两个hem-o-lok塑料夹夹闭肾动脉和肾静脉Figure 7 Renal artery and renal vein were clipped separately by two hem-o-lok clips at their origin site |
193例供者后腹腔镜取肾手术均获得成功, 1例因术中出血视野不清在腹腔镜游离结束后改为开放手术切取肾。手术时间85 min(55~135 min), 术中出血量60 mL(20~200 mL)。所有手术均不需要输血。热缺血时间平均为2.2 min(2~5 min), 左侧供肾动脉长度为(2.2± 0.3) cm, 左侧供肾静脉长度为(2.4± 0.4) cm, 右侧供肾动静脉长度分别为(2.5± 0.3) cm和(2.1± 0.8) cm。所有供者均于术后第2天给予半流食, 并下地活动, 术后24 h内拔除尿管。术后平均住院5.7 d(4~9 d)。共发生手术并发症4例, 3例为术后肾区血肿, 保守治疗后均自行吸收, 未见不良影响, 1例为术中腹膜破裂, 增加一个5 mm Trocar用于辅助操作, 其余均未见异常。所有肾移植手术均获得成功, 供肾血管长度足够移植, 无需静脉延长, 1例受者发生移植肾功能延迟恢复, 给予血液透析、调整免疫抑制剂等治疗, 术后1个月肾功能的血肌酐恢复正常。其余受者肾功能恢复良好, 开放血流后即刻排尿, 在术后第7天和第30天肾功血肌酐分别为(115± 20) μ mol/L和(105± 11) μ mol/L。2例受者发生移植肾输尿管吻合口漏尿, 经手术修补, 重新行输尿管与膀胱吻合后痊愈, 3例受者发生移植肾被膜下血肿, 均无需处理。
162例供者得到随访, 随访1~58个月, 平均42个月, 所有供者随访期间生活质量良好, 4例供者有微量蛋白尿, 无新发高血压或原高血压加重, 血清肌酐较术前升高约20%左右, 但均处在正常范围。
肾移植是治疗终末期肾病最好的方法, 活体肾移植是肾移植的重要组成部分, 要进行活体肾移植, 须从健康供者身体上切取肾, 供肾切取术与常规破坏性的肾切除术不同, 此种手术除了需要尽量将对供者的损伤降至最低, 还要保证供肾解剖和功能的完好, 因此需要最大限度减少术中对肾的挤压, 肾切取后应保留足够长度的动、静脉及输尿管, 方能顺利进行肾移植。
在泌尿外科腹腔镜技术普遍开展以前, 活体取肾常规采用开放手术的方法, 北京大学第三医院也曾采用开放手术切取供肾, 开放手术创伤大, 恢复慢, 对供者健康的影响很大, 许多供者因为惧怕手术而放弃供肾。
1990年Clayman等[1]首次开展后腹腔镜下肾切除术, Gill等[2]于1994年首次报道腹腔镜猪活体供肾切取, Ranter等[3]于1995年完成了世界首例腹腔镜活体供肾切取。随着设备和技术的进步, 腹腔镜技术不断发展完善, 腹腔镜已经普遍用于上尿路和下尿路手术, 取代了大部分泌尿外科开放手术。腹腔镜技术的成熟, 促使了它在活体供肾切取方面的应用和发展, 腹腔镜取肾根据手术路径分为经腹腔途径和经后腹腔途径, 根据手术方式又分为完全(pure)腹腔镜取肾和手助式(hand assisted)腹腔镜取肾[4], 以上方式各有利弊, 由于经后腹腔途径对腹腔脏器干扰少, 术后恢复快, 北京大学第三医院常规采用经后腹腔途径完全腹腔镜下取肾[5, 6, 7, 8, 9]。
供肾切取手术成功的关键是要安全、可靠的处理肾蒂血管, 而且又要尽可能地保留足够长度的血管, 以满足肾移植血管吻合的要求。早期开放手术多采用缝线结扎肾动脉和肾静脉的方法, 此方法优势明显, 可以获得最大长度的肾血管, 尤其是取右肾时, 可以切取一部分下腔静脉壁, 使右肾静脉最长化, 但开放手术创伤大, 对手术的恐惧影响了一部分人的捐献意向, 有学者认为[10], 腹腔镜取肾技术的推广, 使得因此而愿意捐肾的人数增加了37%。
国内在腹腔镜活体供肾切取开展早期, 多采用直线切割器封闭和切断肾血管, 当前, 有很多国外的移植中心仍坚持采用此方法, 其优点在于可靠、安全性高, 本课题组认为直线切割器夹闭血管会造成血管内膜损伤, 移植前需要再去掉一段血管, 增加了肾移植手术难度, 因此本课题组放弃了这种方法。hem-o-lok塑料夹最早于1999年在美国用于肾切除手术时闭合血管, hem-o-lok塑料夹用于活体取肾, 其安全性存在争议, 主要是hem-o-lok塑料夹有脱落导致大出血甚至供者致死的报道[11, 12], 因此美国食品药品管理局禁止将hem-o-lok塑料夹用于供肾血管的处理。中国和美国具有不同的国情, 本课题组对此持不同观点, 根据我们开展大量普通腹腔镜肾切除手术和腹腔镜取肾手术的经验, 认为只要掌握正确的使用方法, 在后腹腔镜下行供肾切取手术使用hem-o-lok塑料夹是安全可行的, 而且, 国内很多中心也是常规使用hem-o-lok塑料夹来取肾的[13, 14, 15, 16, 17, 18], 其安全性已经得到认可。本课题组的经验是在处理肾静脉和肾动脉时切勿强行将hem-o-lok塑料夹夹在血管起始部, 在血管的近心端必须夹两个hem-o-lok塑料夹, 还要保留1~2 mm的血管残端, 必要时可以在hem-o-lok塑料夹的远端夹一个钛夹, 这样做既符合了美国食品药品管理局的要求, 也保证了手术安全, 属于一种变通的方法, 但是, 对于肾动脉有粥样硬化的供者, 使用hem-o-lok塑料夹时应谨慎, 有hem-o-lok夹子导致肾动脉破裂大出血的报道[17]。
此外, 在本课题组多年开展后腹腔镜活体取肾的实践过程中, 我们取长补短, 不断改进和优化技术, 使得这项技术逐渐成熟和标准化, 本课题组的改进之处有:(1)采用 6.5号无菌医用手套自制气囊扩张器, 可以最多注入空气1 000 mL而不破裂, 足够扩张出后腹腔镜操作所需空间, 可以节省商品化扩张器的费用; (2)采用超声刀直接凝固切断直径5 mm以下的肾静脉分支, 可避免使用过多的钛夹或hem-o-lok夹子影响操作, 也可进一步减少费用; (3)术中坚持“ no touch” 原则, 避免器械挤压肾, 以免形成被膜下血肿; (4)输尿管用剪刀剪断, 不用电外科器械或超声刀切断, 避免热损伤; (5)输尿管最早游离出来可以作为解剖标志, 在切断血管之前再剪断, 从而避免肾旋转, 血管扭曲, 缩短热缺血时间; (6)用hem-o-lok夹闭合血管可节省直线切割器的费用, 血管长度足够移植; (7)供肾不装袋直接取出, 缩短热缺血时间; (8)预切开皮肤和皮下, 进一步缩短热缺血时间; (9)取肾切口为纵切口, 切口方向与肌纤维方向平行, 肌肉损伤少, 疼痛轻。
本研究的不足之处在于总体病例数量仍偏少, 这与目前活体移植伦理审批严格复杂有关, 还需要进一步积累病例; 另外, 对于供、受者远期的肾功能情况, 需要进一步随访观察; 约1/5的病例失访, 尤其以早期的病例居多, 此部分供者的肾功能情况不明, 应加强供者随访管理工作, 确保供、受者远期的健康。
综上所述, 经过十余年的发展以及不断技术优化改良, 后腹腔镜取肾技术已经成熟和标准化, 其安全性和有效性已经得到验证, 对于增加活体肾移植数量, 后腹腔镜取肾技术起到了积极地推动作用, 在确保安全的前提下, 这项技术具有推广的意义[19]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|