目的 检测乙酰水杨酸(acetylsalicylic acid,ASA)对牙龈干细胞(mesenchymal stem cells derived from gingiva,GMSCs)免疫调节功能的影响,初步探索乙酰水杨酸对干细胞治疗免疫相关疾病疗效的提高作用及机制。方法 通过流式细胞仪分析ASA对GMSCs干细胞表面标志分子CD146、CD105、CD90、CD34 和 CD45的影响,通过BrdU掺入法以及MTT细胞实验检测GMSCs增殖率。建立 GMSCs与T细胞体外共培养系统,通过流式细胞仪分析细胞凋亡并用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测相关炎症因子。进一步建立硫酸葡聚糖(dextran sulfate sodium,DSS)诱导性小鼠肠炎模型,通过追踪小鼠体重等临床表现以及结肠病理组织切片,研究GMSCs注射对DSS诱导肠炎的治疗作用,以研究ASA对GMSCs免疫调节功能的促进作用,并进一步探索其分子机制。结果 ASA促进GMSCs增殖并调高CD146及CD105等干细胞表面标记分子在GMSCs的表达。GMSCs与T细胞共培养中,GMSCs诱导T细胞凋亡,ASA可以增强GMSCs诱导T细胞凋亡,同时抑制T细胞分泌炎症因子干扰素γ和肿瘤坏死因子α。GMSCs注射对DSS诱导性小鼠肠炎具有治疗作用,表现为小鼠体重下降减缓、肠炎临床指数降低、结肠组织切片HE染色显示炎性细胞浸润减少及病理指数降低,ASA可以促进GMSCs注射治疗小鼠肠炎疗效。分子机制上,ASA通过调高Fas/FasL信号通路FasL的表达促进GMSCs诱导T细胞凋亡。结论 ASA增强GMSCs免疫调节功能,促进GMSCs对小鼠诱导性肠炎的治疗作用。
Objective: To analyze the role of acetylsalicylic acid (ASA) in immunomodulation of me-senchymal stem cells derived from gingiva (GMSCs), and to explore the role of ASA in enhancing the immumomodulation of GMSCs and the capacity of GMSCs to treat immune disorders and the underlying mechanism.Methods: Flow cytometry analysis were used to analyze the role of ASA in the expression of stem cells surface markers CD146, CD105, CD90, CD34 and CD45 in GMSCs,and the GMSCs proliferation was analyzed by 5-bromo-2-deoxyuridine (BrdU) staining and 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay. The GMSCs and T cells co-culture system was established to analyze the role of ASA in immunomodulation of GMSCs by measuring T cell apoptosis using flow cytometry analysis and inflammatory cytokines using enzyme linked immunosorbent assay (ELISA). Further more, the dextran sulfate sodium (DSS) induced colitis mouse model was established and the mouse body weight, disease activity score, histological index and pathological change of colons were analyzed after GMSC infusion.Results: The proliferation of GMSCs and the expressions of CD105, CD146 in GMSCs were increased after ASA treatment. In the GMSCs and T cells co-culture system, GMSCs induced T cells apoptosis and inhibited interferon γ (IFN-γ) and tumor necrosis factor α (TNF-α) secretion by T cells, which were enhanced by ASA treatment. In vivo, GMSCs infusion could ameliorate DSS-induced colitis, including inhibited DSS-induced mouse body weight loss, decreased disease activity score and histological index, and decreased inflammation cells infiltration in colons, as shown by hematoxylin-eosin (HE) staining. Moreover, the therapeutic effects of GMSC infusion on DSS-induced colitis could be enhanced by ASA treatment. Mechanically, ASA treatment increased FasL expression of Fas/FasL death pathway in GMSCs to induce T cells apoptosis.Conclusion: ASA enhanced immunomodulation of GMSCs and increased the capacity of GMSCs to ameliorate DSS-induced colitis in mice.
间充质干细胞(mesenchymal stem cells, MSCs)具有自我更新和成骨、成脂、成软骨等多向分化潜能, 自1974年从骨髓分离出MSCs以来, 研究者陆续从多种成体组织包括口腔组织中分离出口腔干细胞。牙龈间充质干细胞(MSCs derived from gingiva, GMSCs)是从牙龈组织中分离出的, 研究表明其跟骨髓MSCs相似, 不仅具有自我更新、多向分化潜能, 可以用于组织再生, 同时还具有免疫调节功能, 能够体外诱导T细胞凋亡, 抑制Th17细胞分化并增强Treg细胞分化。当注射到体内时, GMSCs可以部分缓解葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠肠炎[1, 2], 但并不能完全治愈, 因此, 寻找促进GMSCs免疫调节功能的药物或小分子化合物非常重要。
乙酰水杨酸(acetylsalicylic acid, ASA)是一种应用广泛的非甾体类抗炎药, 可以作用于多种生物学行为。研究报道, ASA可以通过促进MSCs成骨分化而治疗小鼠骨质疏松[3]。同时, ASA通过抑制干扰素γ (interferon γ , IFN-γ )和肿瘤坏死因子α (tumor necrosis factor α , TNF-α )的产生促进MSCs为基础的组织再生[4]。ASA可以增强MSCs和脱落乳牙干细胞的免疫调节能力[5, 6], 但ASA是否可以促进GMSCs的免疫调节功能及其机制目前尚不清楚, 本研究将探索研究ASA是否参与调控GMSCs的免疫调节能力及其机制。
DMEM培养基、胎牛血清(fetal bovine serum, FBS)、细胞培养用抗生素购自美国Gibico公司, 细胞培养皿等耗材购自美国Corning公司, BCA蛋白定量试剂盒(Pierce BCA protein assay kit)、5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine, BrdU)试剂盒和MTT assay kit购自美国Thermo Scientific公司。抗人抗体 CD90(FAB2067P)、CD146(FAB932P)、CD105(FAB10971P)、CD34(FAB7227P)和CD45(FAB1430P)以及细胞凋亡检测试剂盒购于美国R& D公司。其他研究所用材料、试剂全部购自美国Sigma公司。
本研究经北京大学口腔医院生物医学伦理委员会审查(编号PKUSSIRB-201311103), 提供者均知情同意。收集临床丢弃牙龈组织, 将组织切碎, 4 g/L分散酶Ⅱ 和2 g/L胶原酶Ⅰ 消化1 h, 过100 μ m细胞筛, 获得单细胞悬液, 接种于100 mm培养皿, 置于37 ℃、5%(体积分数)CO2培养箱中, 24 h后换液。培养液成分:a-MEM含150 g/L FBS、2 mmol/L谷氨酰胺、55mmol/L巯基乙醇、104U/L青霉素和100 mg/L链霉素。当细胞达到70%~80%融合时传代。实验组50 mg/L ASA 处理24 h。
总蛋白样品(20 μ g)加上样缓冲液(loading buffer)配制成适量的上样混合液, 混匀, 煮沸10 min, 迅速冰浴, 短暂离心, 加样于预成的SDS-聚丙烯酰胺凝胶加样孔中电泳(浓缩胶, 80 V电压15 min; 分离胶, 200 V电压45 min)。转膜到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜, 将PVDF膜置于封闭液, 室温下轻摇1 h。加入一抗(1 :1 000)稀释, 混匀, 4 ℃孵育过夜, TBST缓冲液室温下摇晃洗涤3次, 每次5 min。加入二抗(1 :10 000)稀释, 室温孵育1 h, 洗膜后曝光显影。
收集细胞培养上清, 用标准酶联免疫吸附测定法(enzyme linked immunosorbent assay, ELISA)检测TNF-α 和IFN-γ 。配制ELISA标准品, 取出酶标板, 分别设空白孔、待测样品孔、标准品孔, 每孔加入50 μ L上述上清液及标准品, 轻轻混匀, 室温孵育2 h。洗涤:吸出酶标板中的液体, 每孔加满洗涤液, 静止30 s后弃去, 如此重复4次。每孔加入100 μ L酶标试剂(空白孔除外), 室温孵育2 h, 重复洗涤步骤同上。每孔加入100 μ L显色底物, 避光室温孵育30 min, 每孔加入100 μ L终止液, 测定450 nm波长下各孔的光密度值。
取小鼠脾脏, 研磨成单细胞, 红细胞裂解液去除红细胞。1 g/L抗CD3抗体铺板, 1 g/L抗CD28抗体培养2~3 d, 激活T细胞。接种GMSCs 1× 105/孔到12孔板, 待细胞贴壁后, 接种T细胞1× 106/孔于12孔板, 共培养2~3 d。收集细胞, 用Annexin Ⅴ 凋亡检测试剂盒进行流式分析, 检测T细胞凋亡。
接种0.5× 105 GMSCs于24孔板, 待细胞贴壁后, 不同浓度梯度的ASA作用24 h, 按(1 :100)加入BrdU溶液(美国Invitrogen)孵育12 h, 按照BrdU检测标准说明操作:室温加封闭液封闭30 min, 加入BrdU一抗作用60 min, 磷酸盐缓冲液(phosphate buffer solution, PBS)洗3遍, 加入二抗作用10 min, PBS洗3遍, 苏木精染细胞核。计算BrdU阳性细胞与总细胞数比例, 代表细胞增殖率。BrdU测定重复5个独立实验组。
接种0.5× 104GMSCs于96孔板, 待细胞贴壁后, 50 mg/L ASA作用24 h, 以未处理的GMSCs作为对照, 将10 μ L MTT储备液(Life Technologies, Carlsbad, 美国)加入到各孔中, 37 ℃孵育4 h, 用二甲基亚砜(dimethyl sulphoxide, DMSO)中和沉淀后, 在540 nm处测量光密度值。
给予C57BL/6J小鼠30 g/L DSS(相对分子质量36× 103~50× 103)饮用水10 d, 诱导急性肠炎模型。30 g/L DSS水喂养3 d后, 尾静脉注射1× 106GMSCs或ASA-GMSCs, 第10天处死小鼠, 收集肠标本, 40 g/L多聚甲醛溶液固定, 进行苏木精-伊红染色(hematoxylin-eosin, HE)染色。
运用SPSS 18.0统计软件, 所有数据用均数± 标准差表示, 干细胞表面标志物表达及MTT细胞增殖采用双侧t检验法, 其他实验结果采用单因素方差分析法(ANOVA), 组间比较采用LSD法。P< 0.05为差异有统计学意义。
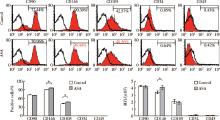
为了研究ASA对GMSCs增殖率的影响, 用不同浓度梯度ASA处理GMSCs。BrdU掺入法显示, ASA处理可以增强GMSCs增殖率, 在10、50、200 mg/L 不同浓度中, 50 mg/L ASA对GMSCs增殖率的增强作用最显著; MTT细胞实验进一步证实, 50 mg/L ASA可以显著提高GMSCs的细胞增殖率(图1)。因此, 后续实验中均采用50 mg/L ASA处理细胞。
流式细胞分析结果显示, GMSCs表达MSCs表面分子标记CD90、CD146和CD105, 不表达造血干细胞表面分子标记CD34和CD45, ASA能够提高GMSCs表达CD146和CD105, 同时增强CD146表达荧光强度, 但对CD105表达荧光强度无明显影响(图2)。
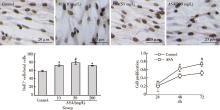 | 图1 ASA对GMSCs干细胞增殖的影响Figure 1 The effects of ASA on the proliferation of GMSCs ASA, acetylsalicylic acid. * P< 0.05, #P< 0.01 vs. Control. |
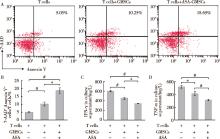
GMSCs和T细胞共培养中, 流式细胞分析显示GMSCs诱导T细胞凋亡(图3A、B), 同时ELISA实验结果显示GMSCs抑制T细胞分泌炎症因子IFN-γ 和TNF-α 。ASA促进GMSCs诱导T细胞凋亡, 同时进一步抑制T细胞分泌炎症因子IFN-γ 和TNF-α (图3C、D), 提示ASA能够增强GMSCs免疫调节功能。
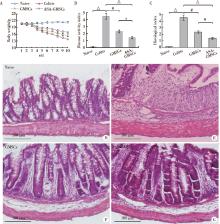
相比对照组, DSS诱导肠炎组小鼠体重显著下降, GMSCs和ASA-GMSCs注射组均可以部分恢复肠炎小鼠体重, ASA-GMSCs注射组的恢复效果更强(图4A)。基于小鼠体重下降、腹泻以及便血等整体评价的疾病活动性评分(disease activity index, DAI)显示, ASA-GMSCs注射相比GMSCs注射可以显著降低小鼠DAI(图4B)。病理学上, DSS肠炎小鼠表现出结肠明显炎症细胞浸润及肠壁上皮层破坏等, 而GMSCs和ASA-GMSCs注射可以显著降低小鼠结肠炎症细胞浸润并修复上皮层。实验结果进一步显示, ASA-GMSCs注射治疗效果优于GMSCs注射组(图4C~G), 提示GMSCs对DSS诱导小鼠肠炎具有治疗作用, ASA可以增强GMSCs治疗效果。
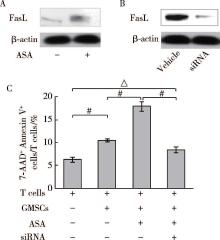
免疫印迹试验显示, ASA提高GMSCs表达FasL(图5A)。为进一步阐明FasL在GMSCs免疫调节功能中的作用, 本研究用FasL siRNA调低FasL表达(图5B)。在共培养中, 降低FasL表达可以抑制ASA增强GMSCs诱导T细胞凋亡(图5C), 提示ASA通过调高GMSCs中FasL表达增强GMSCs免疫调节功能。
牙龈组织是口腔内附着于牙槽突表面和牙颈部周围的结缔组织, 是口腔的生物屏障, 长久持续的暴露在口内丰富多样的细菌微生物微环境中, 易于受到侵害而发生牙龈炎, 继续发展会进一步侵犯硬组织, 发展为牙周炎, 因此维护牙龈组织的完整性以及系统动态平衡对防治牙周病至关重要[7]。GMSCs具有克隆形成、生长稳定、快速增殖等特点, 在诱导培养下, 可向成骨、成脂、成神经等多种中胚层和神经外胚层来源的细胞分化[1, 8]。GMSCs在维持牙龈组织健康和损伤修复中发挥关键作用。本研究结果显示, ASA可以提高GMSCs的干细胞表面标记CD146和CD105的表达, 同时增强GMSCs的增殖率, 说明ASA能够增强GMSCs的干细胞活性, 这可能与ASA增强干细胞的端粒酶活性相关[3], 关于ASA维持和提高干细胞增殖和活性的分子机制还有待进一步的研究。
牙龈组织具有修复速度快, 修复过程中炎症反应低, 且形成胚胎期样无瘢痕组织等优点, 可能与GMSCs的免疫调节功能相关。MSCs的免疫学特性研究表明, MSCs可通过直接接触, 分泌细胞因子[吲哚胺-2, 3-二氧化酶(indoleamine 2, 3-dioxygenase, IDO)、一氧化氮(nitric oxide, NO)、前列腺素(prostaglandin E2, PGE2)和转化生长因子(transforming growth factor beta, TGF-β )等]或调节免疫细胞的代谢发挥免疫调节作用。MSCs能抑制T细胞增殖, 抑制激活的T细胞向T细胞亚群Th1、Th2和Th17细胞转化, 减少Th1、Th2、Th17型炎症因子的释放, 并可通过诱导T细胞凋亡, 促进调节性T细胞(Treg)生成, 诱导免疫耐受[9, 10, 11]。本研究表明, GMSCs通过Fas/FasL凋亡通路诱导T细胞凋亡, ASA提高GMSCs表达FasL, 从而增强GMSCs诱导T细胞凋亡。在体内, GMSCs对DSS诱导小鼠肠炎具有治疗效果, ASA可以提高GMSCs的治疗效果。ASA是否通过调控其他免疫细胞因子调节GMSCs功能还有待进一步研究。
综上, 本研究提示, ASA能够提高GMSCs干细胞特性, 通过调高FasL表达提高其免疫调节能力。
ASA可能是一种有效可行的提高GMSCs 临床治疗效果的药物。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|