目的 探讨颈动脉斑块人群的大动脉弹性功能与冠心病(coronary heart disease,CHD)或下肢动脉疾病(lower extremity arterial disease,LEAD)的关系。方法 入选存在颈动脉斑块且动脉硬化检查、血生化检查及病史资料完整者491例,包括男性208例、女性283例,平均年龄(61.66±11.60)岁,按照有无CHD或LEAD分为两组:无CHD和LEAD组,记为无病组;有CHD或LEAD组,记为CHD/LEAD组。分别进行单因素和多因素分析,研究大动脉硬化[即颈-股动脉脉搏波传导速度(carotid-femoral pulse wave velocity,CF-PWV)>9 m/s]对于不同年龄水平(年龄<61.66岁和年龄>61.66岁)CHD/LEAD患病的独立影响。结果 本组人群大动脉硬化水平较高(平均CF-PWV为10.71 m/s), 其中76.6%存在大动脉硬化,36.9%存在CHD/LEAD。CHD/LEAD组的年龄、男性比例、吸烟比例、收缩压、糖化血红蛋白、同型半胱氨酸、肌酐和CF-PWV水平,以及高血压、糖尿病患病率,降压药、降糖药和降脂药的服药率均显著高于无病组,而总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇显著低于无病组( P均<0.05)。多因素Logistic回归分析提示,在年龄<61.66岁的颈动脉斑块人群中,大动脉硬化是CHD/LEAD患病的独立影响因素( OR=3.229,95% CI 1.156~9.022, P<0.05);在年龄>61.66岁的颈动脉斑块人群中,大动脉硬化对于CHD/LEAD患病无独立影响关系( P>0.05)。结论 颈动脉斑块患者的大动脉弹性功能普遍较差,年龄<61.66岁的颈动脉斑块人群若同时合并大动脉硬化,其CHD/LEAD的患病风险明显增加。不同年龄水平的颈动脉斑块患者CHD/LEAD患病的影响因素不同。
Objective: To evaluate the relationship between large artery elastic function and coronary heart disease (CHD) or lower extremity arterial disease (LEAD) in patients with carotid plaque.Me-thods: A total of 491 patients with carotid plaque were enrolled into the study with complete data of arterial stiffness detection and blood test [male: 208 and female: 283, and mean age: (61.66±11.60) years]. All the subjects were divided into 2 groups according to CHD or LEAD, namely non-CHD&LEAD group (neither CHD nor LEAD) and CHD/LEAD group (either CHD or LEAD). Accor-ding to the mean age level (age<61.66 years or age>61.66 years), the independent association was analyzed between higher large arterial stiffness (carotid-femoral pulse wave velocity, CF-PWV, CF-PWV>9 m/s) and CHD/LEAD.Results: In the present research population, the mean level of arterial stiff-ness was high (the mean CF-PWV was 10.71 m/s), and 76.6% of them had arteriosclerosis, and 36.9% CHD/LEAD. The age, male and smoking proportion, systolic blood pressure (SBP), glycosyla-ted hemoglobin (HbA1c), homocysteine (Hcy), creatinine (Cr), CF-PWV, prevalence rate of hypertension and diabetes mellitus, medication on hypertension, diabetes and hyperlipidemia were higher in CHD/LEAD group, and total cholesterol (TC), high density lipoprotein cholesterol (HDL-C), and low density lipoprotein cholesterol (LDL-C) were lower in CHD/LEAD group than in non-CHD&LEAD group (all P<0.05).In multivariate Logistic regression analysis, the results showed that in the patients with age below 61.66 years, large artery stiffness (CF-PWV>9 m/s) was an independent risk factor of CHD/LEAD ( OR=3.229, 95% CI 1.156-9.022, P<0.05); In the patients with age above 61.66 years, there was no independent association between large artery stiffness and CHD/LEAD ( P>0.05).Conclusion: The large artery elasticity function in the patients with carotid plaque was poor. In the patients with carotid plaque and higher large artery stiffness below 61.66 years, the risk of the prevalence of CHD/LEAD was increased significantly than with normal arterial stiffness. In the patients with carotid plaque below or above 61.66 years, the independent influencing factors on the prevalence of CHD/LEAD were different.
动脉结构出现狭窄或闭塞常引起心脏和血管疾病, 如冠心病(coronary heart disease, CHD)或下肢动脉疾病(lower extremity arterial disease, LEAD)。动脉僵硬度能够反映血管的弹性功能状况, 与多种心脏和血管疾病有关, 是血管事件及死亡的独立预测因子。颈-股动脉脉搏波传导速度(carotid-femoral pulse wave velocity, CF-PWV)是动脉僵硬度评估的金标准, 中国血管病变早期检测技术应用指南、欧洲高血压学会/欧洲心脏病学会高血压管理指南以及最新的血管健康分级标准均推荐将CF-PWV作为常规临床检测[1, 2, 3]。
颈动脉超声检测颈动脉内-中膜厚度及斑块是评估亚临床动脉粥样硬化的主要手段, 研究表明, 颈动脉斑块与多种血管疾病有关, 也是未来心血管事件的危险因素和独立预测因子[4]。颈动脉斑块负荷是冠状动脉(以下简称冠脉)钙化最强烈的预测因子[5], 较高颈动脉斑块负荷的人群其主要不良心脏事件的发病率增高[6]。此外, 低回声、中到大的斑块与未来心血管事件的发生风险密切相关[7], 低回声的颈动脉斑块发生缺血性脑血管事件的风险增加, 且独立于狭窄程度和心血管危险因素[8]。
目前多数研究集中在动脉僵硬度或颈动脉斑块与心血管疾病的关系[6, 9, 10], 较少见将这两个指标联合用于研究二者与CHD和LEAD关系的报道。本研究拟对存在颈动脉斑块的人群进行分析, 探讨其血管弹性功能状况(动脉僵硬度水平)对CHD或LEAD患病影响及其年龄差异性。
选择2012年3月至2016年3月期间在北京大学首钢医院门诊和病房就诊, 经颈动脉超声检查存在颈动脉斑块, 但未造成管腔狭窄或管腔直径狭窄率< 50%的人群, 最终491例主要资料(包括颈动脉超声检查、动脉僵硬度检查及血脂、血糖、超敏C反应蛋白等生化检查)完整者入选, 其中男208例、女283例, 平均年龄(61.66± 11.60)岁。排除标准:肝、肾功能严重异常, 严重心力衰竭, 癌症。所有入选人群均参与问卷调查获取年龄、性别、身高、体重、吸烟史、服药情况、既往史等一般资料, 接受血生化检查, 并进行动脉僵硬度检查。
本研究获得北京大学首钢医院医学伦理委员会批准, 且所有研究对象均签署知情同意书。
本研究为横断面回顾性分析, 入选人群按照有无CHD或LEAD分为两组:无CHD和LEAD组, 记为无病组; 有CHD或LEAD组, 记为CHD/LEAD组。
1.3.1 CHD诊断标准[11] (1)典型的心绞痛症状并排除主动脉瓣病变; (2)有明确的陈旧性心肌梗死病史; (3)有明确的急性心肌梗死病史(症状/心电图+心肌酶谱升高); (4)冠脉造影或冠脉CT造影提示≥ 70%的冠脉管腔狭窄; (5)经皮冠脉介入治疗及冠脉搭桥术。
1.3.2 LEAD诊断标准[12] 任一下肢踝臂指数(ankle brachial index, ABI)≤ 0.9即可诊断为LEAD, ABI测定由动脉功能检测仪自动测出。
问卷调查内容包括入选患者的年龄、性别、吸烟史(既往吸烟史、目前已戒烟或目前正在吸烟均视为有吸烟史, 从未吸烟即为无吸烟史), 相关疾病史包括高血压、糖尿病, 服药情况主要包括高血压药物、糖尿病药物及高脂血症(他汀类)药物的服用情况。
所有患者均取清晨8:00肘静脉空腹血5 mL, 应用全自动生化分析仪(AU5810和AU680)检测总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、空腹血糖(fasting plasma glucose, FPG)、超敏C反应蛋白(high sensitive C reactive protein, hs-CRP)、尿酸(uric acid, UA)、肌酐(creatinine, Cr)、同型半胱氨酸(homocysteine, Hcy)、糖化血红蛋白(glycosylated hemoglobin , HbA1c), 实验室检测采用标准方法, 由北京大学首钢医院检验科完成。
应用动脉硬化自动测定装置Compliar SP(Artech Medical, France)检测CF-PWV, 即通过测量颈动脉和股动脉节段脉搏波传导时间和两个记录部位的体表距离而求得, 传导时间t为两个波形的时间差, 距离L是两个探测器间的距离。嘱受检者采取平卧体位休息5 min, 选择右侧颈总动脉和股动脉作为测量部位, 沿动脉的体表走行位置探查动脉搏动最明显处, 将压力感受器置于颈动脉和股动脉搏动最明显处, 测量这两点的体表距离并输入计算机, 仪器自动进行CF-PWV的计算。根据中国指南[1]推荐, CF-PWV> 9 m/s可以诊断为动脉硬化。
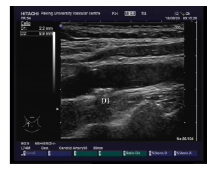
按照指南[1, 13]推荐, 受检者取平卧位, 应用配备7.0~12.0 MHz线阵探头的高分辨超声装置(EUB-7500, Hitachi), 选取双侧颈总动脉主干、颈总动脉分叉部、颈内动脉和颈外动脉颅外起始段为检查部位, 进行横断面和纵断面扫描以检查是否存在颈动脉斑块, 血管纵断面扫描及横断面扫描时均可见该位置存在突入管腔的回声结构或突入管腔的异常血流缺损, 局部内膜中层厚度> 0.13 cm即定义为存在颈动脉斑块(图1)。
采用VS-1000装置(Fukuda Denshi Co. LTD, Japan), 将四肢血压袖带缚于上臂及下肢踝部, 2个电极分别置于双腕部以采集心电信号, 微型麦克风置于胸骨体以采集心音信号, 仪器自动检测并计算ABI值。此外, 该设备还能自动检测得到右上肢收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)及心率(heart rate, HR)。
应用SPSS 20.0统计软件进行统计分析, 正态分布的计量资料数据描述以均数± 标准差表示, 非正态分布的计量资料变量(如hs-CRP和HbA1c)以中位数(25%位数, 75%位数)表示, 计数资料数据描述以例数(百分比)表示, 正态分布的计量资料的组间比较采用t检验, 非正态分布的计量资料采用Mann-Whitney U秩和检验, 计数资料的比较采用卡方检验。单因素分析筛选进入Logistic多因素分析以P< 0.1为检验水准, 应用Logistic回归分析, 以向后步进(似然比)法作为自变量筛选方法, 步进概率:α 进入=0.05, α 删除=0.05, 进行多因素分析, 筛选不同年龄水平的CHD或LEAD患病的独立影响因素, P< 0.05(双侧)为差异有统计学意义。
本组患者大动脉硬化水平较高(平均CF-PWV是10.71 m/s), 在颈动脉斑块人群中76.6%存在大动脉硬化, 36.9%存在CHD或LEAD。比较无病组与CHD/LEAD组患者的一般临床资料, 结果提示, CHD/LEAD组的年龄、男性比例、吸烟比例、SBP、HbA1c、Hcy、Cr和CF-PWV水平, 以及高血压、糖尿病患病率, 降压药、降糖药和降脂药的服药率均显著高于无病组, 而TC、HDL-C和LDL-C显著低于无病组(表1)。
| 表1 无病组和CHD/LEAD组颈动脉斑块人群的一般临床资料比较 Table 1 Comparison of general clinical characteristics between non-CHD& LEAD group and CHD/LEAD group |
经单因素分析及专业判断, 初步筛选出CHD/LEAD的可能影响因素纳入Logistic多因素分析。既往研究结果提示, 动脉硬化水平随着年龄不断增加[14], 其他危险因素共同作用促进其临床进展, 因此, 本研究按照本组人群平均年龄水平(61.66岁)分两个年龄段进行多因素分析建模, 即年龄< 61.66岁和年龄> 61.66岁。采用Logistic回归分析CHD/LEAD与年龄、性别、体重指数(body mass index, BMI)、吸烟、SBP、DBP、FPG、TC、TG、HDL-C、LDL-C、hs-CRP、HbA1c、Hcy、Cr、UA、CF-PWV, 高血压和糖尿病的患病率, 以及降压药、降糖药和他汀药物的服药率之间的关系。
Logistic回归分析结果提示, 在年龄< 61.66岁的颈动脉斑块患者中, 最终进入Logistic回归模型的是X1(年龄)、X3(BMI)、X4(吸烟)、X10(HDL-C)、X17(CF-PWV> 9 m/s)、X21(降糖药)和X22(他汀药), 拟合的Logistic回归方程为:logit(P)=-17.121+0.113X1+0.193X3+2.202X4+1.677X10+1.172X17+2.560X21+2.149X22, 因此, 在年龄< 61.66岁的颈动脉斑块患者中, 大动脉硬化(CF-PWV> 9 m/s)是CHD或LEAD患病的独立影响因素。在年龄> 61.66岁的颈动脉斑块患者中, 最终进入Logistic回归模型的是X7(FPG)、X11(LDL-C)、X12(hs-CRP)、X13(HbA1c)、X14(Hcy)和X15(Cr), 拟合的Logistic回归方程为:logit(P)=0.063-0.599X7-0.982X11+0.040X12+1.178X13+0.092X14-0.026X15, 因此, 在年龄> 61.66岁的颈动脉斑块患者中, 大动脉硬化对于CHD或LEAD患病无独立影响关系。
根据回归系数检验(包括单一回归系数的Wald检验和回归系数整体似然比的检验, P< 0.05)、Logistic回归模型拟合优度的Homser-Lemeshow检验(P> 0.2)和预测准确度的检验(Cox-Snell广义决定系数和Nagelkerke广义决定系数), 最终拟合的以上两个模型为“ 最优” 模型, 即回归系数对于拟合的模型有意义, 模型的拟合效果好, 预测的准确性较高(表2~4)。
| 表2 CHD/LEAD影响因素的变量意义及赋值 Table 2 The meaning and encoding of possible variables associated with CHD/LEAD |
| 表3 年龄< 61.66岁CHD/LEAD影响因素的多因素Logistic回归分析结果 Table 3 The multivariate Logistic regression analysis of influencing factors on CHD/LEAD in patients below 61.66 years old |
| 表4 年龄> 61.66岁CHD/LEAD影响因素的多因素Logistic回归分析结果 Table 4 The multivariate Logistic regression analysis of influencing factors on CHD/LEAD in patients above 61.66 years old |
目前研究已经证明, 动脉僵硬度和颈动脉斑块分别是未来心血管事件的独立预测因子, 但关于二者结合的共同效应, 即是否存在颈动脉斑块且同时存在全身大动脉硬化的患者, 其CHD或LEAD的患病风险有所增加, 且二者关系是否在不同年龄水平有所差异, 目前少有研究探讨。因此, 本研究初步分析了颈动脉斑块患者有无大动脉硬化对于CHD或LEAD患病的影响及其年龄差异性。
本研究结果提示, 在颈动脉斑块患者中, 大动脉硬化水平较高(平均CF-PWV为10.71 m/s), 其中76.6%存在大动脉硬化, 36.9%存在CHD或LEAD。患有CHD或LEAD的患者较无CHD和LEAD的人群, 其传统的心血管危险因素水平均存在差异, 高血压和糖尿病的患病率及其服药率显著较高。但CHD或LEAD患者可能因服用他汀药物的影响, 其血脂(TC、LDL-C和HDL-C)水平普遍较低。此外, FPG、HbA1c以及SBP水平在疾病组也较高。根据平均年龄水平, 本研究将患者分为两组(年龄< 61.66岁和> 61.66岁), 分别分析两个年龄段CHD或LEAD患病的独立影响因素, 结果提示, 年龄< 61.66岁的颈动脉斑块人群, 合并大动脉硬化者其CHD或LEAD的患病风险较大动脉弹性正常者增加2倍以上, 此外, CHD或LEAD患病的独立影响因素还包括年龄、BMI、吸烟、HDL-C、降糖药和他汀药物, 除年龄、BMI和吸烟这些为人们所共识的危险因素外, HDL-C、降糖药和他汀药物也是危险因素, 且OR值较高, 提示该人群的血糖和血脂水平应该尽量通过饮食或运动等非药物来控制, 但还需要进一步的研究来确定。
在年龄> 61.66岁的颈动脉斑块人群中, 大动脉硬化对于CHD或LEAD的患病影响不再具有独立作用, 而最终具有独立影响作用的是FPG、HbA1c、LDL-C、hs-CRP、Hcy和Cr, 其中FPG、LDL-C和Cr是负相关关系, 但并不是越低越好, 而是应该根据个人差异控制在适当水平。细胞膜的基本支架是由磷脂双分子层构成的, 主要成分是蛋白质和脂质, 疾病组的血脂水平均偏低, 服用他汀药物的比例较高, 且服用他汀药物是患病的危险因素, 从而推测血脂水平降低到一定程度可能会影响细胞膜的组分, 发生细胞水平改变, 进而到组织器官, 引起患病差异。因此, 本研究结果提示, 在临床实践中, 不仅要评估血管结构变化(如是否存在颈动脉斑块), 还要评估全身大血管弹性功能状况(如动脉僵硬度水平), 此外, 对于不同年龄段的颈动脉斑块人群, 其治疗策略的侧重可能需要有所差异, 控制在个体的适当水平。
国内外关于血管病变的评估, 大多研究单一指标的预测价值, 少有研究将血管结构和功能状况的评估指标进行结合, 综合评估血管健康状况。血管超声检查颈动脉斑块作为全身亚临床动脉粥样硬化的观察窗口, 有助于识别处于进展期的亚临床动脉粥样硬化的无症状人群[10], 且能独立预测心血管事件, 将其增加到传统的危险因素模型中后, 能够提高CHD事件的风险预测价值[4, 9]。既往无心血管疾病的人群中, 不管有无高血压或糖尿病, 颈动脉斑块与心血管事件的发生均独立相关[15]。关于动脉僵硬度的研究, 目前已经确定了其对于未来心血管事件的独立预测价值, 且优于传统的心血管危险因素[16], 将其增加到传统的危险因素模型中能够提高风险预测价值[17]。此外, 脉搏波传导速度与认知功能障碍有关, 且独立于可改变的心血管危险因素[18], 是健康人群CHD和卒中的独立预测因子[19]。
迄今为止, 也有一些关于动脉结构和功能病变之间关系的研究。关于颈动脉斑块对于颈动脉流体力学特性的影响研究结果提示, 颈动脉斑块能够影响局部血管的僵硬度和弹性效应[20]。由CF-PWV反映的大动脉僵硬度与颈动脉斑块的存在与否及其严重性显著相关[21], 而且斑块回声不同, 其与大动脉僵硬度的关系不同, 仅强回声斑块而不是低回声斑块与大动脉僵硬度有关[22]。另外, 较高的脉搏波传导速度与超声检测的颈动脉粥样硬化斑块的患病率以及斑块内出血显著独立相关[23]。另有研究通过随访10年的观察发现, 基线时颈动脉或股动脉斑块的出现对于心血管事件的预测价值相似, 并且同时存在颈动脉和股动脉斑块者其未来发生心血管事件的风险进一步增加[24], 与本研究结果相似, 多部位存在动脉粥样硬化的风险较单一部位存在的风险增加。然而, 关于动脉结构和功能病变同时存在对于血管系统的影响还需要进一步研究。
本研究的优势在于对目前临床常见的颈动脉斑块人群的血管结构和功能等不同方面进行综合分析研究, 探讨同时合并血管结构和功能病变人群的CHD或LEAD患病状况。但本研究也存在一定的缺陷:首先, 本研究为横断面观察性研究, 因此, 关于同时合并颈动脉斑块和动脉硬化者对于CHD和LEAD的患病风险是否具有预测价值, 还需要进一步的随访研究。其次, 本研究入选人群为颈动脉超声检查存在颈动脉斑块者, 我们仅关注了斑块的有无, 并未对斑块的部位、大小、稳定性等进行深入探讨。因此, 关于同时合并血管结构和功能病变是否对于未来血管事件具有预测价值, 还需要进一步的随访研究来确定。
本研究初步探讨了同时合并血管结构和功能病变与CHD或LEAD患病的关系, 研究结果提示:颈动脉斑块患者的大动脉弹性功能普遍较差, 其中76.6%的患者存在全身大动脉硬化, 36.9%存在CHD或LEAD。年龄< 61.66岁的颈动脉斑块人群若同时合并大动脉硬化, 其CHD或LEAD的患病风险是无动脉硬化者的3.229倍, 且独立于传统的危险因素及药物服用情况。不同年龄水平的颈动脉斑块患者, 其CHD或LEAD患病的独立影响因素不同。
综上, 本研究结果提示, 改善动脉粥样硬化患者大动脉弹性功能可能是预防未来心血管事件的有效策略, 不同年龄的颈动脉斑块患者的干预策略可能需要区别对待, 且应控制在个体适宜水平。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|