目的 采用微剪切方法分析不同浓度碳二亚胺[1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC]乙醇溶液处理牙本质表面对自酸蚀粘接剂粘接强度和断裂模式的影响。方法 收集离体健康智齿80颗,随机分为5组,每组16颗。低速切割机暴露牙合面中层牙本质后使用两步法自酸蚀粘接剂(Clearfil SE Bond)进行牙本质粘接,所有试件设计为粘接半径1 mm、高3 mm的树脂柱试件。粘接时除空白组按常规步骤完成粘接外, 其余4组在Ⅰ液(底涂剂)处理后,分别采用3种浓度(0.01 mol/L、0.3 mol/L、0.5 mol/L)的EDC乙醇溶液和乙醇溶剂对牙本质表面处理1 min 后涂布Ⅱ液(粘接剂)完成粘接。将所有试件放入含0.5%(质量分数)氯胺T生理盐水浸泡24 h后进行微剪切实验,并在体式显微镜下观察试件断裂模式。结果 0.01 mol/L、0.3 mol/L、0.5 mol/L EDC处理组、乙醇溶剂处理组的即刻微剪切粘接强度分别为(35.29±8.97) MPa、(40.24±9.68) MPa、(37.38±9.66) MPa、(37.49±7.76) MPa,高于空白组(33.81±7.98) MPa,各组差异均无统计学意义( P>0.05);断裂模式在各组间差异也无统计学意义( P>0.05)。结论 不同浓度的EDC乙醇溶液处理对牙本质自酸蚀粘接剂的即刻粘接强度、断裂模式没有影响。
Objective: To evaluate the bonding ability of one representative self-etch adhesive system by applying the micro-shear bond strength test method with different concentrations of carbodiimide [1-ethyl-3-(3-dimethylaminopropyl) carbodiimide, EDC] ethanol solution pretreatment.Methods: Extracted sound human third molars were collected from patients ranging 18 to 40 years. In the study, 80 molars were first sectioned to prepare a flat middle coronal dentin surface and then were randomly divided into 5 groups ( n=16) according to without/with different surface treatments [blank control; 80% (volume fraction) ethanol control; EDC ethanol solution of three concentrations (0.01 mol/L, 0.3 mol/L and 0.5 mol/L)]. Each specimen underwent a micro-shear bond strength test and failure mode observation. The data collected were subjected to statistical analysis using one-way ANOVA and post hoc Tukey’s test to analyze the difference of the micro-shear bond strength, and chi-square test/Fisher’s exact test for the failure mode frequency of the micro-shear bond strength test specimens at a significance level of P=0.05.Results: The micro-shear bond strength of the three concentration EDC treatments were (35.29±8.97) MPa (0.01 mol/L EDC treatment group), (40.24±9.68) MPa (0.3 mol/L EDC treatment group), (37.38±9.66) MPa (0.5 mol/L EDC treatment group) separately; and that of the 80% ethanol group was (37.49±7.76) MPa. All micro-shear bond strength value of the above four groups was statistically higher than that of the blank control group [(33.81±7.98) MPa]. The immediate micro-shear bond strength and failure mode was of no statistically significant difference among all the groups. It was noticed that the immediate micro-shear bond strength of 0.3 mol/L was higher than that of all the other groups, especially higher than that of the 80% ethanol pretreatment group despite that there was no significant difference among all the groups. And the test of failure mode indicated that the cohesive failure was more common, while the frequency of adhesive failure was rare in each experimental group.Conclusion: EDC pretreatment had no adverse effect on the immediate micro-shear bond strengths of Clearfil SE Bond. Meanwhile, EDC treatment did not cause more adhesive failure in immediate micro-shear test, which had further denoted what was said above. However, it needs more research to illustrate the anti-enzymatic role of EDC in dentin bonding.
牙本质粘接老化一直是口腔医学领域多学科所共同面临的问题, 近年来国内外许多学者就牙本质粘接老化机制、如何提高粘接界面的稳定性和耐久性进行了大量的研究[1]。化学交联剂碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl)carbodi-imide, EDC]可激活蛋白质中谷氨酸和天冬氨酸的羧基团, 并与之偶联, 不可逆地改变肽的三维结构, 可降低激酶催化中心的自由度[2, 3], 降低其催化功能, 提高牙本质粘接的耐久性[4]。本研究采用微剪切粘接强度和体视镜下观察试件断裂模式的试验方法, 探讨牙本质表面经EDC处理对自酸蚀粘接剂应用的影响。
使用精密电子天平(AL104-IC, Mettler-Toledo, Switzer-land)称取EDC晶体(国药集团化学试剂有限公司), 加入80%(体积分数)乙醇溶剂(北京大学口腔医院制剂室)配制2 mol/L EDC 处理剂, 并稀释为0.5 mol/L、0.3 mol/L和0.01 mol/L的 EDC 处理剂, 于4 ℃下避光保存, 2 d内使用。
本研究经北京大学口腔医院生物医学伦理委员会批准(PKUSSIRB-201523093)。于北京大学口腔医院颌面外科收集18~40岁患者拔除的离体第三磨牙80颗, 要求牙体组织完整、无龋坏和充填体、无严重牙周病、无明显磨耗和裂纹。离体牙拔除后手术刀刮除附着的牙周软组织, 生理盐水清洗后即刻放置于4 ℃含有0.5%(质量分数)氯胺T的生理盐水中储存, 1个月内使用。
将80颗离体牙随机分为5组(未处理组, 80%乙醇溶剂处理组, 0.01 mol/L、0.3 mol/L、0.5 mol/L EDC处理组), 每组16颗。
流水下使用金刚砂车针(Dia-Burs, MANI, Japan)磨除离体牙牙合面牙釉质, 丙烯酸自凝树脂包埋, 研磨机依次120#、200#、400#、600#水砂纸(熊猫牌, 北京东新研磨工具有限公司)流水下研磨30 s, 暴露中层牙本质(图1)。
1.3.1 未处理组 将已准备好的试件牙合面干燥, 固定于有聚四氟乙烯对开模具的定制粘接装置(北京大学口腔医院材料研究所提供)中(图2、3), 采用Clearfil SE Bond (Kuraray, Osaka, Japan)进行粘接。粘接时, Ⅰ 液处理20 s后, 无水无油气枪吹干, 涂布Ⅱ 液, 轻吹匀, 在牙本质表面形成均匀的薄层粘接剂, LED灯(EliparFreeLight2, 3M Espe, Seefeld, Germany)固化10 s, 光强为1 200 mW/cm2。分层堆塑Clearfil AP-X(A2)(Kuraray, Osaka, Japan)复合树脂, 每层约1.5 mm, 共2层, 分层固化20 s, 最终形成高约3 mm的树脂圆柱, 粘接半径设计为1 mm。分离对开模具, 取出试件, 室温下放置, 待测(图4)。
1.3.2 80%乙醇溶剂处理组 采用与未处理组同样的方法固定试件, 在Clearfil SE Bond Ⅰ 液处理20 s并吹干, 分两次将乙醇溶剂均匀涂布在牙本质表面保持湿润1 min, 使用小海绵蘸取多余液体, 涂布Ⅱ 液, 其后处理同未处理组。
1.3.3 EDC处理组(0.01 mol/L、0.3 mol/L、0.5 mol/L) 采用与未处理组同样的方法固定试件, 在Clearfil SE Bond Ⅰ 液处理20 s并吹干, 分两次将新鲜配制的0.01 mol/L、0.3 mol/L、0.5 mol/L EDC乙醇溶液均匀涂布在牙本质表面保持湿润1 min, 使用小海绵蘸取多余液体, 涂布Ⅱ 液, 其后处理同未处理组。
粘接完成的试件储存于37 ℃含0.5%氯胺T的生理盐水24 h后, 固定于特定的剪切夹具上(图5), 将夹具置于万能力学试验机(Shimadzu EZ-L, Kyoto, Japan)上, 以加载头速度为1 mm/min, 加载力为50 N进行加载(图6), 直至试件断裂, 记录断裂时的剪切力值(force, F)。微剪切粘接强度(micro-shear bond strength, μ -SBS)计算公式为:μ -SBS=F/(π r2), 其中μ -SBS单位为MPa, F单位为N, r单位为mm。
使用体式显微镜 (SMZ 1500, Nikon, Tokyo, Japan)10倍下观察粘接试件断裂模式并记录。断裂模式分为3类:发生在粘接界面的粘接断裂; 发生于树脂内部或者牙本质内部的内聚断裂; 部分发生在粘接界面、部分发生在树脂或牙本质层的混合断裂。
试验结果采用统计软件IBM SPSS 20.0(SPSS Inc, Chicago IL, USA)进行单因素方差分析(one-way ANOVA), 比较各组即刻微剪切粘接强度均值与总体的差异, 并采用Turkey法进行多重比较。采用卡方检验/Fisher确切概率法分析各组断裂模式试件数量分布的差异。检验水平为α =0.05, 统计单位为每个试件。
各组即刻微剪切粘接强度见表1。乙醇溶剂处理组、不同浓度EDC 处理组的微剪切粘接强度数值均高于未处理组, 但5组间的即刻微剪切强度差异无统计学意义(P=0.311)。
| 表1 即刻微剪切粘接强度的比较 Table 1 Comparison of immediate micro-shear bond strength |
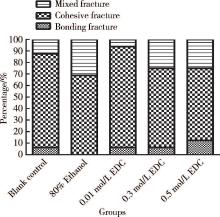
各组主要断裂模式均为发生在复合树脂和牙本质内部的内聚断裂, 发生数量明显高于其余两种断裂模式, 其次为混合断裂模式, 断裂发生在粘接界面的试件数量最少(表2)。统计学分析显示, 5组间的断裂模式构成比差异无统计学意义(P=0.576, 图7)。
| 表2 各组断裂模式的试件数量 Table 2 Failure mode distribution of all groups |
临床上, 修复体对侧向力的抵抗是修复体成功的关键, 稳定的剪切试验生物力学结果对临床具有重要指导意义。对粘接性的临床修复体而言, 剪切试验相较拉伸试验能更好地模拟口腔环境的受力, 修复体剪切强度是衡量粘接剂性能的重要指标。剪切实验试件制备中, 粘接后无需进行多次切割、成形、打磨等, 能更好地保存粘接界面的完整性, 避免了剪切实验前的疲劳失败[5, 6]。试件粘接面积越大, 越容易出现粘接界面缺陷, 受力时应力集中, 更容易发生粘接失败。本试验采用了微剪切试验的方法, 即采用定制粘接模具将粘接半径限定为1 mm的圆形区域, 在保证粘接试件一致性的同时, 提高了粘接界面的稳定性, 实验结果变异程度较小, 试验方法可靠。
牙本质粘接一直是牙科领域多学科所面临的挑战。近年来, 国内外学者做了大量研究以改善牙本质粘接, 其中外源性交联剂EDC的引入能够增强牙本质胶原纤维的机械性能, 提高混合层的稳定性与耐久性。本研究将EDC乙醇溶液用在Clearfil SE Bond Ⅰ 液之后, 结果显示各组之间即刻微剪切粘接强度差异无统计学意义(P=0.311), 说明Clearfil SE BondⅠ 液处理后的牙本质表面, 再经不同浓度的EDC乙醇溶液处理1 min, 对其即刻微剪切粘接强度没有影响。既往研究多采用全酸蚀粘接技术[7, 8, 9], 全酸蚀粘接技术可靠, 但操作步骤较多, 技术敏感性较高, 相对而言, Clearfil SE Bond是经典的两步法自酸蚀粘接剂, 在牙科领域广泛应用[10]。自酸蚀粘接剂的酸蚀、前处理、粘接均会提高健康牙本质中基质金属蛋白酶(matrix metalloproteinases, MMPs)的活性, 进一步对远期粘接强度造成影响, 如Ⅰ 液(底涂剂)处理后, 因无冲洗步骤, 粘接界面残余水相分子, 使Ⅱ 液(粘接剂)渗入不完全, 可能会形成“ 串珠” 样结构, 也即所谓的相分离, 造成粘接界面的缺陷。水也是EDC的良好溶剂, Clearfil SE Bond Ⅰ 液为水溶性, 为避免将EDC添加入Clearfil SE Bond Ⅰ 液后发生反应, 进而影响其预处理的效果, 我们将EDC乙醇溶液作为一种额外的处理液。研究表明, 乙醇湿粘接能够显著提高牙本质粘接的拉伸粘接强度[11]。本研究中, 试验组在牙本质达到处理时间后, 采用小海绵擦干牙本质表面, 防止残留过多的乙醇溶剂, 避免溶剂挥发后导致EDC晶体凝集进而影响粘接树脂的渗透。本研究中未处理组与乙醇溶剂处理组微剪切粘接强度差异无统计学意义, 可能是在使用乙醇处理牙本质表面时, 乙醇溶剂组也采用了同样的试验操作, 与研究者推荐的“ 乙醇湿粘接” 技术不同[12, 13], 不过试验结果中仍可看出乙醇溶剂处理组的微剪切粘接强度高于未处理组[(37.49± 7.76) MPa vs. (33.81± 7.98) MPa]。
本研究应用0.01 mol/L、0.3 mol/L、0.5 mol/L EDC处理剂对自酸蚀粘接中的牙本质表面进行处理1 min, 并不会影响牙本质粘接的即刻粘接强度, 与Mazzoni等[14]研究结果一致。关于EDC临床适宜的应用浓度和处理时间, 各类研究尚未形成共识, Scheffel等[15]采用0.5 mol/L、1 mol/L和2 mol/L EDC处理牙本质30 s或60 s, 发现EDC发挥交联效能具有时间依赖性和浓度依赖性。该课题组最近发表的研究发现0.5 mol/L EDC处理牙本质表面60 s相比30 s更能够保护粘接界面[16]。有研究表明, EDC/羟基丁二酰亚胺(nhydroxysuccinimide, NHS)水溶液处理1 h时效果更为明显[17, 18]。既往牙本质交联剂的处理时间较长, 通常为30 min以上, Tezvergil-Mutluay等[19]研究中选择5种不同的EDC浓度(0.01~0.3 mol/L)和5种不同处理时间(1~30 min), 结果发现高浓度的EDC能够更好地发挥其胶原纤维交联性能, 但其具有细胞毒性, 还会降低牙本质粘接的浓度[20]。我们发现EDC处理组微剪切粘接强度数值均高于未处理组, 且0.3 mol/L EDC组微剪切粘接强度数值还同时高于乙醇溶剂处理组, 但仍需要设定不同的浓度分组, 进一步探究EDC适宜的应用浓度。
本试验观察到, 断裂模式多为发生在树脂层或牙本质层的内聚断裂, 其次是混合断裂, 仅有少部分发生了粘接断裂。在进行统计时, 将牙本质内聚断裂同树脂内聚断裂合并为内聚断裂进行分析, 这是因为在试件制备时, 牙本质端是由丙烯酸自凝树脂进行包埋, 相较于树脂端抵抗外力的作用更大, 研究中体视显微镜下所观察到的内聚断裂大部分是树脂内聚断裂[21]。EDC介导交联的本质是EDC通过功能基团(RN =C=NR)与牙本质的胶原多肽中的谷氨酸或天冬氨酸的羧基反应, 生成O-酰基脲中间体, 继而直接与其他多肽的赖氨酸或羟赖氨酸的氨基反应, 形成肽键交联[2]。这种化学键的连接相对可靠, 本研究观察到各实验组间差异无统计学意义(P=0.576), 粘接断裂仅为极少数, 从侧面反映出EDC应用于牙本质表面处理时, 混合层可能不是牙本质粘接的薄弱点。
本研究存在着一定的局限性。研究表明, 除粘接面积外, 试件形状、模具性能、夹具种类、加载速度及方向、加载载荷等均影响剪切实验的结果[22]。我们基于同类研究及本试验室条件设定了实验的各项参数, 但体外试验无法替代体内试验, EDC在提高牙本质粘接的界面稳定性和抗酶解老化方面存在优异的性能, 但需设计老化试验进一步证实。综上, 本试验条件下, 基于此即刻力学和断裂模式观察的结果表明, 0.01 mol/L、0.3 mol/L、0.5 mol/L EDC对牙本质自酸蚀粘接剂Clearfil SE Bond的即刻粘接强度、断裂模式没有影响。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|