肺腺纤维瘤(pulmonary adenofibroma)是一种非常罕见的肺原发性上皮与间质双相分化的良性肿瘤,多为胸膜下的实性界清结节,上皮呈简单的腺样结构,偶有乳头或叶状结构,上皮周围围绕着丰富的间质,间质由温和的梭形细胞及胶原组成。在目前有限的病例报道中,尚未发现与肿瘤相关的复发与转移。由于既往报道极少,对此类疾病的认识不足,在冰冻组织病理诊断或穿刺组织病理诊断中,容易将其误诊为恶性病变。本文报道1例肺腺纤维瘤,患者为74岁女性,体检时发现左肺外周型肿物,近年缓慢增大,遂于胸腔镜下行肺叶楔形切除手术。肉眼观肿物呈类圆形,边界清晰,但无明显包膜,切面灰白质韧。显微镜下肿瘤由结构简单的腺样分化的上皮及形态温和的梭形细胞间质两种成分组成,每个间质细胞周围围绕着粗细不一的胶原束,偶见小的粗乳头状或叶状结构。免疫组织化学染色显示腺上皮与肺泡上皮表型一致,间质细胞CD34、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、CD99和雌激素受体(estrogen receptor, ER)阳性,S-100、平滑肌肌动蛋白(smooth muscle actin, SMA)以及间皮标记等均为阴性。短期随访患者无复发或转移表现。本文回顾了国内外已报道的相关病例,并对肺腺纤维瘤可能的组织学起源进行初步探讨。
SUMMARY Pulmonary adenofibroma is an extremely rare benign primary tumor of the lung with cha-racteristic bi-phasic differential pattern. They are usually sub-pleural solid pulmonary nodules with clear margins. The tumor is composed of glands and peri-gland stroma. The glands are often quite simple forming long and narrow tubules with uniformly monolayer lining cells. Combined papillary or phyllodes structures were reported in some cases. The stromal cells are spindle-shaped and look mild mixed with the collagen bands. Up till now only a few cases of pulmonary adenofibroma have been reported all over the world. And because of the limited recognition this tumor is easily misinterpreted as malignancy in frozen section or biopsy specimens. We reported a new case of pulmonary adenofibroma. The mass peripherally located in the left lobe of the lung found by chance in a 74-year-old woman. The patient underwent a wedge resection of the left lung by the thoracoscope because of the slowly gradual enlargement of the mass annually. An oval grayish-white nodule was sub-pleural located in the specimen with solid and rubbery texture but without a distinct capsule. Two distinct components of simple glands and mild spindle cell stroma were found to mix together uniformly under the microscope. Collagen bands of various widths evenly surrounded each stromal cell. A few small coarse papillae or phyllodes structures were randomly distributed in some area. The immunohistochemical staining pattern of the glandular cells was accordant with typeⅡalveolar epithelium. Stromal cells were positive with CD34; B-cell lymphoma-2 (Bcl-2) CD99and estrogen receptor (ER) while S-100 smooth muscle actin (SMA) and all the mesothe-lium markers were negative. The patient was disease free after the surgery although the follow-up time was only one year. Besides the new case above we also reviewed all the reported cases and tentatively discussed the probable histological origin of pulmonary adenofibroma.
肺腺纤维瘤(pulmonary adenofibroma)是一种非常罕见的肺原发性双相分化的良性肿瘤, 由Scarff等[1]于1944年首先描述了其病理类型, 并命名为肺的“ 纤维腺瘤” 。截至目前为止, 世界各国报道的具有完整文字和/或图片描述的病例总共不超过15例[1, 2, 3, 4, 5, 6, 7, 8, 9, 10]。目前认为该肿瘤的生物学行为属良性, 已报道的病例均未出现复发、转移或与疾病相关的死亡。由于此类病例罕见, 目前该类型还未被收录至最新的《WHO肿瘤分类— — 肺、胸膜、胸腺及心脏分册》中[11]。本文报道1例新发病例, 提供了详实的临床病理信息, 并对既往相关文献进行回顾, 对肿瘤可能的组织学起源进行初步探讨。
患者女性, 74岁, 2010年3月体检发现左肺上叶肿物, CT显示左肺上叶脏层胸膜下直径9 mm的单发结节, 类圆形, 边界清晰, 因无自觉症状, 未予治疗。2014年1月复查时发现左上肺肿物增大至12 mm, 并在右肺出现小的新发结节。2015年9月复查时, 左上肺肿物继续增大至15 mm, 右肺肿物直径6 mm, 双侧肿物均边缘光滑, 类圆形。患者有高血压、2型糖尿病病史, 既往曾因胆囊结石行胆囊切除术。
患者为求进一步诊治于我院就诊, 并于2015年9月行胸腔镜下左肺上叶楔形切除术。术中见患者左肺叶间裂发育不全, 肿物位于左肺固有上叶及舌叶交界处肋骨面, 紧邻脏层胸膜。
组织标本固定于10%(体积分数)中性缓冲甲醛溶液, 石蜡包埋, 常规制片, HE染色。免疫组织化学染色采用手染法, 使用Dako公司GTVisionTM+检测系统。一抗Ber-EP4、CD34、雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、S-100、calretinin、WT-1及D2-40购自基因科技(上海)有限公司, B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、CD99、平滑肌肌动蛋白(smooth muscle actin, SMA)及Ki-67购自Dako公司, 甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)、Napsin A及雄激素受体(androgen receptor, AR)购自北京中杉金桥生物技术有限公司, 人骨髓内皮细胞标记物1(human bone marrow endothelial cell-1, HBME-1)购自福州迈新生物技术开发有限公司。免疫组织化学染色的阳性信号均为棕色。
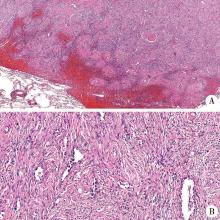
送检左肺上叶楔形切除标本中见类圆形肿物一个, 边界清晰, 但无明显包膜, 灰白色、实性、质韧, 最大径18 mm。显微镜下肿瘤由上皮及间质两种成分组成, 上皮在肿瘤内部分布相对稀疏但较为均一, 排列成腺泡或拉长的腺腔样结构, 可有简单的分支形成, 偶见小的粗乳头状或叶状结构(即上皮包裹纤维性间质共同突入腺腔内, 似乳腺叶状肿瘤的生长方式)。腺上皮均为单层, 上皮细胞呈扁平、矮立方或钉突样, 多数细胞形态一致而温和, 核小, 胞质少且透亮, 但少数细胞体积偏大, 核染色偏深, 偶见大核仁, 上皮细胞的核非典型性在冰冻组织切片的上皮表现更为明显。间质由形态温和的梭形细胞组成, 细胞核椭圆形、梭形或纤细波浪状, 胞界不清, 细胞周围围绕着粗细深浅不一的胶原束。部分区域可见明显的间质细胞围绕腺体呈靶环样排列的分布方式。部分区域间质细胞较稀疏, 胶原化明显, 腺体分布也稍显稀疏; 其余区域腺体及间质细胞稍显丰富, 间质细胞核稍肥胖, 但形态仍较温和, 核分裂象罕见, 局部可见肥胖的间质细胞更趋向于分布在远离腺体区域的现象, 伴有出血, 而紧邻腺体的间质细胞更加成熟稀疏。间质内可见少量散在或小灶状分布的淋巴、浆细胞。肿物周围边界较清楚, 但缺乏纤维性包膜, 肿物周边部分区域可见肺泡上皮围绕肿物的现象(图1)。
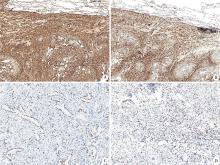
TTF-1(腺体+), Napsin A(腺体+), Ber-EP4(腺体+), CD34(间质+), Bcl-2(间质+), CD99(间质+), SMA(-), S-100(-), ER(多数间质细胞及少数腺上皮+), PR(-), AR(-), calretinin(-), HBME-1(-), WT-1(-), D2-40(-), Ki-67(腺体及间质仅极个别细胞+), 见图2。
最终的病理诊断为肺腺纤维瘤。
患者术后无进一步治疗, 目前术后12个月, 恢复良好, 尚未出现与肿瘤相关的复发或转移表现。
肺的腺纤维瘤是一种非常罕见的肺原发性双相分化的肿瘤, 由于此类病例罕见, 目前对此类疾病的认识尚在经验积累中。
临床上, 该病患者男性多于女性, 发病年龄多为50~70岁, 但也有20多岁的年轻人[6, 8, 10], 本病例为目前已知报道的发病年龄最大的患者。患者多无自觉症状, 检查时偶然发现, 但也可出现胸痛、咳嗽、喀血等症状, 临床症状与肿瘤的大小及位置有关。影像学上多表现为肺的外周型肿物, 境界清楚, 常位于胸膜下, 直径大小不一, 多数小于3 cm, 目前国外文献报道的肿瘤最大直径为8.8 cm[5], 国内报道的最大直径为10 cm[6], 有研究者认为体积偏大的肿瘤更易发生于年轻患者[10]。
大体上, 肿瘤呈灰白质韧而界清的肿物, 位于肺实质内, 常紧邻胸膜, 切面实性或囊实性。组织学上, 肿瘤呈明显的腺体和梭形细胞间质的双相分化。腺体呈腺泡样、小管样、裂隙样、囊腔样, 或有简单的分枝结构, 腺上皮由单层矮立方至柱状上皮组成, 形态温和, 异型性轻微。间质细胞为温和一致的梭形细胞, 有围绕在腺体周围的趋势。间质细胞较稀疏, 伴有多少不等的胶原形成。
部分病例显示上皮和间质共同形成复杂程度不等的乳头状或分叶状结构[3, 4, 5, 6, 8, 10], 该结构较显著时可同时伴有囊性结构形成[10], 这种结构的出现使得医师联想到乳腺中的叶状肿瘤或卵巢的腺纤维瘤, 而后二者为人体内较为常见的纤维上皮性肿瘤(fibroepithelial tumor, FET), 且均发生于女性激素依赖的器官。
免疫组织化学显示上皮与间质呈现截然不同的分化, 上皮表型符合肺泡Ⅱ 型上皮, 即TTF-1、Napsin A阳性, 且混合CK、EMA、CK7、Ber-EP4等上皮标记阳性, 而上述标记在间质中均为阴性。间质细胞恒定表达波形蛋白(vimentin), 也可出现CD34、SMA、CD99及Bcl-2的阳性表达, 但阳性概率依次递减[10]。S-100、HMB45及间皮标记未见阳性报道。
肺腺纤维瘤这一诊断名词最早的提出者Scarff等[1]认为它是肺错构瘤的一种罕见亚型。Suster等[3]同意这一观点, 并认为肺腺纤维瘤是肺错构瘤的一种不成熟亚型, 因此不能进一步分化成更为成熟的软骨、脂肪、平滑肌成分。从目前已报道的肺腺纤维瘤的临床特征、间质细胞形态及免疫组织化学表达模式看, 它与好发于胸膜的孤立性纤维性肿瘤(solitary fibrous tumor, SFT)有一定的相似性, 并且由于其肿瘤内部可出现复杂的乳头样结构, 因此既往文献中曾把它描述成为SFT的乳头状/假乳头状亚型[4, 5]。但是, 肺腺纤维瘤内部的腺体成分显著, 是肿瘤的重要组成成分, 而SFT仅由纤维母细胞样分化的梭形细胞组成, 仅在肿瘤的周边可以见到少量陷入的肺泡上皮, 因此腺体成分是肺腺纤维瘤与SFT最显著的区别。另一个需要与肺腺纤维瘤鉴别的是双相分化的间皮瘤, 二者的好发部位相近, 且都具有腺样上皮及梭形间质两种成分, 但免疫组织化学染色可以将二者截然区分。
从组织学形态及免疫表型上看, 肺腺纤维瘤的间质成分应为纤维母细胞/肌纤维母细胞分化的肿瘤细胞, 细胞形态温和, 周围围绕着成熟度不同的胶原成分, 其间质成分的免疫表型与另两种相对常见的纤维母细胞/肌纤维母细胞性肿瘤, 即隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans, DFSP)和SFT很类似, 三者都可以表达CD34、Bcl-2及C
肺腺纤维瘤的上皮成分是否亦为肿瘤成分是另一个值得进一步探讨的问题。与之类似的是一个长期存在争议且尚未完全定论的学术问题, 即乳腺FET的上皮成分是否是真性肿瘤性成分[19, 20, 21]。已知乳腺间质有特化及非特化之分, 有研究者发现乳腺的特化性间质有诱导乳腺上皮生成及分化的能力[22]。虽然肺内不太强调特化性间质这个概念, 但肺的特定部位的间质也有发生特定类型肿瘤的偏好性, 如胸膜的SFT最早被认为是间皮瘤的一种特殊类型, 但后来的研究认为SFT起源于间皮下的间质, 是一种纤维母细胞分化的肿瘤[23]。此理论可以帮助理解为何仅在SFT周边可见少量掺入的肺泡上皮, 因为其起源于肺实质外的间质成分, 而肺腺纤维瘤中上皮和间质的和谐共存, 似乎提示了其间质的特殊性以及与上皮成分潜在的关联性, 这种关联性在SFT中不显著, 而在肺腺纤维瘤中得到了充分体现, 提示肺腺纤维瘤中的间质可能起源于肺内的某种特化的肺间质细胞。但是, 由于病例极其罕见, 肺腺纤维瘤的具体的起源及成瘤机制仍需进一步研究。
由于取材有限, 肺腺纤维瘤在组织穿刺活检或冰冻组织病理诊断时存在相当的困难, 此外由于上皮成分可出现一定程度的非典型性, 诊断中容易把肿瘤中的腺体成分误诊为恶性的肺腺癌, 而周围的间质成分误认为是癌刺激所致的纤维结缔组织反应, 而导致不必要的根治性手术[10]。正如本文图2所显示的, 肿瘤中部分上皮细胞有一定的核非典型性, 加之周围显著纤维化的间质, 在冰冻组织或活检组织中容易被误诊为促结缔组织增生的腺泡型肺腺癌。但是, 肺腺癌在影像学上呈现磨玻璃样或毛刺样的外观, 与肺腺纤维瘤的边界清晰的外观有着显著的差异, 此外, 在镜下肺腺纤维瘤具有核更加温和的单层腺管结构, 以及更加丰富的具有环绕腺管趋势的间质成分, 这些表现在完整切除的标本中更易观察。对于组织穿刺活检的标本, 鉴别困难时, 可以进一步做CD34、SMA、CD99及Bcl-2等的免疫组织化学检查以判断间质的类型, 还可加做P53、CEA等以判断上皮的良、恶性, 再加上中国比其他国家非小细胞肺癌患者表皮生长因子受体(epidermal growth factor receptor, EGFR)突变的概率高很多[24, 25, 26], 可加做EGFR基因检测以进一步鉴别良、恶性。
目前已知报道的十几例腺纤维瘤多数具有随访结果, 均无复发或与肿瘤相关的死亡报道, 本例患者术后时间尚短, 目前还未出现与肿瘤相关的复发或转移的表现, 上述资料均提示肺腺纤维瘤良性的生物学行为, 行肺楔形切除手术即可, 中央型或体积较大的肿瘤需行肺叶切除。肺腺纤维瘤确切的生物学行为仍需更多的病例进一步证实。
总之, 肺腺纤维瘤是一种肺原发性上皮间质双相分化的良性肿瘤, 好发于肺实质内邻近胸膜处。由于病例极其罕见, 目前尚未被收录于最新的《WHO肿瘤分类— — 肺、胸膜、胸腺及心脏分册》中[11]。肿瘤中间质细胞呈纤维母细胞/肌纤维母细胞分化, 形态温和, 具有围绕腺腔上皮或突向腺腔内形成乳头状或叶状结构的形态特征(似乳腺FET), 免疫表型与SFT或DFSP有一定的相似性。肺腺纤维瘤的组织学起源仍需进一步探究, 但生物学行为基本为良性, 多数情况下行肺楔形切除即可。值得注意的是, 不要在冰冻组织或穿刺标本上将其上皮成分误诊为肺腺癌而导致不必要的治疗, 免疫组织化学及基因检测有助于肿瘤类型的鉴别。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|