目的 探讨结肠癌细胞中组织因子/活性凝血因子Ⅶ(tissue factor/active coagulation factor Ⅶ,TF/FⅦa)通路与表皮生长因子受体(epidermal growth factor receptor,EGFR)通路之间是否存在交互作用。方法 在 KRAS野生型的HT-29及 KRAS突变型的LoVo结肠癌细胞中,以FⅦa活化TF/FⅦa通路,采用qRT-PCR、Western blot检测EGFR配体双调蛋白(amphiregulin,AREG)及表皮调节素(epiregulin,EREG)基因、蛋白表达改变;利用RNA干扰技术敲低TF表达后活化TF/FⅦa通路,检测其对 AREG、 EREG基因表达的影响,以证实FⅦa对AREG、EREG表达调节作用依赖TF。以表皮生长因子(epidermal growth factor,EGF)激活两细胞EGFR通路后,检测TF/FⅦa通路关键分子 TF、 FⅦ基因表达改变。结果 TF/FⅦa通路活化后,HT-29细胞 AREG、 EREG基因表达及EREG蛋白表达水平均较对照组显著下调( AREG、 EREG基因表达量分别为0.55±0.09 vs.0.99±0.09、0.67±0.10 vs.1.02±0.02,EREG蛋白表达量0.54±0.09 vs.1.04±0.13, P均<0.05);LoVo细胞 AREG基因表达及AREG、EREG蛋白表达水平较对照组显著上调( AREG基因表达量1.87±0.39 vs.0.93±0.23,AREG、EREG蛋白表达量3.09±0.73 vs.1.11±0.21、1.53±0.19 vs. 0.97±0.23, P均<0.05);TF敲低后均可部分阻断FⅦa对两细胞AREG、EREG表达调节作用;EGFR通路激活后,HT-29细胞 TF基因表达较对照组无显著变化, FⅦ基因表达未检测到,而LoVo细胞的 FⅦ及 TF基因表达均较对照组显著上调,表达量分别为1.53±0.23 vs.1.00±0.23、53.20±6.08 vs.1.00±0.15( P均<0.05)。结论 结肠癌LoVo细胞TF/FⅦa通路与EGFR通路的活化可分别上调另一通路的关键分子表达并发生交互作用, KRAS基因突变可能对该交互作用的发生发挥关键作用。
Objective: To preliminarily verify the cross talk between tissue factor/active coagulation factor Ⅶ (TF/FⅦa) and epidermal growth factor receptor (EGFR) pathways in human colon cancer cells in culture.Methods: FⅦa was treated to HT-29 ( KRAS-wild type) and LoVo ( KRAS-mutant) colon cancer cells to activate TF/FⅦa pathway, qRT-PCR and Western blot were used to detect the expressions of amphiregulin (AREG) and epiregulin (EREG), ligands of EGFR on mRNA and protein levels, respectively. After knocking down expression of TF by TF-targeted siRNA transfection, FⅦa was treated and mRNA expressions of AREG and EREG were detected to see whether the FⅦa-induced effects were dependent on TF. Expressions of mRNA of TF and FⅦ were detected by qRT-PCR following the activation of EGFR pathway by treatment with epidermal growth factor (EGF) to HT-29 and LoVo cells.Results: After TF/FⅦa pathway was activated, for HT-29 cells, expressions of AREG (on mRNA level) and EREG (both on mRNA and protein level) were significantly down-regulated versus those of control group, gene expressions of AREG and EREG were 0.55±0.09 vs.0.99±0.09, 0.67±0.10 vs.1.02±0.02, protein expressions of EREG were 0.54±0.09 vs.1.04±0.13, all P<0.05. For LoVo cells, expressions of AREG (both on mRNA and protein level) and EREG (on protein level) were significantly up-regulated versus those of control group, gene expression of AREG were 1.87±0.39 vs. 0.93±0.23, protein expressions of AREG and EREG were 3.09±0.73 vs.1.11±0.21, 1.53±0.19 vs.0.97±0.23, all P<0.05. The regulating effect of AREG and EREG mRNA expression by FⅦa in HT-29 and LoVo cells could both be partly blocked by knocking down TF expression. For HT-29 cells, activation of EGFR pathway induced no significant TF mRNA expression, FⅦ mRNA expression was not detected. However,for LoVo cells, activation of EGFR pathway induced significantly higher mRNA expressions of both TF and FⅦ, expressions were 1.53±0.23 vs.1.00±0.23, 53.20±6.08 vs.1.00±0.15, all P<0.05.Conclusion: In colon cancer cell LoVo, when activated, TF/FⅦa pathway and EGFR pathway could interact through upregulating the other pathway’s effectors, and mutant KRAS might play a critical role in the two pathways’cross talk.
组织因子(tissue factor, TF)是一相对分子质量为47的跨膜糖蛋白, 在人体多数器官中都有表达, 是启动外源性凝血的关键分子。此外, TF在众多恶性实体肿瘤中呈现异常高表达[1], 研究发现, 活化的凝血因子Ⅶ (active coagulation factor Ⅶ , FⅦ a)作为TF目前唯一明确的配体蛋白, 在多种癌细胞中与TF胞外域结合为TF/FⅦ a复合物后引发一系列胞内信号通路, 并最终促进肿瘤细胞侵袭、转移[2, 3, 4, 5, 6]。表皮生长因子受体(epidermal growth factor receptor, EGFR)的异常活化通过其下游通路最终促进包括结直肠癌在内的多种肿瘤细胞生存、生长、增殖已被学者所熟知, 近年有文献报道, 人HaCaT细胞TF/FⅦ a通路活化后, 可旁路磷酸化EGFR, 同时诱导EGFR配体肝素结合性表皮生长因子(heparin-binding EGF-like growth factor, HB-EGF)的表达[7]; 在人恶性胶质细胞瘤中, EGFR的异常活化可诱导TF、FⅦ 的表达上调[8]。但目前对于结直肠肿瘤的相关报道多局限于TF与肿瘤恶性进展的相关性方面, 且TF/FⅦ a与EGFR两通路在结直肠癌中的相互作用方面的研究尚为空白。
我们前期研究已证实TF在人结直肠癌组织中呈高表达, 与肿瘤浸润深度、肝转移相关[9], 且四系结肠癌细胞(SW620、SW480、LoVo、HCT116)TF/FⅦ a通路活化后均发现各有不同的EGFR配体基因表达上调, LoVo细胞TF/FⅦ a通路活化后可旁路磷酸化EGFR Y845位点; 此外, 通过免疫组织化学检测到临床结直肠癌组织中可异源性表达FⅦ [10]。根据这些前期研究成果, 结合上述文献报道, 我们推测, 在人结肠癌细胞中, TF/FⅦ a通路和EGFR通路之间可能存在相互调节作用。本研究旨在验证结肠癌细胞中TF/FⅦ a通路与EGFR通路之间的交互作用, 该作用机制的明确可为晚期结直肠癌恶性进展分子机制提供更合理的理论依据, 并为晚期结直肠癌靶向治疗药物研发提供新思路。
人结肠癌细胞系:因KRAS基因状态与EGFR通路密切相关, 故选用KRAS野生型的HT-29及KRAS突变型的LoVo结肠癌细胞系同步实验, 两系细胞均购自美国ATCC(American Type Culture Collection)。高糖DMEM细胞培养基、胎牛血清(fetal calf serum, FBS)、转染用siRNA(正义链:5'-GAACGGACUUUAGUCAGAAGGAACA-3', 反义链:5'-UGU-UCCUUCUGACUAAAGUCCGUUC-3')及转染试剂RNAiMAX、转染用培养基Opti-MEM、RNA提取用Trizol试剂、RT-PCR反转录试剂盒、Real-time qPCR荧光染料Sybr Green均购自美国Invitrogen公司, 细胞刺激药物重组FⅦ a购自丹麦Novo Nordisk公司, 重组EGF购自美国R& D公司。Real-time PCR引物(表1)由上海生工生物工程公司合成, 细胞裂解液RIPA、蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、蛋白浓度测定二喹啉甲酸(bicinchoninic, BCA)试剂盒购自上海碧云天生物技术公司, 抗双调蛋白(amphiregulin, AREG)一抗购自美国R& D公司(AF262), 抗表皮调节素(epiregulin, EREG)一抗购自美国Sigma公司(SAB1303143), 二抗购自美国Santa Cruz公司(sc-2004, sc-2020), 蛋白上样缓冲液购自南京凯基生物公司, ECL发光液购自美国Thermo公司。
| 表1 各目的基因的引物序列 Table 1 Sequence of primers of target genes |
HT-29、LoVo细胞均匀铺于6孔板, 设空白对照组、转染组, 以含10%(体积分数)FBS的DMEM完全培养基在37 ℃、5%(体积分数)CO2条件下培养, 在细胞生长至约60%致密度时进行转染:弃培养基, 无菌磷酸盐缓冲液(phosphate buffered saline, PBS)洗3遍, 加新鲜含10%FBS完全培养基, 以Opti-MEM培养基分别溶解转染试剂RNAiMAX和siRNA, 两者混匀, 室温放置5 min后加入转染组细胞, 对照组加等体积PBS, 转染48 h后提取总RNA, 取 1 μ g总RNA反转录得cDNA, Real-time PCR检测TF mRNA表达(50 ℃ 2 min; 95 ℃预变性10 min; 95 ℃变性15 s, 60 ℃退火、延伸1 min, 40循环)。检测重复3次以验证敲低效应。
两细胞系均设空白对照组(Con组)、TF敲低组(TFi组)、FⅦ a刺激组(FⅦ a组)和TF敲低+FⅦ a刺激组(TFi+FⅦ a组), 按1.2小节方法转染 TFi组和TFi+FⅦ a组细胞后, 饥饿处理24 h, 以100 nmol/L终浓度的FⅦ a刺激FⅦ a组和TFi+FⅦ a组细胞, 6 h后提取各组总RNA, qRT-PCR检测EGFR配体AREG、EREG的基因表达。实验独立重复3次。
两细胞系设Con组和FⅦ a组, FⅦ a组加终浓度为100 nmol/L的FⅦ a, Con组加等体积PBS, 36 h后提取细胞总蛋白, BCA法测蛋白浓度, 加上样缓冲液, 配胶上样(每泳道上样20 μ g总蛋白), 120 V恒压电泳1.5 h, 200 mA恒流电转1.5 h, 5%(质量分数)牛奶室温封闭1.5 h, 4 ℃过夜孵育一抗, TBST洗膜3次(10 min/次), 室温孵育二抗2 h, TBST洗膜3次(10 min/次), ECL发光; 根据灰度值作柱状图。实验独立重复3次。
两细胞系设Con组和EGF组, 以500 μ g/L的EGF刺激EGF组细胞, Con组加等体积PBS, 2 h后提取总RNA, qRT-PCR检测TF、FⅦ 的基因表达。实验独立重复3次。
应用SPSS 20.0统计学软件, 不同分组的基因、蛋白表达量以相对表达量的均数± 标准差表示, 统计学方法采用t检验、单因素方差分析(包含q检验), 双侧检验, P< 0.05定义为差异有统计学意义。
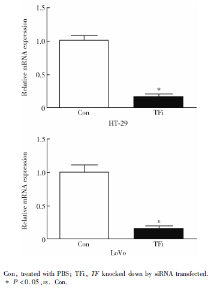
TF siRNA转染后48 h, HT-29、LoVo细胞系对照组和TFi组的TF基因相对表达量分别为1.01± 0.08 vs. 0.17± 0.04、1.00± 0.12 vs. 0.14± 0.06(P均< 0.05, 图1)。
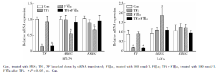
FⅦ a刺激6 h后, HT-29细胞系的FⅦ a组AREG、EREG基因表达较Con组均显著下调, AREG基因在Con组、FⅦ a组相对表达量分别为0.99± 0.09 vs. 0.55± 0.09(P=0.011), EREG基因在Con组、FⅦ a组相对表达量分别为1.02± 0.02 vs. 0.67± 0.10(P=0.037), Con组、TFi组和TFi+FⅦ a组间差异均无统计学意义; LoVo细胞系AREG基因表达较Con组显著上调, Con组、FⅦ a组相对表达量分别为0.93± 0.23 vs.1.87± 0.39(P=0.007), Con组、TFi组和TFi+FⅦ a组间差异均无统计学意义, EREG基因各组两两间表达差异均无统计学意义(图2)。
两细胞系TFi+FⅦ a组与FⅦ a组间基因表达差异有统计学意义, TFi+FⅦ a组与Con组间差异无统计学意义, 即FⅦ a诱导基因上/下调效应可被TF敲减部分阻断, 表明FⅦ a上述效应依赖于TF。
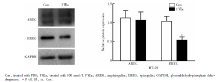
FⅦ a刺激36 h后, HT-29细胞EREG蛋白表达量显著低于Con组(0.54± 0.09 vs. 1.04± 0.13, P=0.005), AREG蛋白表达在两组间差异无统计学意义(P=0.732, 图3); LoVo细胞+FⅦ a组AREG、EREG蛋白表达水平均显著高于Con组, 分别为3.09± 0.73 vs. 1.11± 0.21(P=0.011)、1.53± 0.19 vs. 0.97± 0.23(P=0.032, 图4)。
EGF刺激2 h, HT-29细胞TF表达与Con组相比无显著变化, FⅦ 基因表达未检测到; LoVo细胞系EGF刺激组TF、FⅦ 基因表达均较Con组显著上调, 分别为1.00± 0.23 vs. 1.53± 0.23(P=0.048)、1.00± 0.15 vs. 53.20± 6.08(P< 0.01, 图5)。
本研究通过分别激活KRAS基因野生型的HT-29及KRAS基因突变型的LoVo结肠癌细胞的TF/FⅦ a、EGFR通路, 检测两通路的相互调节作用。对于HT-29细胞, TF/FⅦ a通路活化后可负性调节EGFR通路, 表现为EGFR配体EREG的基因和蛋白表达下调, EGFR通路活化后对TF/FⅦ a通路则无显著影响; 对于LoVo细胞, TF/FⅦ a通路活化后可上调EGFR配体AREG、EREG的基因和蛋白表达, EGFR通路活化后则可上调TF、FⅦ 基因表达, 两通路表现为相互促进的交互作用。KRAS基因状态不同的两种细胞TF/FⅦ a-EGFR通路间的相互作用截然不同。我们前期研究发现, 结肠癌细胞SW620、SW480及HCT116(均为KRAS突变型)TF/FⅦ a通路活化后均可上调EGFR配体基因表达, 结合本实验研究结果推测, KRAS基因突变可能对TF/FⅦ a-EGFR通路间发生相互促进的交互作用机制发挥关键作用。
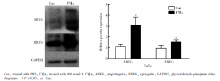 | 图4 Western blot检测LoVo细胞TF/FⅦ a通路活化后对AREG、EREG蛋白表达的影响Figure 4 Protein expressions of AREG and EREG after TF/FⅦ a pathway was activated in LoVo cell by Western blot |
 | 图5 qRT-PCR检测HT-29、LoVo细胞EGFR通路活化后TF、FⅦ 基因表达改变Figure 5 Gene expressions of TF and FⅦ after EGFR pathway was activated in HT-29 and LoVo cells by qRT-PCR |
目前TF/FⅦ a通路与EGFR通路的相关性研究较少, 我们前期通过基因表达谱芯片检测到SW620细胞(KRAS突变型)TF/FⅦ a通路活化后, EGFR配体AREG、EREG、HB-EGF均有不同程度表达上调; 通过免疫组织化学检测到临床结直肠癌组织中可异源性表达FⅦ (生理条件下仅表达于肝细胞)[10], 均与本实验结果一致。Hjortoe等[11]研究证实, MAPK活化及白细胞介素-8(interleukin-8, IL-8)上调为TF/FⅦ a通路的下游效应, Wiiger等[7]则进一步阐明了上述TF/FⅦ a通路效应通过促进EGFR磷酸化介导, 而EGFR通路活化后上调TF/FⅦ a通路关键分子TF、FⅦ 表达则只见于Garnier等[8]的报道。上述研究均未涉及两通路的交互作用, 且在结直肠肿瘤中的相关研究尚为空白。本研究证实了结肠癌细胞中TF/FⅦ a、EGFR双通路交互作用机制的存在, 并推测KRAS基因突变可能对该机制的发生起关键作用, 既往关于结直肠癌KRAS、p53突变与TF高表达的相关性研究也支持这一假设[12, 13]。
TF/FⅦ a信号通路在结直肠癌等众多实体肿瘤的进展中发挥着重要作用[14, 15, 16], 近年以TF为靶标应用于肿瘤诊疗的研究成果已得到初步肯定。Breij等[17]报道, 针对TF的靶向药物TF HuMab将人TF单抗与细胞毒性药物连接, 在7种不同的人实体瘤小鼠移植模型中表现出高效抑瘤作用, 且对凝血作用并无明显影响。Zhu等[18]利用肿瘤血管内皮异常表达TF, 研制出一种Cy5.5荧光染料标记的靶向结合TF的蛋白分子, 可在体内定位肿瘤并成像, 这一新技术有望应用于临床肿瘤的检测与治疗效果的监测。这些研究均表明, 以TF为靶标在肿瘤的诊疗中具有极高的临床应用价值。
EGFR通路与结直肠癌发生、发展密切相关, 抗EGFR单抗可用于治疗KRAS基因野生型的晚期结直肠癌患者, 该药物通过结合EGFR胞外域, 阻断EGFR与其胞外配体结合导致的EGFR活化作用, 从而达到抑制EGFR信号通路的效果, KRAS基因发生突变的患者对EGFR靶向治疗无效[19]。传统观念认为, 由于KRAS基因突变导致的Ras蛋白持续活化, 使EGFR通路下游处于不依赖EGFR的持续激活状态, 从而导致EGFR靶向治疗的失败。本研究结果提示, KRAS基因发生突变除持续活化其下游通路外, 还可使EGFR通过结合其胞外配体(EGF)产生对TF/FⅦ a信号通路的促进作用, TF/FⅦ a通路的活化一方面促进结直肠癌细胞增殖、侵袭、转移, 同时又进一步上调EGFR配体表达, 形成正反馈环路强化上述作用, 即KRAS发生突变后, EGFR与其胞外配体的结合虽对EGFR下游通路活化作用不再重要, 但可通过与TF/FⅦ a通路发生交互作用进一步促进癌细胞恶性进展, 因而我们推测, 尽管临床上KRAS基因突变的晚期结直肠癌患者对抗EGFR的靶向治疗无效, 但该药物仍具有治疗意义, 其疗效很可能在EGFR-TF联合靶向抑制后得以显现。
TF/FⅦ a通路与EGFR通路在结直肠肿瘤恶性进展中存在交互作用, 这一发现有望为结直肠癌靶向治疗提供新思路; 对本研究涉及的双通路下游相关效应分子的进一步明确, 有望指导临床研发双通路抑制、较现有药物(如西妥昔单抗)更为高效的复合靶向药物。
总之, 本研究初步证实了结肠癌细胞中TF/FⅦ a与EGFR双通路的交互作用机制, 但具体的反馈机制尚待进一步明确, 如:双通路交互作用是通过直接激活还是间接激活实现; 两通路各自下游通路是否同样存在交叉反应参与了这一正反馈过程, 并最终影响癌细胞的生物学行为; KRAS基因突变对两通路相互作用的调节机制如何等。相信对TF/FⅦ a-EGFR通路交互作用机制的深入研究与进一步明确, 将对研发晚期结直肠癌新型复合靶向治疗药物具有重大指导意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|