目的 观察高糖腹膜透析液对人腹膜间皮细胞NLRP3-IL-1β的影响。方法 体外培养人腹膜间皮细胞株第5~10代[HMrSV5,DMEM/F12培养基含10%(体积分数)胎牛血清],观察1.5%、2.5%、4.25%(质量分数)葡萄糖腹膜透析液(dextrose)及线粒体呼吸链复合酶Ⅰ抑制剂鱼藤酮(rotenone),线粒体呼吸链复合酶Ⅱ抑制剂噻吩甲酰三氟丙酮(thenoyltrifluoroacetone,TTFA),线粒体呼吸链复合酶Ⅲ抑制剂抗霉素A(antimycin A)对细胞IL-1β表达的影响(免疫印迹);通过小RNA干扰技术下调NLRP3的表达,免疫印迹分析4.25%高糖腹膜透析液作用下细胞IL-1β的表达;通过白藜芦醇(resveratrol,RSV)诱导自噬,3-甲基腺嘌呤(3-methyladenine,3-MA)、自噬相关蛋白5(autophagy related gene 5,ATG5)siRNA、自噬相关蛋白(Beclin1)siRNA抑制自噬,流式细胞仪分析细胞活性氧(reactive oxygen species,ROS),免疫印迹分析IL-1β的表达。结果 对照组、1.5%高糖腹膜透析液、2.5%高糖腹膜透析液、4.25%高糖腹膜透析液、鱼藤酮(10 μmol/L)、抗霉素A(50 mg/L)、噻吩甲酰三氟丙酮(10 μmol/L)各组细胞上清IL-1β的相对表达依次为0、0.175±0.082、0.418±0.163、2.357±0.288、2.642±0.358、3.271±0.462、0.123±0.091,提示 2.5%高糖腹膜透析液、4.25%高糖腹膜透析液、鱼藤酮、抗霉素A作用细胞IL-1β表达明显升高,应用NLRP3 siRNA可阻断上述效应;此外,对照组、阴性对照siRNA(negative control,NC siRNA)、RSV(50 μmol/L,诱导自噬)、3-MA(10 mmol/L,抑制自噬)、ATG5 siRNA(抑制自噬)、Beclin1 siRNA(抑制自噬)各组总线粒体荧光强度分别为1.76±0.42、1.83±0.55、1.85±0.62、7.36±0.92、5.35±0.77、5.06±0.62,超氧化线粒体荧光强度分别为821.68±95.12、868.15±102.82、723.39±92.56、1 660.08±113.65、1 433.01±107.24、1 562.36±112.88,结合免疫印迹结果,提示抑制自噬可增强线粒体ROS产生和提高IL-1β表达,诱导自噬对ROS、IL-1β无明显影响。结论 长期应用高糖腹膜透析液,腹膜间皮细胞NLRP3-IL-1β持续激活,实时启动自噬可能成为干预NLRP3-IL-1β持续激活、延缓腹膜透析腹腔慢性炎症及腹膜纤维化的治疗靶点。
Objective: To explore the effect of high glucose-based peritoneal dialysis fluids on NLRP3-IL-1β in human peritoneal mesothelial cells.Methods: HMrSV5 cells (SV40 immortalized human peritoneal mesothelial cell line) were grown in type Ⅰ collagen-coated dishes in DMEM/F12 containing 10% fetal calf serum (FCS). All experiments on HMrSV5 cells were performed between passages 5 and 10. The cells were divided into 7 groups: control, 1.5% dextrose, 2.5% dextrose, 4.25% dextrose, rotenone, thenoyltrifluoroacetone (TTFA), and antimycin A. Immunoblotting was used to evaluate the expression of IL-1β. Small interfering RNA (siRNA) targeting NLRP3 was used to downregulate the expression of NLRP3 and Western blot was used to evaluate the expression of IL-1β in human peritoneal mesothelial cells exposed to 4.25% dextrose. In the meanwhile, resveratrol (RSV) was used to induce autophagy, 3-methyladenine (3-MA) and siRNA against Beclin 1 or ATG5 were used to block auto-phagy, flow cytometric was used to analyze the respiring (mitotracker deep red), total (mitotracker green) and reactive oxygen species (ROS)-generating mitochondria (mitoSOX); Western blot was used to evaluate the expression of IL-1β.Results: The IL-1β relative expressions were 0, 0.175±0.082, 0.418±0.163, 2.357±0.288, 2.642±0.358, 3.271±0.462, and 0.123±0.091, indicating that the cells exposed to high glucose-based peritoneal dialysis fluids and cells treated with mitochondria respiratory chain key enzyme complex Ⅰ, and complex Ⅲ inhibitors increased the IL-1β expression. And we found that NLRP3 knock-down significantly blocked the upregulation of IL-1β. In addition, the fluorescence intensity of total mitochondria and ROS-generating mitochondria in the following groups: control, negative control, RSV, 3-MA, ATG5 siRNA, Beclin1 siRNA were 1.76±0.42, 1.83±0.55, 1.85±0.62, 7.36±0.92, 5.35±0.77, 5.06±0.62 and 821.68±95.12, 868.15±102.82, 723.39±92.56, 1 660.08±113.65, 1 433.01±107.24, 1 562.36±112.88 respectively. The increased concentrations of mitochondrial ROS and IL-1β upregulation were confirmed in the inhibition but not the induction of auto-phagy. We also found that downregulation of ATG5 and Beclin1 sensitized cells for the release of IL-1β induced by MSU (monosodium urate) or nigericin which was the NLRP3 inflammasome activator. RSV treatment attentuated this effect.Conclusion: Long-term application of high glucose-based peritoneal dialysis fluids can trigger the consistent activation of NLRP3-IL-1β in peritoneal mesothelial cells. Timely initiation of autophagy may block the NLRP3-IL-1β activation and provide a basis for the further development of a potential therapeutic strategy for delay of chronic inflammation and peritoneal fibrosis associated with peritoneal dialysis.
腹膜透析具有良好的残肾保护作用及早期生存率优势成为终末期肾病患者的重要替代治疗方法[1, 2], 其使用人数在发展中国家特别是在中国迅速增长。尽管新型腹膜透析液不断涌现, 但基于葡萄糖的传统透析液仍然是绝大多数腹膜透析患者的首选, 这种高糖、高渗、低pH值的腹膜透析液是一种非生物相容性的透析液, 长期使用可导致腹膜炎症因子的产生、血管新生、腹膜纤维化, 最终导致超滤衰竭, 患者不得不放弃腹膜透析治疗。腹膜间皮细胞是构成腹膜的主要细胞群体之一, 其位于腹膜巨噬细胞和间皮下微血管之间紧密连接的关键部位, 在高浓度葡萄糖腹膜透析液持续作用下, 间皮细胞产生活性氧(reactive oxygen species, ROS)、分泌炎症因子, 细胞长期处于慢性炎症状态, 从而启动新生血管形成及腹膜组织纤维化[3]; 当前, NLRP3炎症小体在机体炎症相关疾病中的作用备受关注, 是近年研究的热点, 其可被病原相关模式分子(pathogen-associated molecular patterns, PAMPs)或危险相关模式分子(danger-associated molecular patterns, DAMPs)激活, 通过ROS共同信号通路, 促进促炎症蛋白酶caspase-1活化, 活化的caspase-1切割位于炎症反应上游的IL-1β 前体, 产生成熟的IL-1β , 启动系列炎症反应[4, 5]。本实验旨在探讨高糖腹膜透析液对腹膜间皮细胞NLRP3-IL-1β 的影响。
人腹膜间皮细胞株(HMrSV5)购自美国模式培养物集存库(American type culture collection, ATCC)。
1.5%、2.5%、4.25%(质量分数)葡萄糖腹膜透析液(dextrose), 购自广州百特(中国)医疗有限公司; 3种线粒体荧光染料mitotracker deep red、 mitotracker green和mitoSOX购自美国Invitrogen公司; 线粒体呼吸链复合酶Ⅰ 抑制剂鱼藤酮(rotenone)、线粒体呼吸链复合酶Ⅱ 抑制剂噻吩甲酰三氟丙酮(thenoyltrifluoroacetone, TTFA)、线粒体呼吸链复合酶Ⅲ 抑制剂抗霉素A(antimycin A)、白藜芦醇(resveratrol, RSV)、3-甲基腺嘌呤(3-methyladenine, 3-MA, 自噬抑制剂)购自美国Sigma公司; NLRP3激动剂尿酸钠晶体(monosodium urate, MSU)和尼日利亚菌素(Nigericin)购自法国Invivogen公司; anti-IL-1β 、pro IL-1β 、自噬相关蛋白5(autophagy-related genes, ATG5)、自噬相关蛋白(Beclin1)、NLRP3购自美国Cell Signaling Technology公司; NLRP3 siRNA购自美国Dharmacon公司, ATG5 siRNA和Beclin1 siRNA购自美国Invitrogen公司。
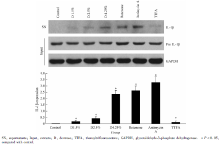
1.3.1 高糖腹膜透析液对腹膜间皮细胞IL-1β 表达的影响 人腹膜间皮细胞株(HMrSV5)为研究对象, 采用第5~10代细胞, 按照本课题组以前报道的方法进行细胞活力的检测[6], 以备进行后续实验。对照组、 1.5%高糖腹膜透析液组、 2.5%高糖腹膜透析液组、4.25%高糖腹膜透析液组、鱼藤酮组(10 μ mol/L)、噻吩甲酰三氟丙酮组(10 μ mol/L)、抗霉素A组(50 mg/L)用Western blot法分别测定细胞上清内IL-1β 及细胞胞浆内pro IL-1β 的表达。
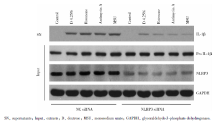
1.3.2 下调NLRP3对于高糖腹膜透析液对腹膜间皮细胞IL-1β 表达的影响 在上述实验基础上, 实验组分为阴性对照siRNA(negative control, NC siRNA)及NLRP3 siRNA组, 亚组分为:对照组、4.25%dextrose、鱼藤酮组(rotenone, 10 μ mol/L)、抗霉素A组(antimycin A, 50 mg/L)、MSU组(150 mg/L), Western blot分别测定细胞上清内IL-1β 及细胞胞浆内pro IL-1β 、NLRP3的表达。
1.3.3 调节细胞自噬对腹膜间皮细胞线粒体活性氧的影响 HMrSV5细胞分为6组:对照组、阴性对照siRNA(NC siRNA)、白藜芦醇RSV组(50 μ mol/L, 诱导自噬)、3-MA组(10 mmol/L, 抑制自噬)、ATG5 siRNA组(抑制自噬)、Beclin1 siRNA(抑制自噬), 作用细胞后, 加入线粒体荧光染料mitotracker deep red、 mitotracker green和mitoSOX染色30 min, 流式细胞仪分析。
1.3.4 调节细胞自噬对腹膜间皮细胞NLRP3-IL-1β 的影响 HMrSV5细胞分为6组:对照组、阴性对照siRNA(NC siRNA)、白藜芦醇组(50 μ mol/L, 诱导自噬)、3-MA组(10 mmol/L, 抑制自噬)、ATG5 siRNA组(抑制自噬)、Beclin1 siRNA(抑制自噬), 作用细胞后, Western blot分别测定细胞上清内IL-1β 及细胞胞浆内pro IL-1β 、ATG5、Beclin1的表达。HMrSV5细胞分为4组:阴性对照siRNA(NC siRNA)、白藜芦醇组(50 μ mol/L, 诱导自噬)、ATG5 siRNA组(抑制自噬)、Beclin1 siRNA(抑制自噬), 亚组分为对照组、MSU组(150 mg/L)、Nigericin组(15 μ mol/L), Western blot分别测定细胞上清内IL-1β 及细胞胞浆内pro IL-1β 的表达。
采用SPSS15.0统计软件, 计量资料以± s表示, 根据方差齐性检验结果, 多组比较采用单因素方差分析, P< 0.05认为差异具有统计学意义。
对照组、1.5% 高糖腹膜透析液组、2.5%高糖腹膜透析液组、4.25%高糖腹膜透析液组、鱼藤酮(10 μ mol/L)组、抗霉素A(50 mg/L)组、噻吩甲酰三氟丙酮(10 μ mol/L)组细胞上清IL-1β 相对表达依次为0、0.175± 0.082、0.418± 0.163、2.357± 0.288、2.642± 0.358、3.271± 0.462、0.123± 0.091, 高糖腹膜透析液(2.5%%和4.25%组)、鱼藤酮、抗霉素A组细胞上清(supernatants, SN)IL-1β 表达明显升高, 与对照组比较, 差异具有统计学意义(P< 0.05), TTFA组上调IL-1β 作用不明显。
为进一步证实高糖腹膜透析液上调HMrSV5细胞IL-1β 表达是否通过NLRP3发挥作用, 通过小RNA干扰技术下调NLRP3的表达, 观察4.25% 高糖腹膜透析液、鱼藤酮、抗霉素A、MSU作用下HMrSV5细胞IL-1β 的表达情况(图2), NLRP3 siRNA转染细胞后, NLRP3表达明显下调, 4.25% 高糖腹膜透析液、鱼藤酮、抗霉素A、MSU上调IL-1β 表达的作用明显减弱。
选择白藜芦醇作为细胞自噬的诱导剂, 应用自噬抑制剂3-MA及干扰自噬体形成的关键蛋白分子ATG5、Beclin1(ATG5 siRNA、Beclin1 siRNA)作为自噬阻断剂, 观察上述不同自噬状态下HMrSV5细胞ROS的情况, 对照组、阴性对照组、白藜芦醇组、3-MA组、Beclin1 siRNA组、ATG5组荧光强度分别为1.76± 0.42、1.83± 0.55、1.85± 0.62、7.36± 0.92、5.35± 0.77、5.06± 0.62, 3-MA、ATG5 siRNA及Beclin1 siRNA组与对照组比较, 差异具有统计学意义(P< 0.05, 图3), RSV作用后细胞总线粒体无明显变化; 对照组、阴性对照组、白藜芦醇组、3-MA组、Beclin1 siRNA组、ATG5组荧光强度分别为821.68± 95.12、868.15± 102.82、723.39± 92.56、1 660.08± 113.65、1 433.01± 107.24、1 562.36± 112.88, 3-MA、ATG5 siRNA及Beclin1 siRNA组与对照组比较差异具有统计学意义(P< 0.05, 图4), RSV作用后超氧化线粒体无明显变化。
由图5可见, 3-MA、ATG5 siRNA及Beclin1 siRNA作用细胞后IL-1β 表达上调, 与上述第2.3.1节的结果3-MA、ATG5 siRNA及Beclin1 siRNA作用细胞后ROS增加的趋势一致, RSV对IL-1β 表达无明显影响。由图6可见, 阻断细胞自噬(ATG5 siRNA、Beclin1 siRNA)后NLRP3炎症小体激活(MSU、Nigericin)上调IL-1β 表达的效应增强, 相反诱导细胞自噬(RSV)后NLRP3炎症小体激活(MSU、Nigericin)上调IL-1β 表达的效应减弱。
持续不卧床腹膜透析是目前治疗终末期肾病的主要替代治疗方法之一, 腹膜透析患者5年生存率与血液透析相似, 而10年生存率却明显低于血液透析患者[7]。基于葡萄糖的传统透析液仍然是绝大多数腹透患者的首选, 特别是在中国。作为腹腔主要细胞群体之一的腹膜间皮细胞长期暴露于高糖环境中, 可能产生ROS、分泌炎症因子并启动新生血管形成及腹膜组织纤维化。在人腹膜间皮细胞、大鼠腹膜间皮细胞的研究已证实高糖腹膜透析液可导致细胞内ROS升高[8, 9, 10], 本课题组的前期研究也得到类似的结论[11]。本研究发现, 高糖腹膜透析液作用HMrSV5 IL-1β 表达升高, 以4.25%高糖腹膜透析液最明显; 与此同时, 鱼藤酮、抗霉素A作用细胞后IL-1β 表达同样升高, 根据本课题组前期研究结果[11], 推测IL-1β 的高表达与高浓度葡萄糖作用后细胞ROS升高有关, 也与线粒体呼吸链抑制后线粒体ROS产生增加有关。
处于炎症反应上游的IL-1β , 是启动系列炎症反应的重要分子, 过度和/或持续激活可造成广泛的组织损伤参与人类许多急慢性炎症相关疾病的发生, NLRP3炎症小体是调控IL-1β 表达的关键分子, 近年来在机体炎症相关疾病中的作用备受关注[12, 13], 其中, ROS是激活NLRP3炎症小体的共同通路之一[5]。本研究应用高糖腹膜透析液或线粒体呼吸链抑制剂所导致的ROS升高及IL-1β 的高表达, 是否由NLRP3炎症小体介导, 本课题组利用小RNA干扰技术下调NLRP3的表达, 发现NLRP3表达明显下降, 4.25%高糖腹膜透析液、鱼藤酮、抗霉素A、MSU上调IL-1β 表达的作用明显减弱。体外实验初步证实高糖腹膜透析液在ROS-NLRP3-IL-1β 中的作用, 进一步的体内实验证据需要在
有学者报道[14]:因自噬(线粒体自噬)受阻, 细胞受损ROS线粒体清除障碍, ROS积累越来越多, 随后激活NLRP3-IL-1β , 提示线粒体自噬与NLRP3-IL-1β 联系紧密。参照以往研究[15, 16], 本研究选择白藜芦醇作为细胞自噬的诱导剂, 应用自噬抑制剂3-MA及干扰自噬体形成的关键蛋白分子ATG5、Beclin1(ATG5 siRNA、Beclin1 siRNA)作为自噬阻断剂, 证实抑制自噬可增强ROS-NLRP3-IL-1β , 诱导自噬对ROS-NLRP3-IL-1β 无明显影响。本研究在人腹膜间皮细胞中的发现与巨噬细胞的一致[14], 提示实时启动自噬对细胞过度激活的ROS-NLRP3-IL-1β 可能发挥一定的保护作用, 进一步的实验需在体内加以证实。
 | 图4 不同自噬状态对细胞超氧化线粒体(线粒体ROS)的影响Figure 4 The effect of autophagy on ROS-generating mitochondria in cells |
综上所述, 长期应用葡萄糖腹膜透析液, 特别是高糖腹膜透析液, 腹膜间皮细胞NLRP3-IL-1β 持续激活, 实时启动自噬可能成为干预NLRP3-IL-1β 持续激活的潜在靶点, 并有可能成为延缓腹膜透析腹腔慢性炎症及腹膜纤维化的治疗靶点。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|