目的 研究人胚胎植入前囊胚滋养外胚层细胞基因的空间表达。方法 辅助生殖来源人受精后第6天Gardner评分5AA的囊胚,显微镜下微吸管机械分离滋养外胚层细胞,对囊胚滋养外胚层极滋养层细胞和壁滋养层细胞采用单细胞测序检测,选取经 t检验计算所得 P<0.05且基因表达差异≥2倍的差异表达基因,采用生物信息学软件对筛选的差异基因进行无监督层次聚类分析和基因本体(gene ontology,GO)功能分类分析,对差异表达基因进行注释和生物功能富集,并用全基因组对差异基因功能进一步注释。结果 对2枚受精后第6天的5AA囊胚滋养外胚层8个极滋养层细胞和8个壁滋养层细胞测序,发现极滋养层细胞306个基因上调,壁滋养层细胞75个基因上调。无监督聚类分析结果显示外胚层细胞分成极滋养层细胞和壁滋养层细胞两群,属于两种不同类型和生物功能的细胞群。差异基因功能注释显示,极滋养层细胞上调基因GO生物学功能主要是转录、能量代谢、蛋白合成、转运、氧化应激、离子转运、蛋白合成及运输、细胞周期调节、肌动蛋白增长等,主要参与泛素介导的蛋白水解、氧化磷酸化、Wnt信号通路、雌雄激素代谢等信号通路;壁滋养层细胞上调基因GO生物学功能主要是蛋白分解代谢、细胞周期停滞、细胞凋亡、激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、碳水化合物运输、突触负调节、细胞生长、钙通道激活、正向B 细胞分化、T细胞凋亡等,主要参与B细胞受体、T细胞受体、白细胞跨内皮移植、血管内皮生长因子(vascular endothelial growth factor,VEGF)表达、间隙连接、促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)分泌、细胞凋亡等信号通路。结论 从空间维度揭示囊胚极/ 壁滋养层细胞的基因表达,显示胚胎植入前囊胚极/壁滋养外胚层相互协调,精细调节囊胚孵化和胚胎植入过程,进一步数据分析有望寻找到调控胚胎植入的内源性特异分子。
Objective: To study the spatial expression of trophectoderm cells in human embryonic preantral blastocysts.Methods: The study used Gardner score 5AA blastocysts harvested on day 6 after fertilization from assisted reproductive technology. Microcapsules were used to separate trophectoderm cells from the epidermal cells. Single-cell sequencing was performed. P < 0.05 was calculated by unpaired t test, and the difference was 2 times. Here we determined, for the first time, global gene expression patterns in the polar/mural trophectoderm isolated from human blastocysts. Unsupervised hierarchical clustering analysis and gene ontology (GO) functional classification were performed using bioinformatics software. Differentially expressed genes were annotated by the Database for Annotation, Visualization and Integrated Discovery. Functions of differentially expressed genes were further annotated using encyclopedia of genes and genomes.Results: The results showed that there were up to 306 genes in the trophoblast cells and up to 75 genes in the trophoblast cells. Unsupervised cluster analysis of polar trophoblast cells and mural trophoblast cells were divided into two groups, belonging to different types and biological functions. Differences in gene function indicated that the biological functions of GO gene uptake genes were mainly transcription, energy metabolism, protein synthesis, transport, oxidative stress, ion transport, protein synthesis and transport, cell cycle regulation, actin growth, etc. They were mainly involved in ubiquitin-mediated protein hydrolysis, oxidative phosphorylation, Wnt signaling pathway, estrogen androgen metabolism and other signal pathways; wall trophoblast cells up-regulated gene GO biological function, which was mainly proteolytic metabolism, cell cycle arrest, apoptosis, activation of MAPK, carbohydrate transport, synaptic regulation, cell growth, calcium channel activation, positive B cell differentiation, T cell apoptosis and other biological functions, which were mainly involved in B cell receptor, T cell receptor, white blood cells cross-endothelial transplantation, VEGF expression, gap connection, GnRH secretion, apoptosis and other signaling pathways.Conclusion: The gene expression of blastocysts trophectoderm is revealed from the spatial dimension, indicating that differentiation of polar and mural trophectoderm of blastocysts is accompanied by differences between the two cell lineages, and the polar and mural trophectoderms are coordinated with each other and the blastocyst hatching and embryo implantation processes are finely adjusted. Further data analysis is expected to find the endogenous molecular specificity of the regulation of embryo implantation.
胚胎植入是哺乳动物生殖过程中的关键环节, 它是指胚泡运行到子宫后, 与子宫内膜相互作用的过程, 主要包括胚泡的定位、黏附和穿透, 此过程非常复杂, 由胚胎和子宫内膜双方共同作用完成, 位于胚胎外围的滋养层细胞在胚胎侵入过程中发挥着关键的作用, 它通过分泌系列细胞因子和激素行使妊娠识别作用, 还通过分泌这些因子、激素的作用使胚胎对子宫内膜发生黏附和侵入[1]。胚胎植入被认为是调控女性生育和发展避孕方法的靶点和关键环节, 异位妊娠现象表明, 对胚胎植入起关键作用的基因和分子可能不是来自于母体, 而是来自囊胚的滋养层细胞。人类胚胎是在系膜侧偏心区着床, 内细胞团位于系膜侧, 最初与母胎子宫内膜接触的是极滋养层细胞[2]。由于必须恪守伦理原则和实际操作原因, 研究人体胚胎植入和滋养层细胞功能十分困难, 目前关于滋养层细胞在胚胎植入前基因表达研究多局限在基因表达的时间顺序演变, 细胞基因表达空间研究尚少见, 本研究通过对植入前囊胚滋养外胚层的显微操作, 分析植入前囊胚滋养外胚层基因的空间表达差异, 探讨胚胎植入的细胞和分子机制, 寻找控制胚胎植入的关键分子。
患者来源于北京大学第三医院生殖中心, 年龄25~35岁, 因为输卵管因素导致不孕, 男性精液检测正常。本研究开始前得到北京大学第三医院医学科学研究伦理委员会审查批准(医伦审:2014075), 所有研究对象包括患者和健康人均签署知情同意书, 所有胚胎均获得捐赠夫妇书面知情同意, 确认患者自愿捐赠胚胎用于人类早期胚胎发育机制研究, 并被告知捐赠胚胎可能带来的潜在风险。
体外受精(in vitro fertilization, IVF)及囊胚评分方案:所采用的超排卵方案按照本中心的常规进行, 获卵后根据患者情况采用自然授精, 取卵24 h后观察受精情况, 72 h观察卵裂球胚胎情况, 根据胚胎评分情况决定移植, 移植后剩余的胚胎经患者知情同意后全部进行囊胚培养, 在受精后第5天或第6天分别观察囊胚形成情况及其形态, 并进行冷冻保存, 采用Gardner评分系统对囊胚进行评分。首先根据囊腔扩张程度进行分期, 囊腔不足胚胎的50%为1期, 囊腔超过胚胎的50%为2期, 囊腔占满整个胚胎为3期, 囊胚扩张透明带变薄为4期, 囊胚开始孵化为5期, 囊胚完全孵出为6期, 对4~6期的囊胚进一步评价。内细胞团(inner cell mass, ICM)评分:(1)A:细胞数目多, 排列紧密; (2)B:细胞数目较少, 排列松散; (3)C:细胞数目很少。滋养外胚层细胞(tropheetoderm, TE)评分:(1)A:细胞数目多, 囊腔四周均有细胞, 排列紧密; (2)B:细胞数较少, 排列较松; (3)C:细胞数目很少。本研究选择第6天评分为5AA的早期孵化的囊胚, 具有光滑的滋养外胚层和发育良好的囊胚腔。
微吸管由硬质玻璃微电极毛坯(Narishige, 日本)拉制而成, 分离微吸管直径为1~2 μ m, 吸取微吸管直径10~20 μ m。光学显微镜下先以20倍物镜× 10倍目镜找到所需细胞, 然后在60倍物镜× 10倍目镜下分离微吸管机械分离滋养外胚层细胞, 并送入吸取微吸管内, 再转移到含有1× Expand High Fidelity PCR缓冲液的Eppendorf管中。
单细胞cDNA制备采用逐步单细胞RNA-Seq方法[3, 4]。将微吸管挑选的单细胞转移到全细胞裂解缓冲液中, 使用末端脱氧核苷酸转移酶以在第1链cDNA的3'末端添加多聚(A)尾, 然后进行20+10个循环的PCR以扩增单细胞cDNA。RNA-0Seq文库制备和测序生成cDNA 之后, 将200 ng的cDNA剪切成150~350 bp的片段, 采用TrueSeq DNA 文库准备试剂盒 (Illumina), 制备测序文库。片段化的cDNA末端修饰dA尾, 衔接子连接后进行10~12个循环PCR扩增。每个滋养外胚层单细胞获得20~60万个100 bp的读数。基因片段的读取, 从UCSC Genome Browser (http://genome.ucsc.edu)下载hg19 RefSeq, 采用既往方法[5, 6], 将已经筛选的数据与hg19 RefSeq进行对比, 获得已知基因(UCSC hg19, http://genome.ucsc.edu)的表达情况。
基因功能注释与功能富集采用DAVID(http://david.abcc.ncifcrf.gov/)和生物分子功能注释系统MAS 3.0(http://bioinfo.capitalbio.com/mas3/)。
用SPSS 16.0软件进行统计学处理, 数据以均数± 标准差表示, 非配对t检验分析差异基因表达结果, P< 0.05认为差异有统计学意义。
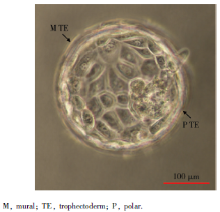
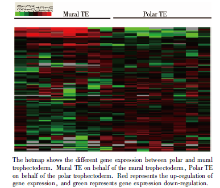
对2枚第6天Gardner评分5AA级的孵化前囊胚进行单细胞基因检测, 收集滋养外胚层的16个单细胞进行测序, 其中极滋养层细胞8个, 壁滋养层细胞8个(图1)。检测结果经非配对t检验分析, 基因表达差异≥ 2倍, 且差异有统计学意义(P< 0.05), 发现极滋养层细胞306个基因表达上调, 壁滋养层细胞有75个基因表达上调(图2、3)。
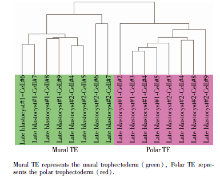
利用无监督聚类软件对囊胚滋养外胚层的极滋养层细胞和壁滋养层细胞上调基因进行分析, 结果以TreeView显示(图4), 可见极滋养层细胞和壁滋养层细胞比较明显地分成两群, 说明极滋养层细胞和壁滋养层细胞具有比较明显的基因表达差异, 属于两种类型和生物功能的细胞。
利用基因功能注释与功能富集技术, 采用DAVID和生物分子功能注释系统MAS, 对极滋养层细胞和壁滋养层细胞特异表达基因进行注释, 并对极滋养层细胞306个差异表达基因和壁滋养层细胞75个差异表达基因进行GO功能分类分析, 发现在生物学过程方面, 极滋养层细胞差异表达基因主要与转录、能量代谢、蛋白合成、转运、氧化应激、离子转运、蛋白合成及运输、细胞周期调节、肌动蛋白增长等有关, 壁滋养层细胞差异表达基因主要与泛素介导蛋白分解代谢、线粒体电子传递、细胞周期、细胞凋亡、激活MAPK途径、碳水化合物运输、突触负调节、B 细胞正向分化、细胞生长、钙通道激活、T细胞凋亡等有关(图5)。极滋养层细胞特异表达基因的分子功能和细胞组分见表1, 壁滋养层细胞特异表达基因的分子功能和细胞组分见表2。
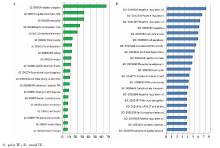 | 图5 极滋养层细胞和壁滋养层细胞差异表达基因主要生物功能Figure 5 The main biological functions of differentially expressed genes in polar and mural trophectoderm. |
| 表1 极滋养层细胞特异表达基因GO分析 Table 1 Gene ontology (GO) analysis of differentially expressed genes in polar trophectoderm |
| 表2 壁滋养层细胞特异表达基因GO分析 Table 2 Gene ontology (GO) analysis of differentially expressed genes in mural trophectoderm |
KEGG通路分析极滋养层细胞特异基因的15种通路和壁滋养层细胞特异基因的15种通路见表3。
| 表3 极/壁滋养层细胞KEGG通路 Table 3 Polar / mural trophectoderm KEGG pathway |
胚胎植入已成为生殖医学研究领域中尚未解决的热点问题, 胚胎植入需要胚泡和子宫内膜之间的通讯和相互协同作用, 被认为是调控女性生育和发展避孕方法最理想的靶点和最关键的环节, 与人类生殖健康关系密切[7]。目前, 在滋养层细胞侵润过程、影响因素、调控因子及细胞与分子机制等研究方面已取得了一些进展, 表明免疫识别、血管发生、细胞凋亡和细胞外基质水解是与胚胎植入和胎盘形成中同步协调发生的关键过程[8]。
囊胚极性与胚胎植入方向性关系密切, 人受精卵发育到第5天囊胚已经具有极性, 分化为内细胞团和滋养层细胞, 包绕内细胞团的是极滋养层细胞, 包绕胚泡腔的是壁滋养层细胞[9]。啮齿类的胚胎是在子宫对系膜区着床, 内细胞团位于系膜侧, 最初与母体子宫内膜接触的是壁滋养层细胞。人及灵长类的胚胎是在系膜侧偏心区着床, 最初与母体子宫内膜接触的是极滋养层细胞[10]。在非人灵长类, 极滋养层在附着到子宫内膜形成初级着床位点时, 胚体仍部分暴露于子宫表面, 胚体对侧的壁滋养层细胞附着到对侧子宫壁, 形成次级着床位点, 随后发育为次级胎盘, 这与啮齿类相似[11]。
极滋养层细胞位于内细胞团外侧, 是人类囊胚植入子宫内膜的滋养层细胞, 具有重要生理作用。本研究采用无监督聚类分析, 极滋养层细胞基因表达不同于壁滋养层细胞, 极滋养层细胞有306个基因表达上调。极滋养层细胞差异表达基因主要与转录、能量代谢、氧化应激、离子转运、蛋白合成及运输等生物功能有关。
极滋养外胚层突起与蛋白水解:本研究发现RPS19、RPS23、RPL26L1等30个基因的生物学作用是参与细胞伸展和突起(图5A)。受精第6天的囊胚处于即将孵化时期, 囊胚极滋养层细胞膜在局部区域会形成突起向外伸展, 称为滋养外胚层突起(trophectodermal projections, TEPs), TEPs具有高度的伸展性, 可长达17 μ m, 能通过卵周隙穿透5 μ m 厚的透明带, 引起透明带局部或整体裂解[12]。TEPs在穿透透明带过程中引起的透明带裂解, 还需要透明带溶解分子(如组织蛋白酶、水解酶、肽酶、环氧合酶等)参与[13]。极滋养层细胞特异基因CPSF2, SMARCA4, DDX6等17个基因分子功能包含这些蛋白酶活性(表1), 说明其在囊胚孵化过程中可能通过TEPs向透明带运输自身分泌的蛋白酶来溶解透明带。
极滋养层细胞吞噬与氧化应激: 研究发现TCOF1、NDUFA7、KHSRP等20个极滋养层细胞特异表达基因参与运输功能, 这种功能是通过吞噬完成的, 囊胚阶段极滋养层细胞吞噬凋亡细胞和蜕膜细胞碎片, 获得发育所需要营养和空间, 同时也清除有害粒子和病原体, 是胚胎植入子宫内膜和组织重塑生理过程的关键环节[14]。这种现象只发生于靠近内细胞团的极滋养层细胞, 而在啮齿类动物只发生于壁滋养层细胞, 恰恰是囊胚植入位置[15], 也说明单细胞检测结果与形态学研究结果相一致。低氧条件下与对照细胞株相比较, 自噬缺陷型细胞株HTR8细胞侵袭能力和血管生成能力明显降低, 进而导致胎盘浅着床和螺旋动脉重塑障碍[16]。
极滋养层细胞细胞周期与增殖:极滋养层细胞特异表达基因中有36个基因功能是DNA依赖转录功能, 另有37个基因功能是转录功能, 说明极滋养层细胞比较快速的增殖与分化。极滋养层细胞特异基因的生物学功能还包括蛋白质合成、蛋白质剪切、蛋白质折叠, rRNA加工、RNA聚合酶Ⅱ 启动子的RNA延伸、RNA聚合酶Ⅱ 启动子的转录起始、RNA剪接、核mRNA剪接体剪接等, 显示了极滋养层细胞在胚胎植入中的特殊功能。
本研究极滋养层细胞特异基因KEGG信号通路分析显示, 这些特异基因参与泛素介导的蛋白水解、氧化磷酸化、Wnt信号通路、雌雄激素代谢等信号通路(表3)。泛素介导的蛋白水解对于细胞分化、细胞器生物合成、细胞凋亡、DNA修复、新蛋白生成、调控细胞增殖、蛋白质输运、免疫应答和应激反应等生理过程, 都起到很重要的作用[17]。可逆的氧化磷酸化过程几乎涉及所有的生理及病理过程, 如细胞信号转导、肿瘤发生、新陈代谢、神经活动、肌肉收缩以及细胞增殖发育和分化等[18]。Wnt信号通路可能是通过影响滋养层细胞, 进而影响了囊胚的孵化[19]。极滋养层细胞特异基因参与雌激素和雄激素代谢, 适当的雌激素和雄激素调节胚胎发育和子宫内膜容受的同步性, 同时也在免疫识别和耐受调控中起到一定作用, 主要影响细胞因子的合成和局部淋巴细胞中NK细胞的功能[20]。
壁滋养层细胞是覆盖胚泡位于内细胞团对侧的滋养层细胞, 采用无监督聚类分析, 壁滋养层细胞基因表达明显不同于极滋养层细胞, 壁滋养层细胞有75个基因表达上调, 差异表达基因主要与蛋白分解代谢、细胞周期停滞、细胞凋亡、激活MAPK、碳水化合物运输、突触负调节、细胞生长、钙通道激活、正向B 细胞分化、T细胞凋亡等生物功能有关。
壁滋养层细胞特异基因TAOK2、GNAI2参与MAPKs信号通路, MAPKs中每个分子均出现于植入前早期胚胎中, 并调控着早期胚胎发育和对环境的适应性[21]。研究发现MAPKs也是囊胚扩张和孵化的重要调控因子, 将MAPKs抑制因子SB220025与早期胚胎共培养, 会使得滋养层细胞之间紧密连接的通透性明显升高, 水通道蛋白表达降低, 减少液体在囊胚腔积累, 进而影响了囊胚的扩张和孵化[22]。壁滋养层细胞特异基因TP53INP1、MFSD10、TAOK2、DPF2、C11orf82参与细胞凋亡。细胞凋亡是胚胎植入过程中在蜕膜和滋养层细胞中发生的一种非常普遍现象。人胎盘表达TNF2α 和IFN2γ , 前者能诱导滋养层细胞凋亡, 而后者能促进这一过程[23], 滋养层细胞表达的EGF 能抑制它的凋亡, 显示壁滋养层细胞在囊胚孵化和胚胎植入过程中精细控制凋亡、侵袭、免疫耐受及血管生成等生理功能。
壁滋养层细胞特异基因CDK5、BARD1参与核的蛋白质输出的负调节, GCLC、AKT1参与阳性调节蛋白酶体泛素依赖性蛋白质分解代谢过程, GCLC、CDK5参与负调节蛋白质泛素化, PDE8A、DLX3、ZNF7、NFYA、HES6、DPF2、EED参与DNA依赖调节转录, CGRRF1、C11orf82、BARD1、CAPG、PKMYT1、CGRRF1参与细胞周期调节。壁滋养层特异基因共同调节囊胚孵化和胚胎植入过程中的蛋白水解及滋养层细胞侵润能力。胚胎植入的重要标志是滋养层细胞向子宫内膜侵入, 滋养层细胞不断分裂并与合体滋养层融合, 使后者不断向外扩张以至于发生中空形成初级绒毛[24]。本研究结果显示壁滋养层细胞在胚胎植入中协同极滋养层细胞和子宫内膜, 发生有限、精细调控的细胞外基质局部降解, 并伴随组织重塑和改建, 显示壁滋养层细胞在时间和空间上协调囊胚孵化和胚胎植入过程, 壁滋养层细胞可能同时参与并精细调节几个生物学过程, 某些特异基因是某一过程的激活因子同时也是另外过程的抑制因子。
本研究壁滋养层细胞特异基因KEGG信号通路分析显示, 这些特异基因参与B细胞受体、T细胞受体、白细胞跨内皮移植、VEGF、间隙连接、GnRH、细胞凋亡等信号通路。壁滋养层细胞特异基因表达可能调节T细胞、B细胞和中性粒细胞, 调节母体对子代的同种异体移植的免疫响应, 同时通过调控细胞因子的表达来调节滋养层细胞的侵袭和胎盘形成。B细胞和中性粒细胞在抗原递呈、维持炎性平衡, 多因子相互协调促进胚胎植入[25]。壁滋养层细胞特异基因参与VEGF信号通路, 对胚胎黏附和发育以及母胎界面细胞外基质黏附作用均有重要影响, 另外VEGF信号通路在胚胎植入早期母胎界面基底部、螺旋动脉内皮细胞、腺上皮细胞都有特异表达。正常有序的血管发生对胚胎植入和胎盘形成至关重要, 异常血管发生将阻断胚胎植入和导致多种妊娠疾病[26], 说明壁滋养层细胞参与胚胎植入过程中血管新生和母胎界面蜕膜组织血管通透性的调节。
综上所述, 关于胚胎植入和异位妊娠研究表明, 对胚胎植入起关键作用的基因和分子可能不是来源于母体, 而是来源于胚胎, 母胎界面组织只是提供胚胎发育的载体。既往的研究多将胚胎滋养层细胞作为一个整体, 研究基因表达时间顺序演变, 进行缺少细胞基因表达空间研究, 本研究对人胚胎植入前囊胚极/壁滋养层细胞进行基因表达分析, 发现人类胚胎是极滋养层细胞着床, 其特异表达基因主要参与转录、能量代谢、氧化应激、离子转运、蛋白合成及运输、细胞周期调节、肌动蛋白增长等生物功能, 以及泛素介导的蛋白水解、氧化磷酸化、Wnt信号通路、雌雄激素代谢等信号通路。壁滋养层细胞特异表达基因主要参与蛋白分解代谢、细胞周期停滞、细胞凋亡、激活MAPK、碳水化合物运输、突触负调节、细胞生长、钙通道激活、正向B 细胞分化、T细胞凋亡等生物功能, 以及B细胞受体、T细胞受体、白细胞跨内皮移植、VEGF、间隙连接、GnRH、细胞凋亡等信号通路, 显示胚胎植入在空间上的复杂调控、精细平衡、协调同步的生理过程需要极/壁滋养层细胞相互协调共同完成。
(志谢:北京大学第三医院生殖中心提供病例标本来源, 特此致谢!)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|