目的 研究由选择性激光熔化(selective laser melting,SLM)技术制备的钛种植体的粗糙表面对种植体周围早期骨矿化沉积率的影响。方法 在两只成年雄性比格犬下颌骨愈合拔牙窝分别植入SLM种植体和大颗粒喷砂酸蚀(sandblasted, large-grit, acid-etched, SLA)种植体共16颗,分为埋入愈合和穿龈愈合即刻负重,在植入后2、4、8周分别注射3种四环素类荧光标记物,用以标记和观察新骨。植入12周时处死两只比格犬,制作硬组织切片共16张,经甲苯胺蓝染色后在光学显微镜和激光扫描共聚焦荧光显微镜下观察标本,对比各组种植体周围的新骨形成情况并计算平均骨矿化沉积率。结果 SLM种植体在植入术后12周与骨组织之间形成了良好的骨结合,新生骨在其粗糙表面爬行生长并渗透于孔隙之间,SLM种植体的平均骨矿化沉积率明显高于SLA种植体( P<0.01)。结论 SLM法制备的钛种植体可以促进种植体周围早期骨整合,提高早期骨矿化速率。
Objective: To evaluate the influence of the rough surface of dental implants prepared by selective laser melting (SLM) on early bone healing around titanium implants.Methods: A total of sixteen titanium implants were involved in our research, of which eight implants were prepared by SLM (TIXOS®Cylindrical, Leader-Novaxa, Milan, Italy; 3.3 mm×10 mm, internal hex) and the other eight were sandblasted, large-grit and acid-etched (SLA) implants (IMPLUS® Cylindrical, Leader-Novaxa, Milan, Italy; 3.3 mm×10 mm, internal hex). All of the dental implants were inserted into the healed extraction sockets of the mandible of two adult male Beagle dogs. Half of the dental implants were designed to be healed beneath the mucosa and the other half were intended to be healed transgingivally and were immediately loaded by acrylic resin bridge restoration. Three types of tetracycline fluorescent labels, namely calcein blue, alizarin complexone and calcein, were administered into the veins of the Beagle dogs 2, 4, and 8 weeks after implant placement respectively for fluorescent evaluation of newly formed bone peri-implant. Both Beagle dogs were euthanized 12 weeks after implant insertion and the mandible block specimens containing the titanium implants and surrounding bone and soft tissue of each dog were carefully sectioned and dissected. A total of 16 hard tissue slices were obtained and stained with toluidine blue for microscopic examination and histomorphometric measurements. Histological observation was made for each slice under light microscope and laser scanning confocal microscope (LSCM). Comparison on new bone formation around titanium implants of each group was made and mineral apposition rate (MAR) was calculated for each group.Results: Dental implants prepared by selective laser melting had achieved satisfying osseointegration to surrounding bone tissue after the healing period of 12 weeks. Newly formed bone tissue was observed creeping on the highly porous surface of the SLM implant and growing into the pores of surface structure. Higher MAR values were shown for SLM implants compared with SLA implants ( P<0.01).Conclusion: Dental implants prepared by selective laser melting could promote early bone healing and improve mineral apposition rate.
众所周知, 粗糙的种植体表面更有利于种植体周围早期骨愈合[1, 2]。传统的种植体系统以钛金属棒为原料, 通过机加工制作, 然后进行喷沙和酸处理, 以获得较为粗糙的种植体表面结构, 即大颗粒喷砂酸蚀(sandblasted, large-grit, acid-etched, SLA)种植体。选择性激光熔化(selective laser melting, SLM)是一项较新发明的种植体制作工艺, 通过电脑完成虚拟三维设计, 将微米级钛金属粉末作为原料, 控制激光束热源的输出能量和运行轨迹, 逐步熔结、叠加钛金属粉末, 从而形成钛种植体, 并在其表面形成一层约200 μ m厚的具有三维复杂结构的种植体-骨接触面[3]。根据这一原理, 可以一步工序制作完成具有特定复杂表面结构的种植体, 其高孔隙率的表面形貌结构大大增加了可用表面积, 更有利于从组织液中吸附各种生物分子, 这个过程可能会给种植体表面血凝块的形成和纤维蛋白附着提供更多的机会, 这两者都是初始骨愈合过程的关键[4, 5]。已有文献显示SLM种植体更有利于新骨的生长[6], 并能获得与SLA种植体相媲美的种植体-骨接触率(bone-to-implant contact, BIC)[7, 8], 但目前尚缺乏更多对此类种植体与SLA种植体在早期骨愈合方面的动物实验研究。
本研究选取比格犬进行动物实验, 采取免疫荧光标记的方式, 旨在对比SLM种植体与SLA种植体在两种不同负载方式下的骨矿化沉积率(mineral apposition rate, MAR), 以探讨SLM这种特殊的种植体表面结构对早期骨愈合的影响。
由北京玛斯生物技术有限公司提供两只1岁龄健康雄性比格犬, 体重分别为10 kg和13 kg, 饲养于北京大学医学部实验动物中心, 饲养级别为清洁级。本研究通过北京大学生物医学伦理委员会批准(批号:动2011-60)。
所有实验操作均由同一实验组成员在相同实验环境下完成, 拔除两只比格犬下颌第二、三、四前磨牙和第一磨牙, 以3%(体积分数)戊巴比妥钠按1 mL/kg体重静脉注射进行全身麻醉, 气管插管, 2%(体积分数)利多卡因加肾上腺素(体积比为1 ∶ 100 000)进行局部麻醉, 以减少术区出血, 以复方氯己定含漱液(商品名:洗必泰)冲洗口腔30 s。拔牙时使用涡轮钻针颊舌向进行分牙, 将由根分叉分开的牙根分别钳拔挺出, 术中尽量避免骨破坏, 伤口用可吸收线(4/0)缝合。术后1周给予阿莫西林(500 mg, 2次/d, 口服)抗感染, 比格犬术后至整个实验结束一直给予软食。
拔牙后3个月进行种植体的植入手术:分别在两只比格犬的下颌骨一侧植入4颗SLM种植体(TIXOS® Cylindrical, Leader-Novaxa, Milan, Italy; 3.3 mm× 10 mm, internal hex), 另一侧植入4颗SLA种植体(IMPLUS® Cylindrical, Leader-Novaxa, Milan, Italy; 3.3 mm× 10 mm, internal hex)。下颌前部两颗种植体为埋入式, 后部两颗种植体安放临时基台, 制作树脂联冠, 咬合轻接触。伤口用可吸收线(4/0)缝合。术后1周给予阿莫西林(500 mg, 2次/d, 口服)和布洛芬(600 mg, 3次/d, 口服), 每周观察愈合情况并用洗必泰冲洗口腔。分别在植入后2、4、8周按20 mg/kg的剂量静脉注射钙黄绿素蓝、茜素络合物和钙黄绿素(Sigma Chemical Co., USA)。
术后12周对比格犬实施安乐死, 取得包含有种植体的下颌骨块共4块, 拍摄X线片。标本经10%(体积分数)甲醛溶液固定, 流水冲洗, 乙醇溶液逐级脱水, 包埋, 最终制备出包含有单颗种植体的硬组织切片共16张, 进行甲苯胺蓝染色。全部16颗种植体根据不同种类和负重方式共分4组, 具体见表1。
| 表1 实验分组 Table 1 Groups of the experiment |
1.3.1 大体观察和X线片检查 临床检查种植体有无松动、脱落, 周围牙龈是否红肿, 树脂联冠是否存留, 有无破损。拍摄X线片检查种植体周围是否有明显骨吸收影像。
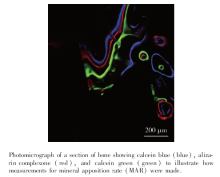
1.3.2 组织学观察 分别在普通光学显微镜和激光扫描共聚焦荧光显微镜下对切片进行观察、拍照。共选取3个合成图像视野, 每个视野中的3条标记物条带上各选取10个点, 应用Image-Pro Plus 6.0(Media Cybernetics, Inc.)图像处理软件测量条带间距, 除以时间即得到种植体周围平均骨矿化沉积率。
采用SPSS 19.0软件对定量结果进行统计学分析, 定量数据均采用均数± 标准差表示。各组数据之间的比较采用独立样本t检验(independent-samples t test), 检验水准α =0.05, P< 0.05为差异有统计学意义。
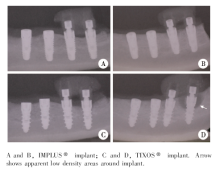
植入术后12周, 所有种植体均存留于比格犬口腔, 未发生脱落。树脂联冠未发生破损、脱落。组C有一颗种植体出现轻微松动, 局部牙龈红肿, X线片显示该种植体颈部周围出现凹坑状低密度骨吸收影像, 提示该处已发生种植体周围炎(图1D箭头所示), 在之后的组织学观察和数据计算统计中均未纳入该颗种植体, 其他15颗种植体临床检查均未发现明显炎症且无松动, X线片显示骨结合良好(图1)。
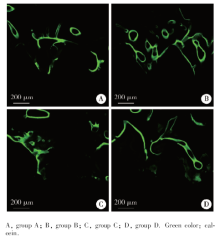
图2显示种植体植入术后12周, 各组种植体与骨组织之间接触面的情况。各组种植体与骨组织之间均形成了良好的骨结合, 未发现明显的炎症细胞浸润或纤维组织包裹。种植体-骨接触面可见大量类骨质和成骨细胞, 骨组织内可见骨吸收陷窝和大量编织状新骨形成。图2C和D中的箭头指示处可见新生骨在种植体的粗糙表面爬行生长并渗透于孔隙之间。
图3显示了钙黄绿素蓝标记的种植体-骨接触面情况, 即种植体植入后2周时的新骨沉积情况。各组均可见大量蓝色标记的新生骨沉积在种植体表面及周围, 组B种植体周围蓝色标记相对最少。
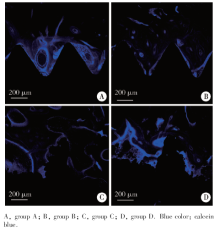 | 图3 激光扫描共聚焦荧光显微镜下钙黄绿素蓝标记各组图像Figure 3 Photographs of calcein blue labeled bone by laser scanning confocal microscopy |
图4显示了茜素络合物标记的种植体-骨接触面情况, 即种植体植入后4周时的新骨沉积情况。各组均可见大量红色标记的新生骨沉积, 组C和D种植体周围红色标记条带相对更多。
 | 图4 激光扫描共聚焦荧光显微镜下茜素络合物标记各组图像Figure 4 Photographs of alizarin labeled bone by laser scanning confocal microscopy |
图5显示了钙黄绿素标记的种植体-骨接触面情况, 即种植体植入后8周时的新骨沉积情况。各组均可见大量绿色标记的新生骨沉积。
利用3种标记物的合成图像计算各组的平均MAR(图6), 统计学结果显示, 不论在即刻负重还是埋入条件下, 植入术后早期两种种植体表面的平均MAR差异均有统计学意义(表2), 即骨愈合早期SLM种植体表面的骨矿化沉积率明显高于SLA种植体。
| 表2 各组的MAR比较和t检验分析 Table 2 MAR values and independent-samples t test of each groups |
自从种植体表面结构被认为是促进骨整合的关键因素以来, 大量实验研究开始聚焦于如何对种植体表面进行优化处理[9, 10], 包括喷砂[11]、酸蚀[9, 12]、阳极氧化处理[13, 14]以及各种化学处理[11, 13, 15]等。大量研究表明, 粗糙表面可以促进骨愈合过程中各种细胞因子的释放, 如前列腺素E2 (prostaglandin E2, PGE2)和转化生长因子-β 1(transforming growth factor-β 1, TGF-β 1), 从而加速新骨形成[10, 11, 15], 并可能根据“ 沉积状骨形成” 模式在种植体表面直接刺激新骨形成[16]。临床研究也表明, 粗糙表面种植体的长期存留率和成功率均优于光滑表面种植体[9, 14, 17]。
与其他传统种植体的生产技术相比较, SLM工艺具有很多优势, 如可自由设计种植体表层结构, 减少工艺步骤, 材料利用率高等[3]。有报道显示, SLM种植体独特的表面多孔状微观结构含有大量边缘锋利的孔隙, 犹如砂纸或锉刀, 在植入过程中可以收集新鲜骨屑于表面孔隙中, 成为促进沉积状新骨形成的天然来源[18], 这是普通SLA种植体所不可比拟的。另外, SLM种植体的特殊表层结构还具有与骨组织更接近的弹性模量, 一定程度上减轻了不良负荷对骨改建造成的不利影响[19]。目前对此类种植体的研究报道相对较少, Mangano等[20]所进行的多中心前瞻性临床研究显示, 内螺旋SLM种植体在上、下颌固定修复中均取得了良好的预后效果。相关的组织学研究显示, SLM种植体表面能够促进新骨形成, 并具有更强的骨诱导能力, 其BIC在骨愈合早期高于SLA种植体[21]。Shibli等[22]对30位患者上颌后部进行不同种类微植体植入, 术后8周取出植体进行组织学观察, 结果显示SLM微植体的BIC高于SLA微植体。
本研究以比格犬进行动物实验, 对SLM和SLA种植体进行了组织学对比研究, 光学显微镜下观察的结果显示二者在植入术后12周时均形成了良好的骨整合, 且可以看到骨组织沿SLM种植体的粗糙表面爬行并向孔隙内部长入, 这与以往文献结果一致。Peng等[23]发现术后12周SLM种植体的表面孔隙被新生骨渗透长入并填满。
本研究为了探讨早期骨愈合情况, 在种植体植入后2、4和8周分别对比格犬进行了四环素类药物的静脉注射, 此类药物对钙离子有高亲和力, 静脉注射后几分钟内便可快速结合血浆中的钙离子, 在种植术后不同时间点进行打药并测量不同染料间距可以直观显示新骨沉积情况, 并能计算出新生骨的平均MAR, 对研究种植体周围早期骨愈合机制具有推断作用。本实验结果显示, 在即刻负重和埋入两种条件下, 植入术后2~4周和4~8周, SLM种植体的平均MAR均高于SLA种植体, 提示SLM种植体表面能促进早期新骨形成。以往尚未见对SLM种植体进行荧光标记的文献报道, Foley等[24]对SLA种植体进行了荧光标记, 得出其MAR值为(0.99± 0.84) μ m/d, 本实验计算所得的MAR值高于该报道, 可能与SLM种植体的特殊表面结构更有利于骨结合有关。
临床上将即刻负重(immediate loading)定义为植入后2 d内开始负载[25]。临床研究报道, 即刻负重可以获得与延期负重相类似的成功率, 前提条件为种植体具有良好的初期稳定性且负重不宜过大[26]。本研究中比格犬给予软食且将树脂联冠调为轻接触, 但仍存在一些不可控因素, 不能完全控制负载大小。组C有一颗种植体发生明显骨吸收, 可能与比格犬口腔卫生欠佳及咀嚼力不易控制有关。另外, 本实验所得结果受样本量所限, 为进一步探讨SLM种植体表面的特殊性质, 对比其在不同负载下的骨整合情况, 尚需要更大样本的组织学研究加以验证。
本研究应用荧光标记法对SLM种植体和SLA种植体进行了组织学观察和对比, 结果显示SLM种植体具有更高的平均骨矿化沉积率, 提示其对早期骨愈合有促进作用, 更有利于早期新骨形成。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|