目的 通过观察精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp polypeptedes,RGD)多肽表面修饰多孔钽对MG63成骨样细胞-多孔钽结合界面形态变化以及相关成骨因子表达的影响,评价RGD修饰多孔钽对钽-骨界面骨整合所起的重要作用。方法 直径10 mm、厚3 mm的多孔钽片通过表面吸附法分别将3种质量浓度的RGD溶液(1 g/L、5 g/L、10 g/L)吸附于多孔钽表面。取第2代MG63成骨样细胞与钽-RGD复合培养成为成骨细胞/钽/RGD复合物,分为4组:未修饰Ta组(对照组),1 g/L成骨细胞/Ta/RGD组,5 g/L成骨细胞/Ta/RGD组及10 g/L成骨细胞/Ta/RGD组。扫描电子显微镜观察多孔钽及复合物外观特征、成骨细胞与Ta/RGD界面的相互作用,测定成骨细胞在Ta/RGD材料上的黏附率,免疫细胞化学染色检测各组成骨蛋白骨钙蛋白(osteocalcin,OC)、纤维连接蛋白(fibro-nectin,FN)及丝状肌动蛋白(filamentous actin, F-actin)的表达。结果 扫描电子显微镜观察,成骨细胞在RGD修饰后多孔钽界面铺展并向孔隙内伸延,分泌细胞外基质覆盖于多孔钽微孔内及界面。24 h、48 h及72 h各组成骨细胞在Ta/RGD材料界面的黏附率均高于未修饰组(对照组),其中5 g/L成骨细胞/Ta/RGD组在48 h的黏附力最强[(68.07±3.80) vs. (23.40±4.39), P<0.05]。免疫细胞化学染色发现,成骨细胞与Ta/RGD复合培养48 h成骨细胞OC、FN及F-actin的阳性表达均高于未修饰组,其中5 g/L成骨细胞/Ta/RGD组高于10 g/L组及1 g/L组[OC:(18.08±0.08) vs. (15.14±0.19), P<0.05;(18.08±0.08) vs. (14.04±0.61), P<0.05。FN:(24.60±0.98) vs. (15.90±0.53), P<0.05;(24.60±0.98) vs. (15.30±0.42), P<0.05。F-actin:(29.20±1.31) vs. (24.50±1.51), P<0.05;(29.20±1.31) vs. (16.92±0.40), P<0.05]。细胞骨架蛋白F-actin呈丝状分布于胞质,沿细胞胞突纵向排列,其蛋白表达高于OC及FN。结论 RGD多肽有利于成骨细胞在多孔钽界面黏附、铺展及细胞骨架蛋白的重组,从而促进成骨细胞-多孔钽界面改建及骨整合。
Objective: To investigate the effects of the Arg-Gly-Asp polypeptedes (RGD) peptides-modified porous tantalum surface on osteoblasts morphology and expressions of osteogenesis factors, and to evaluate RGD peptides promotes junctura ossium of tantalum-bone interface in vivo.Methods: RGD peptides of different concentrations (1 g/L, 5 g/L, and 10 g/L) were loaded to porous tantalum slices with a diameter of 10 mm and a thickness of 3 mm by physical absorption. The 3rd generation of MG63 cells were co-cultured with tantalum and divided into 4 groups: Ta-cells (control) group, 1 g/L cells/Ta/RGD group, 5 g/L cells/Ta/RGD group, and 10 g/L cells/Ta/RGD group. Porous tantalum compo-sites and osteoblasts-tantalum interface were observed by scanning electron microscopy. The adhesion rate of osteoblasts was detected and immunocytochemistry was used to detect the expressions of filamentous actin (F-actin), osteocalcin (OC) and fibronectin (FN).Results: The scanning electron microscope (SEM) revealed that osteoblasts distributed on the surface of porous tantalum and secreted extracellular matrix on outside and inner of micro-pores. The osteoblasts adhesion rate on porous tantalum modified with RGD was higher than that in the unmodified porous tantalum at the end of 24, 48, and 72 hours. The best adhesion effect was got in 5 g/L cells/Ta/RGD group at hour 48 [(68.07±3.80) vs. (23.40±4.39), P<0.05]. The results of immunocytochemistry showed that the expressions intensity of F-actin, OC and FN in osteoblasts on porous tantalum modified groups with RGD were stronger than that in the unmodified groups, and the expressions of 5 g/L cells/Ta/RGD group were significantly higher than those in the 10 g/L group and 1 g/L group [OC: (18.08±0.08) vs. (15.14±0.19), P<0.05; (18.08±0.08) vs. (14.04±0.61), P<0.05. FN: (24.60±0.98) vs. (15.90±0.53), P<0.05; (24.60±0.98) vs. (15.30±0.42), P<0.05. F-actin: (29.20±1.31) vs. (24.50±1.51), P<0.05; (29.20±1.31) vs. (16.92±0.40), P<0.05]. Correspondingly F-actin in osteoblasts was showed in longitudinal arrangement, and the expressions intensity was stronger than those OC and FN.Conclusion: The RGD peptides is beneficial to enhance adhesion of osteoblast, spreading and reorganization of cytoskeleton on porous tantalum surface and improve the interface morphology, further promoting osteoblasts-tantalum conjunctive interface osseointegration.
将金属材料植入骨组织以代替修复骨损伤及缺损, 这就要求植入材料与其周围的宿主骨能达到良好紧密的结合。金属材料与骨组织直接接触、长入且融合为一体, 是理想的界面形式[1, 2], 而植入材料之所以能成功, 在于植入材料与人体骨之间早期的相互作用, 即形成骨性结合。在影响金属材料与骨界面形成的诸多因素中, 材料表面的理化特性及材料的表面改性是其中重要因素[3]。
多孔钽是近年来出现的较为理想的医用植入金属材料, 它的立体三维构型及多孔结构与人松质骨极为相似, 同时具有良好的细胞亲和性、生物相容性及骨传导能力, 在植入时可使其周围细胞快速黏附并向孔隙内生长, 最终由机械固定变为生物固定[4, 5, 6]。
含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp polypeptedes, RGD)片段的多肽是整合素与配体相互结合的细胞识别作用位点, 在细胞外基质糖蛋白、胶原蛋白、纤维蛋白原、骨桥蛋白中介导细胞与支架材料黏附、分化并可加强细胞外基质蛋白之间的相互作用, 是目前作为细胞黏附序列最有效且应用最广的多肽性物质。RGD多肽可修饰支架材料植入体内, 增加细胞黏附, 促进细胞增殖而并不会影响机体组织的酶活性和代谢[7, 8]。
本研究应用RGD多肽对国产多孔钽材料表面进行修饰及改性, 同时与MG63成骨样细胞进行复合培养, 倒置相差显微镜及扫描电子显微镜观察不同时间点成骨样细胞形态变化及细胞-钽结合界面相互作用并计算细胞黏附率。免疫细胞化学检测骨钙蛋白(osteocalcin, OC)、纤维连接蛋白(fibronectin, FN)、丝状肌动蛋白(filamentous actin, F-actin)在多孔钽修饰前后的表达水平, 从而评价RGD多肽在材料表面修饰对成骨细胞-钽界面骨整合能力及生物学性能的影响。
本研究使用的主要试剂、细胞株及仪器有:多孔钽材料(重庆润泽医疗器械有限公司), MG63成骨样细胞(中国医学科学院基础医学研究所), 环RGD多肽(上海淘普生化有限公司), DMEM、胰蛋白酶、FBS(Gibco公司, 美国), 兔抗人F-actin、OC、FN多克隆抗体(Abgent 公司, 美国), PV-9000 两步法免疫细胞化学试剂盒(北京中杉金桥生物技术有限公司), 倒置相差显微镜(Nikon 公司, 日本), S-4800扫描电子显微镜(电子株式会社, 日本), Bio-Rad 680 酶标仪(Bio-Rad公司, 美国), 3K30高速冷冻离心机(Sigma公司, 德国)。
取MG63成骨样细胞, 复苏并加入含10%(体积分数)胎牛血清、含双抗各100 U/mL的DMEM培养液, 37 ℃、5%(体积分数)CO2及饱和湿度孵育箱培养。每日换液且在倒置相差显微镜下观察细胞生长状态及形态特点。待细胞生长融合至80%~90%时传代。取生长良好的第2代细胞接种于24孔板内先进行碱性磷酸酶(alkaline phosphatase, ALP)、Ⅰ 型胶原免疫细胞化学染色鉴定成骨细胞。
直径10 mm、高3 mm的扁圆柱形多孔钽材料用去离子水超声清洗, 高压蒸汽灭菌后干燥。以物理吸附法将多孔钽分别置于3种质量浓度(1 g/L、5 g/L、10 g/L)的50 mL RGD多肽溶液中充分浸泡, 使钽孔隙内充分浸入RGD溶液, 取出后室温充分干燥, 紫外线照射备用。
实验分为4组:未修饰Ta组(对照组), 1 g/L、5 g/L、10 g/L成骨细胞/Ta/RGD组。
将预先修饰处理好的各组及对照组多孔钽置入24孔板中, 每孔钽加入200 μ L DMEM培养液于培养箱内预湿过夜, 取生长状态良好的第2代成骨细胞, 将调整细胞含量为1× 106/mL的单细胞悬液200 μ L接种于多孔钽表面及内部, 并于支架周边缓慢加入含10%胎牛血清的DMEM培养液使其没过多孔钽, 培养箱内培养, 每日更换培养液, 于1、2、3 d取出用于实验。
取修饰后各组成骨细胞/Ta/RGD复合物, 磷酸盐缓冲液(phosphate buffered solution, PBS)冲洗后, 25 g/L戊二醛溶液固定4 h, 梯度乙醇溶液脱水, 临界点干燥、喷金。扫描电子显微镜观察比较各组不同时间成骨细胞在Ta/RGD材料上的形态变化及相互作用。
将各组Ta/RGD置于24孔板, 每孔支架滴加200 μ L DMEM培养液, 培养箱内预湿过夜, 吸取细胞含量为1× 106/mL的成骨细胞悬液200 μ L接种到各组Ta/RGD表面及内部, 然后再加DMEM培养液使其没过多孔钽, 继续培养并于1、2、3、4 d分别取出各组支架材料, PBS冲洗, 转移至新24孔板内, 每孔加500 μ L的0.25%(体积分数)胰蛋白酶消化, 计数板计数取平均值, 计算细胞黏附率(黏附率=黏附细胞数/接种细胞数× 100%)。
分别取培养第2天的各组Ta/RGD/成骨细胞复合物, 0.25%胰蛋白酶消化, 转移至6孔板内的盖玻片上做细胞爬片。按照王茜等[9]和张辉等[10]的研究方法行免疫细胞化学染色, 检测各组成骨蛋白OC、FN、F-actin的表达。
图像分析及结果判定:各组选取3张切片在高倍镜(× 200)下选取5个(四周及中央)视野计数, 取其均值。阳性细胞采用统计分析软件Image Pro-Puls进行统计分析, 以积分光密度(integrated optical density, IOD)值作为表达量。
结果数据釆用SPSS 20.0统计软件分析处理, 统计量以均数± 标准差表示, 对各组数据采用单因素方差分析(one-way ANOVA), 以SNK检验(Student-Newman-Keuls)进行组间比较, P< 0.05为差异有统计学意义。
多孔钽材料断面为10 mm× 3 mm扁圆形、呈灰黑多孔状, 孔约为针孔大小。在RGD多肽修饰前, 扫描电子显微镜下可见钽表面微孔状结构相互连通并向深部延伸, 小孔直径约200~700 μ m, 间隔均匀一致。经不同浓度RGD多肽修饰后, 多孔钽界面为灰色, 可见一层均质状涂层覆盖、包裹, 使小孔状结构稍变浅, 但孔状结构仍清晰(图1)。
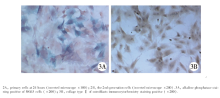
倒置相差显微镜观察:MG63原代成骨样细胞在与Ta/RGD复合之前其形态多为小圆形状, 大小一致, 部分悬浮, 10 h后开始贴壁, 24 h开始体积增大, 传代后体积开始增大, 形状呈梭形及多角形, 胞浆丰富(图2A、B), ALP、Ⅰ 型胶原免疫细胞化学染色阳性(图3A、B)。
扫描电子显微镜观察:在RGD修饰多孔钽之前成骨细胞在多孔钽表面生长, 数量少且细胞伪足细、胞体小(图4A、B), 当细胞与Ta/RGD复合后胞体开始伸出伪足并随时间的延长逐渐伸长。细胞伪足24 h后向四周伸展但并无方向性, 细胞与多孔钽界面结合紧密, 随着复合培养时间延长, 细胞出现不规则形状, 伪足进一步伸展并附于多孔钽孔隙边缘, 与钽片表面结合紧密, 或平铺于孔隙表面或深入孔洞内部(图4C、D)。48 h时各组细胞进一步增大, 扁平、多角形, 胞突伸长并跨越钽间隙及孔洞(图4E、F)。72 h上述各组细胞与多孔钽表面界面贴附紧密, 胞体以扁平状为主, 覆盖大部分钽表面, 相邻细胞相互融合, 细胞伪足突起增多, 除深入相邻较大空洞, 上下联通的细小孔洞也已穿越, 细胞之间突起相互连接(图4G、H)。
成骨细胞接种于修饰前后的Ta/RGD材料, 检测各组Ta/RGD/成骨细胞复合后24 h、48 h及72 h的细胞黏附率, 结果RGD多肽修饰多孔钽各组的黏附率均高于未修饰组(对照组, P< 0.05), 组间差异均有统计学意义(P< 0.05), 提示RGD多肽修饰多孔钽可明显促进成骨细胞在多孔钽界面的黏附生长, 其中, 5 g/L成骨细胞/Ta/RGD组及10 g/L成骨细胞/Ta/RGD组的界面黏附能力均高于1 g/L组, 但以5 g/L组的黏附率最高。同时, 各组细胞的黏附率在24 h、48 h及72 h之间比较均不同, 以48 h时黏附率达到最高, 各时间点之间的比较差异均有统计学意义(P< 0.05, 表1)。
| 表1 成骨细胞在Ta/RGD复合材料界面生长的黏附率( $\bar{x}$ ± s, n=6) Table 1 The adhesion rate of osteoblasts attached to RGD peptides-modified porous tantalum ( $\bar{x}$ ± s, n=6) |
免疫组织化学染色观察多孔钽经RGD修饰前后成骨细胞与其复合培养48 h OC、FN及F-actin蛋白的表达。免疫细胞化学图像分析结果显示, 各组成骨细胞OC、FN及F-actin的阳性物质均位于胞质, 呈棕黄色。修饰后3种蛋白表达强度均高于修饰前(图5A~C)。F-actin表达的细胞骨架蛋白呈丝状分布于胞质, 同细胞突起方向一致。1 g/L、5 g/L及10 g/L成骨细胞/Ta/RGD组与未修饰Ta组的IOD值比较, 差异均有统计学意义(P< 0.05); 组间比较, 5 g/L成骨细胞/Ta/RGD组高于10 g/L及1 g/L组(P< 0.05, 图5D~F); 同时, F-actin的表达高于OC、FN (P< 0.05), 具体见表2。
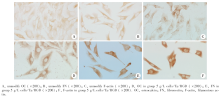 | 图5 成骨细胞与Ta/RGD复合培养48 h各组免疫细胞化学染色结果Figure 5 Immunocytochemical staining of RGD/tantalum/osteoblasts composites at 48 hours |
| 表2 免疫细胞化学检测成骨细胞与Ta/RGD复合培养48 h OC、FN及F-actin的表达(IOD, $\bar{x}$ ± s, n=3) Table 2 Expressions of OC, FN, and F-actin by immunocytochemical staining at 48 hours (IOD, $\bar{x}$ ± s, n=3) |
当金属骨移植材料植入骨内修复骨缺损时, 骨内植入成功的首要条件是形成预期的植入材料-骨结合界面。影响界面形成的诸多因素中, 金属材料表面的物理特性是重要因素之一[11, 12]。一些学者认为, 植入材料表面的粗糙程度以及表面修饰后可与骨结合更紧密, 有助于骨结合界面的形成, 其机制是植入材料与骨界面之间的微观结构发生了改建, 此种改建是一个动态变化过程, 当界面的机械负荷(植入材料)增加, 将力学刺激信号传导给效应细胞(成骨细胞), 诱发了一系列相应的生物学效应以完成成骨过程, 首先是材料-骨界面活跃的成骨细胞分泌细胞外基质蛋白(如OC、FN、Ⅰ 型胶原、骨桥蛋白、骨唾液蛋白等)参与成骨的信号传导, 其次是激活了转化生长因子-β (transforming growth factor-β , TGF-β )、骨形态发生蛋白(bone morphogenetic proteins, BMPs)、胰岛素样生长因子(insulin like growth factor, IGF)等参与新生骨的增殖和分化[13, 14, 15]。
RGD多肽是精氨酸-甘氨酸-天冬氨酸3个氨基酸构成的短肽复合体, 存在于纤连蛋白、骨桥蛋白、骨涎蛋白等细胞外基质蛋白中, 也是细胞外基质中的组成成分, 可作为细胞膜整合素受体与细胞外配体结合的识别位点, 当与细胞表面整合素蛋白结合时, 可促进细胞与细胞间黏附[16, 17]。经过外源性RGD多肽表面处理后的植入材料既保留了原有的理化性能及生物相容性, 同时又赋予了新的表面活性, 能够更好地促进细胞的黏附, 与周围组织发生牢固而持久的结合。当材料表面RGD与细胞直接接触后使界面没有其他成分介入, 提高了材料-细胞界面结合的成功率。RGD按其结构特点分为线性肽和环状肽, 大多数线性RGD肽在体内半衰期短, 对整合素受体亲和力低, 容易被蛋白酶降解, 环形RGD肽具有更高的受体结合特异性, 与整合素的结合强度是线形RGD肽的100倍。将环RGD吸附多孔钽修饰其表面, 能明显促进成骨细胞增殖、黏附和铺展。但无论何种修饰物与植入材料的结合量, 目前对此均无精确、可靠的测量及计算方法。有学者通过粗糙度测试仪测得涂层的厚度, 间接推测涂层材料的结合量[18, 19]。
本研究将环RGD肽处理多孔钽材料表面, 在其表面形成致密膜状结构, 呈多孔状粗糙结构, 进一步增加了RGD与多孔钽接触面积, 其后再将MG63成骨样细胞与经环RGD多肽修饰后的多孔钽复合培养, 观察修饰前后钽-骨界面形成的微观形态变化及细胞黏附率, 结果显示, 经不同浓度RGD多肽修饰后多孔钽表面可见覆盖均质层状涂层结构, 小孔稍变浅, 但相互连通的孔状结构仍清晰。成骨细胞在与Ta/RGD复合之前其形态从小圆形状逐渐贴壁, 体积增大, 形状为多角形或梭形, 当与Ta/RGD复合后胞体进一步增大, 细胞伪足向四周伸展, 与多孔钽界面结合紧密, 随着RGD修饰浓度的增加及Ta/RGD/成骨细胞复合时间的延长, 细胞伪足进一步伸展并附于多孔钽孔隙边缘, 与钽表面结合紧密, 或平铺于孔隙表面或深入孔洞内部, 胞突跨越钽间隙, 胞体覆盖大部分钽表面, 相邻细胞相互融合。
植入材料表面的特性可直接影响细胞的黏附和细胞的分化乃至于组织的愈合。由细胞表面整合素受体调节的细胞与植入材料的黏附是一个复杂的过程, 细胞在材料表面的初期黏附决定了细胞其后的铺展、增殖和分化。RGD修饰多孔钽对成骨细胞的黏附具有促进作用。当细胞一旦接触到RGD修饰后的钽表面时, 成骨细胞膜上的整合素受体即可识别材料表面的RGD短肽序列, 从而加速了细胞的黏附过程, 而细胞铺展、延伸及体积增大则发生在细胞黏附之后[20]。
本研究采用的多孔钽材料是我国具有自主知识产权的骨移植金属材料, 其粗糙的表面及内部丰富的多孔状结构形成了良好的材料-成骨细胞接触界面, 十分有益于细胞的吸附。本研究各组Ta/RGD/成骨细胞复合后24 h、48 h及 72 h细胞黏附率均高于未修饰组, 但以5 g/L 成骨细胞/Ta/RGD组在48 h时的黏附率最高, 说明此种条件下RGD多肽在体外通过改变多孔钽表面形貌, 增加其粗糙度进而增强了钽-成骨细胞界面黏附力, 使细胞充分伸展, 相邻细胞突起融合、相互攀附, 细胞生长及生物学行为能更好的体现, 同时, 植入体内后也可增强钽-骨界面的机械锁合作用, 促进诱导骨整合作用。
本研究还通过免疫细胞化学方法检测成骨细胞与钽界面相互作用后骨架丝状肌动蛋白F-actin、成骨相关蛋白OC、FN的表达模式, 探讨成骨细胞-钽界面相互作用后成骨分化过程中的分子机制, 结果发现, 成骨细胞与Ta/RGD复合培养后48 h, 5 g/L RGD条件下, 细胞黏附率达到最高时, F-actin、OC、FN蛋白均呈阳性表达, 其中F-actin的表达最强, 呈丝状分布于胞质, 并同细胞长轴平行一致。
细胞骨架是细胞内呈细丝纤维状结构的蛋白质成分, 通过膜蛋白感受细胞外基质变化从而激活胞内信使, 传递细胞内外信息, 在基因及蛋白水平引导相应基因表达、蛋白合成、细胞增殖、形态改变以及细胞运动[21]。微丝蛋白actin是细胞骨架的一部分, 其结构与膜性蛋白脂质结构(细胞膜及核膜)相连接, 参与维持细胞形态、分裂、细胞内物质转运及信号转导功能, 是细胞生长重要的内部环境基础。细胞内actin包括聚合态(F-actin)和游离态(G-actin)。正常时细胞内两种actin处于动态平衡状态, 当受到外界刺激后, 细胞内游离G-actin自身旋转, 骨架结构彼此结合、重排成为螺旋状微丝, 即成为F-actin。细胞骨架与细胞的功能关系密切[22, 23], 成骨细胞在成骨分化过程中胞体细长的胞突与相邻细胞胞突通过细胞之间的缝隙连接融合成一体来感受骨形成中外界力学变化, 此时actin结构发生重排而成为F-actin, 介导了骨生成及骨重建。
FN同OC一样是由成骨细胞合成及分泌, 对成骨细胞黏附、增殖及Ⅰ 型胶原表达起到重要作用, 同时还具有多种生物活性, 如促进细胞贴壁功能及细胞代谢[24]。
本研究结果表明成骨细胞与Ta/RGD复合培养后, 当细胞黏附移植材料的过程一旦开始, 即出现细胞肌动蛋白F-actin表达增强, 使得细胞骨架发生了改变及重组, 将信息传递到细胞内, 调控成骨基因的表达, 从而行使成骨功能。同时, 我们认为成骨细胞-钽界面的相互作用, 在力学负荷调节的作用下F-actin重组也促进了成骨细胞形态变化, 从而促进了成骨蛋白OC、FN的表达, 骨基质矿化速度加速, 细胞增殖、代谢加速及Ⅰ 型胶原表达增强。
综上, 本研究将生物活性多肽RGD与多孔钽复合可以促进成骨细胞对多孔钽等生物材料的黏附, 使成骨细胞变形、延展, 从而促进多孔钽-骨界面骨整合作用, 本研究前期的实验证实了多孔钽材料动物骨内植入具有良好的生物相容性, 可促进宿主骨长入内部孔隙结构, 促进骨组织和小血管内生性生长, 使材料与宿主之间产生稳定的连接及骨整合。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|