目的 探讨维生素K依赖的生长停滞特异性蛋白6(growth-arrest-specific protein 6,Gas6,一种维生素K依赖性蛋白,参与细胞增殖、存活、黏附和迁移,也在炎症反应中起重要作用)在牙龈卟琳单胞菌脂多糖( Porphyromonas gingivalis lipopolysaccharide, P.g-LPS)诱导血管内皮细胞(human umbilical vein endothelial cells,HUVECs)表达黏附因子和趋化因子过程中的作用。方法 在血管内皮细胞中过表达和敲低 Gas6基因后,用1 mg/L P.g-LPS刺激血管内皮细胞3 h和24 h,利用实时定量荧光聚合酶链式反应(real-time polymerase chain reaction, real-time PCR)检测细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和E选择素(E-selectin),以及趋化因子白细胞介素-8(interleukin-8, IL-8)和单核细胞趋化蛋白1(monocyte chemoattractant protein 1, MCP-1)的表达。过表达或敲低 Gas6基因后,细胞划痕实验检验内皮细胞迁移的生物学功能表型的变化。结果 P.g-LPS刺激3 h后,敲低 Gas6组的黏附因子及趋化因子的表达情况与对照组相比,差异无统计学意义( P>0.05),过表达 Gas6组的黏附因子及趋化因子与对照组相比显著降低(E-selectin、ICAM-1、IL-8和MCP-1分别下降81%±0%、47%±3%、76%±3%和26%±6%, P<0.01); P.g-LPS刺激24 h后,敲低组的黏附因子及趋化因子表达情况与对照组相比显著升高(E-selectin、ICAM-1、IL-8和MCP-1上调的倍数分别是2.06±0.07、1.99±0.11、3.14±0.15和1.84±0.03), 过表达组的黏附因子及趋化因子与对照组相比显著降低(E-selectin、ICAM-1、IL-8和MCP-1分别下降29 %±1 %、62 %±3%、69 %±1%和41 %±2 %), 实验组与对照组黏附分子及趋化分子表达差异具有统计学意义( P<0.01)。细胞划痕实验结果显示,敲低 Gas6组细胞迁移能力与对照组相比增强,过表达组细胞迁移能力较对照组弱,与real-time PCR检测结果趋势一致。结论 下调 Gas6基因后, P.g-LPS促进ICAM-1、E-selectin、IL-8和MCP-1表达作用增强,上调 Gas6基因后, P.g-LPS促进ICAM-1、E-selectin、IL-8和MCP-1表达作用减弱,各细胞因子表达量与 Gas6表达趋势相反,提示 Gas6在内皮细胞炎症状态下的黏附过程中可能发挥抑制作用。
Objective: Growth-arrest-specific protein 6 (Gas6)is a vitamin K-dependent protein and involved in cell proliferation, survival, adhesion and migration . Also it has been shown to play an important role in the inflammatory response .The aim of present study was to investigate the role of Gas6 in the process of the expression of adhesion molecules and chemokines of human umbilical vein endothelial cells(HUVECs)induced by Porphyromonas gingivalis lipopolysaccharide( P.g-LPS).Methods: After up-regulation and down-regulation of the expression of Gas6,the vascular endothelial cells were stimulated with 1 mg/L P.g-LPS for 3 h and 24 h. Real-time quantitative polymerase chain reaction(real-time PCR)was taken to detect the expression of the cell adhesion molecules:intercellular adhesion molecule-1(ICAM-1) and E-selectin, as well as chemokines:interleukin-8(IL-8)and monocyte chemoattractant protein 1(MCP-1). Wound healing assay was taken to observe the migration ability of endothelium cells in different groups.Results: After 3 h of P.g- LPS stimulation, the expression of adhesion molecules and chemokine in the down-regulation group was not significantly different from that in the control group,while in the up-regulation group the decrease of E-selectin, ICAM-1, IL-8 and MCP-1 was 81%±0%, 47%±3%, 76% ± 3%, 26% ± 6% respectively. After 24 h of P.g- LPS stimulation, the expression of adhesion molecules and chemokine in down-regulation group was significantly higher than that in control group (2.06±0.07, 1.99±0.11, 3.14±0.15, 1.84±0.03 flod), while these molecules in the down-regulation group was significantly lower than in the control group (29%±1%, 62%±3%, 69%±1%, 41%±2%). Differences were statistically significant ( P<0.01). Wounding healing assay showed that down-regulation of Gas6 enhanced migration ability of endothelial cells while up-regulation of Gas6 weakened this ability,which was consistent with the trend of real-time PCR result.Conclusion: Down-regulation of the Gas6 gene enhanced the expression of ICAM-1, E-selectin, IL-8 and MCP-1 in HUVECs after P.g- LPS stimulating, while up-regulaiton of the Gas6 gene weakened the expression of ICAM-1, E-selectin, IL-8 and MCP-1 in HUVECs after P.g- LPS stimulating,suggesting that Gas6 may play a role in the process of endothelial cell adhesion.
牙周炎是由菌斑微生物引起的牙齿周围支持组织(包括牙龈、牙周膜、牙骨质、牙槽骨)的慢性感染性口腔疾病, 是造成成人牙齿丧失的首位原因。目前已明确菌斑微生物是引发牙周病的始动因子, 其中牙龈卟啉单胞菌(Porphyromonas gingivalis, P.g)是公认的牙周致病菌之一, 是牙周病尤其是慢性牙周炎病变区或活动部位最主要的优势菌, 其所携带的毒力因子脂多糖(lipopolysaccharide, LPS)为具有很高的毒性和抗原性的活性致病物质。近年来牙周炎与动脉粥样硬化之间的关系被广泛关注, 有学者提出慢性牙周炎不仅可造成局部牙周组织功能的缺陷, 而且可能与冠心病的发生与发展存在潜在的关联[1]。关于牙周炎与心血管疾病, 2013 年欧洲牙周病学会与美国牙周病学会认为牙周炎增加了未来罹患心血管疾病的风险, 动物实验和临床研究结果支持两者的关联性[2]。目前动脉粥样硬化被认为是多种致病因子损伤心血管内皮细胞引发的一系列炎性反应所致[3], 内皮细胞损伤有多种信号途径介导, LPS可通过核转录因子(nuclear factor, NF-kappaB)途径损伤人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs), 导致后者高表达黏附分子, 在高浓度(10 mg/L)作用下, LPS可通过影响内皮细胞离子通道使钠离子内流, 导致内皮细胞损伤。生长停滞特异性蛋白6(growth-arrest-specific protein 6, Gas6)是一相对分子质量约为75 000的分泌型蛋白, 是维生素K依赖蛋白家族成员之一。Gas6目前被认为参与许多细胞过程, 包括增殖、针对凋亡的保护、吞噬作用、细胞黏附、趋化效应等[4]。本研究旨在通过上调或下调Gas6基因表达, 研究Gas6是否在P.g-LPS诱导的内皮细胞黏附、趋化等功能变化中起作用。通过相关机制的诠释将有助于更好地理解牙周炎与内皮功能紊乱的关系, 从而为探索牙周炎和动脉粥样硬化关系的潜在机制打下基础。
HUVEC购自美国Sciencell公司, P.g-LPS购自美国InvivoGen公司, 完全ECM培养基购自美国Sciencell公司, 胰蛋白酶购自美国Gibco公司, 培养瓶和培养皿购自美国Corning公司, 脂质体转染试剂lipofectamine 3000(Lipo 3000)购自美国Invitrogen公司, siRNA及质粒购自上海吉玛公司。RNA提取剂Trizol试剂购自美国Invitrogen公司, 逆转录试剂盒购自日本Takara公司; 引物均由华大基因公司负责合成; Universal SYBR Green master mix试剂购自美国Roche公司。
1.2.1 细胞培养 人脐静脉内皮细胞购得后加入完全ECM培养基[含10 %(体积分数)胎牛血清、1%(质量分数)内皮细胞生长剂、1%(质量分数)青霉素/链霉素溶液, 避光保存]离心后重悬, 培养于T-75培养瓶(2 μ g/cm2多聚赖氨酸包被后), 恒温培养箱(37 ℃, 体积分数5 %CO2)中培养, 培养至3~6代细胞用于后续研究。
1.2.2 利用siRNA敲低Gas6基因表达 siRNA在准备siRNA干扰实验前24 h, 把所需血管内皮细胞接种于60 mm培养皿(5× 105 个/皿), 培养24 h后细胞汇合至70 %~90 %, 参考转染试剂说明书将siRNA和Lipo 3000分别加入无血清Opti-MEM培养基中(siRNA序列: 5'-GCCUCCAGAUCUGCCACAATT-3', 5'-UUGUGGCAGAUCUGGAGGCTT-3'; 每孔用量: siRNA 100 pmol; Lipo 3000 5 μ L; 无血清Opti-MEM 500 μ L), 静置5 min后混合, 二者混匀后静置30 min, 将混合好的siRNA-转染试剂混合物加入换为新培养基(不含双抗)的培养皿中, 干扰12 h后再次换新培养基, 同时加入1 mg/L P.g-LPS进行刺激, 处理指定时间后收集细胞, 提取RNA, 做逆转录及real-time PCR检测。
1.2.3 Gas6过表达质粒转染血管内皮细胞 如1.2.1所述, 将Gas6过表达质粒用lipo 3000转染到血管内皮细胞中(每孔用量: DNA 5 μ g; Lipo 3000 5 μ L; Lipo 3000 Reagent 5 μ L; 无血清Opti-MEM 500 μ L), 转染12 h, 更换新培养基, 同时加入1 mg/L P.g-LPS进行刺激, 处理指定时间后收集细胞, 做real-time PCR检测。
1.2.4 real-time PCR检测细胞黏附分子ICAM-1、E-selectin, 以及趋化因子IL-8和MCP-1的表达 在转染及P.g-LPS刺激的3 h和24 h后, 分别用Trizol试剂提取总RNA, 按照Takara逆转录试剂盒说明书将其反转录为cDNA, 按照Universal SYBR Green master mix说明书配置real-time PCR反应体系, 采用20 μ L real-time PCR反应体系, 50 ng cDNA模板。循环条件为:95 ℃ 15 min; 95 ℃ 10 s, 58 ℃ 20 s, 72 ℃ 30 s, 共40个循环。每个样本设置3个副孔, 实验重复3次, 应用2-Δ Δ Ct法检测ICAM-1、E-selectin、IL-8和 MCP-1的表达。引物序列见表1。
| 表1 real-time PCR 引物序列 Table 1 Real-time PCR primer sequence |
1.2.5 细胞划痕实验 实验开始前将12孔板倒置, 马克笔于培养板背面划线作为底面标记, 用于后续实验确定拍照位置。将HUVECs接种于该12孔板内培养, 如前所述转染siRNA或质粒后12 h, 10 μ L垂直于底面标记于细胞层中纵向划痕, 造成培养细胞缺损区域带, 用PBS冲洗3次后, 倒置显微镜下观察, 以1 mg/L P.g-LPS刺激及12 h后于同样位置观察, 比较组间细胞迁移情况。
记录每个样品3个副孔的2-Δ Δ Ct值, 计算均值及标准差, 采用SPSS 20.0软件, 多组间比较采用单因素方差分析, 各组和对照组比较采用t检验分析, P< 0.05表示差异有统计学意义。
3~6代HUVECs状态良好, 细胞形态均一, 呈菱形或多角形, 呈铺路石样镶嵌排列。细胞核呈圆形或卵圆形, 核内染色质稀疏空亮, 可见1~2个核仁。传代细胞生长旺盛。
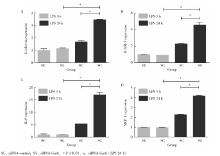
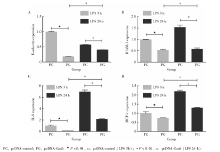
将下调Gas6基因的细胞作为敲低组, 以转染对照质粒的细胞作为对照组。以1 mg/L P.g-LPS刺激3 h及24 h后提取总RNA, 逆转录后利用real-time PCR检测细胞黏附分子及趋化因子达情况(图1)。刺激24 h后, 两组E-selectin、ICAM-1、IL-8、MCP-1的表达较3 h均有升高(P< 0.01)。P.g-LPS刺激3 h后, 对照组与敲低组4种目的基因表达情况差异均无统计学意义(P> 0.05)。刺激24 h后, 敲低组与对照组相比, E-selectin、ICAM-1、IL-8和MCP-1上调的倍数分别是2.06± 0.07、1.99± 0.11、3.14± 0.15和1.84± 0.03, 差异具有统计学意义(P< 0.01)。
P.g-LPS刺激3 h及24 h后, 过表达Gas6基因的HUVECs黏附因子及趋化因子表达均较对照组低, 差异有统计学意义(P< 0.01)。刺激3 h, 与对照组相比, 过表达组E-selectin、ICAM-1、IL-8和MCP-1分别下降81 %± 0%、47%± 3%、76%± 3%和26%± 6%, 差异具有统计学意义(P< 0.01)。 刺激24 h, 与对照组相比, 过表达组E-selectin、ICAM-1、IL-8和MCP-1分别下降29 %± 1 %、62 %± 3 %、69 %± 1%和41 %± 2 %, 差异具有统计学意义(P< 0.01, 图2)。
即刻(0 h)观察可见, 对照组与实验组划痕宽度基本相同, 划痕两侧细胞密度基本一致, 12 h后, 敲低组划痕宽度明显较对照组窄(图3), 提示抑制Gas6表达后内皮细胞在1 mg/L LPS刺激下的迁移能力较对照组强, 过表达组12 h后划痕宽度较对照组窄(图4), 显示过表达Gas6后内皮细胞迁移能力减弱。细胞划痕实验结果与real-time PCR实验结果趋势相符合。
本研究静默或过表达HUVECs细胞中的Gas6基因后, 以1 mg/L P.g-LPS刺激细胞3 h或24 h, 发现在加入刺激后的24 h后, 静默组和过表达组黏附因子及趋化因子的表达较对照组出现了明显变化, 下调Gas6基因后, P.g-LPS促进ICAM-1、E-selectin、IL-8和MCP-1表达作用增强, 上调Gas6基因后, P.g-LPS促进ICAM-1、E-selectin、IL-8和MCP-1表达作用减弱。
1974年, Stenflo等[5]相继发现维生素K是一个翻译后修饰将谷氨酸残基羧化为γ 羧基-谷氨酸(γ -carboxyglutamic acid, Gla)的辅酶, 从而使其成为具有生物活性的蛋白质, 因此, 含Gla的蛋白作为羧化物的底物也叫做维生素K依赖蛋白。Gas6是维生素K依赖蛋白家族成员之一, 是一相对分子质量约为75 000的分泌型蛋白, 1993年, Manfioletti等[6]首先克隆并随后完成对其测序, 另有学者发现, Gas6结合并激活酪氨酸激酶家族TAM受体(TAM包括3个成员, Tyro3、Axl和Mer, 其中Axl与Gas6的亲和力最大)[7]。有报道[8], Gas6蛋白激活Axl受体后, Axl磷酸化部位与PI3K结合, 使下游Akt和NF-kappaB磷酸化并激活, Akt抑制促凋亡蛋白Bad的活性, NF-kappaB促进抗凋亡蛋白Bcl-2的表达, 最终抑制细胞的凋亡, 并提出炎症状态下内皮细胞表达Gas6参与了内皮细胞活化、凋亡及内皮受损等系列过程, Gas6可能在动脉粥样硬化中起到了一定作用, NF-kappaB位点可能与该作用相关。动脉粥样硬化损伤的初期有血管内皮受损及血栓形成, 而Gas6也参与了加强血小板聚集的过程[4; 7]。另外, 在人与小鼠动脉粥样硬化斑块阶段, Gas6蛋白在内皮细胞、平滑肌细胞、巨噬细胞均有表达, 且随动脉粥样硬化严重程度的增加, Gas6的表达增多[9, 10]。炎症因子参与了动脉粥样硬化发生、斑块形成和发展整个过程, 并起重要作用[11], 2015年, Ahmed等[12]对过去12年的文献进行了回顾及综述, 发现体外研究提示了口腔细菌与动脉粥样硬化之间的潜在联系, 一项多中心临床对照研究表明牙周治疗可以减少系统性炎症的标志物[13], 本课题组2014年的研究中, 以1 mg/L P.g-LPS刺激HUVECs, 检测细胞因子E-selectin、ICAM-1、IL-8和MCP-1的表达情况, 其mRNA均上升, 差异均有统计学意义[14]。VKDPs家族中的骨钙素(osteocalcin, OC)与Gas6同样在肝外组织依赖维生素K2进行转录后修饰[15], 近期研究发现骨钙素与牙周炎发生发展关系密切[16], 同为VKDPs家族的Gas6也可能是牙周炎致病菌与动脉粥样硬化之间关联的一个桥梁因子。
目前, VKDPs是心血管疾病研究的热点领域, 研究表明Gas6在血管壁中起着重要作用, Gas6在内皮细胞、血管平滑肌细胞等广泛表达, 血管内皮细胞分泌多种生物活性物质, 参动脉粥样硬化和血栓形成[17], Gas6通过内皮细胞影响炎症反应, 介导细胞凋亡及血管重塑[8- 9; 18]。
同为VKDPs家族含Gla残基的Gas6在内皮细胞的表达是否受P.g-LPS刺激调控目前尚未见相关报道, Gas6是否在P.g-LPS诱导内皮细胞表达黏附分子及趋化因子中发挥作用也仍有待探讨。Tjwa等[9]发现, 使用100 μ g/L的TNF-α 刺激Gas6基因缺陷小鼠来源内皮细胞后, 发现Gas6的静默导致内皮细胞活化因子(ICAM-1、VCAM-1)及IL-6、IL-1β 的表达下降, 其研究结论是Gas6通过上调细胞黏附因子表达水平来增强内皮活化, 认为Gas6可起到促进炎症的作用。Korshunov等[18]在Axl-/-小鼠研究中发现增加Gas6能抑制粒细胞对体外培养内皮细胞的黏附, 表明Gas6似乎可通过减少细胞的外渗而起到抗炎的作用, 认为Gas6可起到抗炎的作用。本研究发现静默Gas6后ICAM-1、E-selectin、IL-8和MCP-1表达上升, 过表达Gas6后ICAM-1、E-selectin、IL-8和MCP-1表达下降, 提示Gas6可能有抗炎作用, 与Korshunov等[18]的研究结论相符, Gas6在炎症过程中是否起到双向作用及相关作用机制尚待进一步研究。
综上所述, 本研究通过静默或过表达Gas6基因, 观察到在P.g-LPS刺激下内皮细胞黏附因子和趋化因子的表达有显著差异, 提示Gas6在内皮细胞炎症状态下的黏附过程中发挥作用, 各因子表达量与Gas6表达趋势相反, 推测Gas6在内皮细胞受到炎症刺激后的应答过程中可能起到了抗炎作用, 这可能是牙周炎致病菌与动脉粥样硬化之间关联的一个桥梁因子, 对于该蛋白的进一步研究有可能揭示牙周炎与动脉粥样硬化之间的相互影响关系。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|