目的 探讨乏氧诱导因子-1α(hypoxia-inducible factor 1α,HIF-1α)蛋白表达在口腔鳞状细胞癌颈淋巴转移中的作用及其在判断预后方面的意义。方法 1993年6月至2010年5月在北京大学口腔医院住院并接受手术治疗的原发口腔鳞状细胞癌患者125例纳入本次研究,收集所有患者的临床病理学资料,制作组织病理切片,应用免疫组织化学方法检测HIF-1α蛋白的表达情况,根据表达情况分为高表达组和低表达组,主要评估指标为颈淋巴转移率和癌相关生存率(disease-specific survival,DSS)。颈淋巴转移率与各项临床病理学参数的关系比较采用秩和检验,组间及组内癌相关生存率的差异性比较采用Kaplan-Meier分析,并应用COX多因素生存分析对DSS的独立预测因子进行统计分析。所有统计学分析均采用SPSS 17.0软件包完成。结果 随访截止日期为2013年6月1日,生存患者的中位随访时间为73个月,有75例HIF-1α高表达,48例HIF-1α低表达,2例无法评估。秩和检验分析发现,HIF-1α高表达组淋巴转移率显著高于HIF-1α低表达组(58.7% vs. 37.5%, P=0.027)。Kaplan-Meier生存分析发现,HIF-1α低表达组患者无病生存率显著高于高表达组(60.4% vs. 36.0%, P=0.009), 癌相关生存率显著高于高表达组(70.8% vs. 46.7%, P=0.005)。多因素生存分析表明,HIF-1α表达( HR=2.164,95% CI:1.150~4.074, P=0.017)和T分期( HR=1.387,95% CI:1.066~1.804, P=0.015)均是判断口腔鳞状细胞癌患者预后的独立预测因子。结论 HIF-1α蛋白表达是预测口腔鳞状细胞癌预后的独立因子,且与颈淋巴转移显著相关,能够作为口腔鳞状细胞癌潜在的分子诊断标志物和靶向治疗靶点。
Objective: To explore the association between hypoxia-inducible factor 1α (HIF-1α) expression and lymph node metastasis in oral squamous cell carcinoma (OSCC).Methods: Tumor specimens from 125 patients with histologically-proven, surgically-treated OSCC were examined by immunohistochemical staining for expression of HIF-1α. The patients were divided into two groups by the expression of HIF-1α, high expression of HIF-1α group (H-group) and low expression of HIF-1α group (L-group). The main assessment parameters were lymph node metastasis rate and disease-specific survival (DSS). The lymph node metastasis rate and clinicopathologic features were compared using Mann-Whitney test. The Kaplan-Meier curve was generated for each group and compared using the log-rank test. Cox proportional hazard models were utilized for multivariate analyses of HIF-1α expression and other baseline factors with DSS. All calculations and analyses were performed using the SPSS 17.0 software package.Results: The protein expression levels of HIF-1α were up-regulated in OSCC and two patients were unable to evaluate. There were 48 patients in L-group and 75 patients in H-group. Lymph node metastasis rate was 37.5% (18/48) for L-group and 58.7% (44/75) for H-group ( P=0.027). Expression of HIF-1α was significantly correlated with lymph node metastasis. The patients of L-group had a significantly better DSS than the patients of H-group (70.8% vs. 46.7%, P=0.005), while the patients of L-group had a significantly better disease-free survival (DFS ) than the patients of H-group (60.4% vs. 36.0%, P=0.009) by Kaplan-Meier method. A multivariate survival analysis also showed that HIF-1α expression ( HR=2.164, 95% CI: 1.150-4.074, P=0.017) and T-stage ( HR=1.387, 95% CI: 1.066-1.804, P=0.015) both were the independent factors associated with prognosis.Conclusion: HIF-1α expression is significantly correlated with lymph node metastasis in OSCC. HIF-1α expression is an independent predictive factor for prognosis of OSCC patients, and may serve as a potential biomarker for molecular diagnosis and targeted therapy in future.
头颈部鳞状细胞癌(鳞癌)已成为发病率位列第6位的恶性肿瘤[1], 全世界每年约有50万个新发病例, 占所有新发恶性肿瘤的5%, 其发病率在过去的30年中一直处于上升趋势[2]。口腔鳞癌作为口腔颌面外科常见的恶性肿瘤, 是头颈部鳞癌的重要组成部分, 且所占比例较高, 据统计, 在世界范围内, 每年约有27.5万个新发病例, 每年因口腔癌死亡的人数占所有癌相关死亡人数的1.7%[3]。在中国, 口腔鳞癌发病率占所有恶性肿瘤的1.5%~5.6%[4]。随着科学技术的不断进步, 肿瘤的诊断技术和综合治疗手段在不断丰富和改进, 但口腔鳞癌的总体生存率提高并不明显, 5年生存率仍徘徊在50%左右, 晚期患者的预后更差, 且需要辅助放化疗等治疗手段[5]。已有研究表明, 口腔鳞癌在组织学和生物学行为上具有明显的异质性[6]。针对每个患者的个性化诊断和治疗是目前诊治口腔鳞癌的发展趋势, 传统的TNM分期系统、病理分级、肿瘤体积等用以评估口腔鳞癌患者的预后已不够全面。近期的研究表明, 一些生物因子与肿瘤的进展及患者的预后具有明显的相关性, 如细胞周期蛋白D1(cyclin D1)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、环氧酶(cyclooxygenase-2, COX-2)等[7, 8]。所以, 开发高敏感性和特异性的生物学标志物来指导临床诊疗和判断预后, 具有广阔的应用前景。
乏氧是实体性肿瘤微环境的基本特征之一, 同时也是肿瘤发生恶性转化甚至转移的始动因素[9]。目前, 已有研究表明, 乏氧诱导因子-1(hypoxia inducible factor-1, HIF-1)是肿瘤乏氧环境的中心调节因子, 其功能亚基HIF-1α 在许多恶性实体肿瘤中表达异常, 可能与恶性肿瘤的增殖、侵袭、转移及预后等生物学特征相关[10, 11], 但其在口腔鳞癌方面的作用和临床应用价值仍然存在较多争议。本研究旨在应用免疫组织化学技术, 检测HIF-1α 在口腔鳞癌中的表达, 并进一步分析HIF-1α 的表达水平与口腔鳞癌颈淋巴转移情况及预后之间的关系。
选取北京大学口腔医院口腔颌面外科1993年6月至2010年5月住院治疗的原发口腔肿瘤患者125例。纳入标准:(1)病理确诊为鳞癌; (2)所有患者术前未经任何治疗, 且全身检查排除远处转移; (3)原发灶和颈淋巴均行手术治疗或包括手术在内的综合治疗; (4)所有患者的临床、病理及随访资料完整。
1.2.1 主要试剂 HIF-1α 蛋白免疫组织化学试剂为美国Novus Biologicals公司的鼠单克隆抗体(NB100-105, 1 ∶ 200稀释)。
1.2.2 操作步骤 (1)标本的固定:手术切除标本在2 h内取材固定, 避免组织自溶及抗原变性等影响免疫组织化学染色结果; 标本用10%(体积分数)中性缓冲甲醛固定液[10 mL甲醛+90 mL磷酸盐缓冲液(phosphate buffer saline, PBS, 0.01 mol/L, pH 7.4)]固定12~18 h; 脱水、透明、浸蜡、包埋。(2)切片与烤片:彻底清洗玻片, 烤干后1 ∶ 10多聚赖氨酸涂抹, 风干; 切片厚度4 μ m, 50~60 ℃烤片2~3 h 以上; 将石蜡切片4 μ m贴在涂有切片粘合剂的载玻片上, 58 ℃烤1 h, 常规脱蜡至水, 二甲苯Ⅰ 、Ⅱ 、Ⅲ 处理各10 min, 无水乙醇和95%、85%、75%(体积分数)乙醇处理各2 min, 水洗2 min, PBS洗3 min× 3次。(3)减少或消除非特异性染色:3%(体积分数)H2O2作用20 min以消除内源性过氧化物酶活性, PBS洗3 min× 3次。(4)抗原修复:将切片置于Tris-EDTA缓冲液(10 mmol/L Tris Base, 1 mmol/L EDTA溶液, 0.05% Tween 20, pH 9.0)中, 100 ℃水浴煮沸20 min, 自然冷却至室温, PBS洗 3 min× 3次。(5)血清封闭及一抗、二抗孵育处理:1%(体积分数)正常马血清封闭, 室温孵育1 h; 加适当一抗(anti-HIF-1α , 1 ∶ 200浓度稀释, Novus Biologicals公司, 美国), 4 ℃孵育过夜, PBS洗3 min× 3次; 加入EnVision(Dako Cytomation, Denmark)的二抗, 室温下孵育1 h, PBS洗3 min× 3次。(6)染色及封片:0.04%(体积分数)DAB(Dako Cytomation, Denmark)显色1~5 min, 镜下控制显色; 自来水洗, 复染(苏木素衬染2 min, 水洗, 盐酸酒精分化2 s, 水洗、分化30 min); 脱水, 常规树脂封片。
1.2.3 评分标准 HIF-1α 蛋白表达评分参照以往同类研究方法, 仅计算阳性细胞百分比, 所有切片的阳性细胞百分比采用Image-pro Plus 6.0(IPP 6.0)软件的手动计数方法评分。每张切片评分均采用10个随机高倍视野下至少1 000个细胞进行评分, 最终评分结果再由2名独立的病理学专家进行评估, 如对高低表达评判有争议, 要经过讨论得出最后结论。取10个视野的评分平均值作为最终结果。HIF-1α 蛋白表达评分以10%细胞核阳性为阈值分为高、低表达亚组。
所有统计分析均采用SPSS 17.0统计软件进行。将患者分为有颈淋巴转移组(pN+)和无颈淋巴转移组(pN0), 两组内各项临床病理学参数(除发病年龄外)转化为计数资料, 采用非参数检验; 两组发病年龄比较采用两独立样本t检验。HIF-1α 蛋白表达水平与颈淋巴是否转移的差异分析采用秩和检验。对于生存分析, 计算癌相关生存及无病生存, 组间及组内无病生存(disease-free survival, DFS)和癌相关生存(disease-specific survival, DSS)应用Kaplan-Meier检验进行分析, 并应用多因素生存分析对DSS的独立预测因子进行统计分析。P< 0.05被定义为差异有统计学意义。
125例口腔鳞癌患者中, 男77例、女48例, 平均年龄(57.4± 12.0)岁(24~80岁)。发病部位:舌51例、下牙龈20例、颊19例、口底16例、口咽7例、上牙龈9例、硬腭3例。临床T分期:T1, 24例; T2, 58例; T3, 12例; T4, 31例。病理分级:Ⅰ 级49例、Ⅱ 级63例、Ⅲ 级13例。生长方式:外生型34例、溃疡型39例、浸润型52例。125例临床患者的基本资料见表1。
| 表1 125例口腔鳞癌患者基本临床病理学资料 Table 1 Baseline demographics of the 125 patients who participated in the study |
手术方式:所有患者均行原发灶切除, 术中切缘阴性, 并同期行颈淋巴清扫术; 其中55例行单侧择区性颈淋巴清扫术(elective neck dissection, END), 46例行单侧传统/改良根治性颈淋巴清扫术(classical/modified radical neck dissection, C/MRND), 13例行双侧END, 9例行单侧C/MRND+对侧END, 2例行双侧C/MRND。术后病理报告淋巴结转移情况:62例(49.6%)无颈淋巴转移, 63例(50.4%)伴有颈淋巴转移, 其中33例pN1、25例pN2b、5例pN2c。术后病理提示有颈淋巴转移患者被建议行放射性治疗, 颈部复发患者行治疗性颈淋巴清扫术, 酌情建议术后放射性治疗。
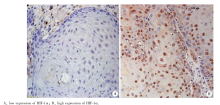
HIF-1α 蛋白阳性表达主要定位于肿瘤浸润边缘和肿瘤中央区(图1)。所有患者的组织切片均完成免疫组织化学染色, 结果显示, 125例患者中, HIF-1α 低表达48例(38.4%), 高表达75例(60%), 无法评估2例(1.6%)。
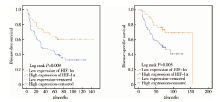
本研究随访的截至日期为2013年6月1日, 生存患者的中位随访时间为73个月(四分位数分别为68.3、103个月)。HIF-1α 低表达组和HIF-1α 高表达组的颈淋巴转移率分别为37.5%和58.7%, 两组比较差异有统计学意义(P=0.027); 不同T分期(T1~T4)的颈淋巴转移率分别为33.3%、44.8%、50%和74.2%, 四组比较差异有统计学意义(P=0.013, 表1), 表明不同T分期和HIF-1α 蛋白表达水平与患者的颈淋巴转移情况密切相关。Kaplan-Meier生存分析发现, HIF-1α 低表达组患者无病生存率显著高于高表达组(60.4% vs. 36%, P=0.009), 癌相关生存率也显著高于高表达组(70.8% vs. 46.7%, P=0.005, 图2), 表明HIF-1α 蛋白表达水平与患者预后显著相关。包括各临床病理学参数和HIF-1α 蛋白表达在内的Cox回归模型分析表明, T分期(HR=1.500, 95%CI:1.163~1.934, P=0.002)、N分期(HR=1.875, 95%CI:1.080~3.256, P=0.026)和HIF-1α 表达(HR=2.385, 95%CI:1.275~4.461, P=0.007)与患者DSS密切相关。进一步将上述3个DSS相关因子进行多因素生存分析(进入法), 结果表明, HIF-1α 表达(HR=2.164, 95%CI:1.150~4.074, P=0.017)和T分期(HR=1.387, 95%CI:1.066~1.804, P=0.015)均是判断口腔鳞癌患者预后的独立预测因子(表2)。
| 表2 125例口腔鳞癌患者预后单因素和多因素生存分析 Table 2 Univariate and multivariate survival analysis for the 125 patients |
目前, 口腔鳞癌的治疗方案主要依赖于肿瘤的发病部位、临床分期、影像学检查以及术后病理分期、病理分级等, 即所有临床病理学特征相似的患者接受同样的治疗, 称为均一治疗模式(one size fits all)[12]。然而临床上常常发现, 病理学特征相似的患者在接受同样治疗后, 疗效和预后差异很大, 直接导致一部分患者接受的治疗不足或治疗过度, 出现了局部复发、远处转移, 或者受累于手术、放疗或化疗的并发症, 既损害患者的健康又增加了经济负担[13]。近年来, 随着肿瘤分子机制研究的不断深入, 已公认肿瘤的发生和发展是多基因、多信号通路异常共同作用的结果, 传统的临床病理学参数已远远不能反映肿瘤内复杂的生物学性状[14]。为进一步提高口腔鳞癌患者的生存率和生存质量, 须将传统的均一治疗模式向个体化治疗模式(personalized treatment)转变, 开展以筛选和鉴定高效的生物标志物为基础的个体化治疗[12]。
乏氧是实质性肿瘤微环境的基本特征之一, 有研究表明, 乏氧状态是影响肿瘤增殖、侵袭、转移及放化疗抵抗的关键因素之一[15]。HIF-1作为肿瘤细胞在乏氧状态下的中心调节因子发挥着重要的作用, HIF-1由氧调节亚单位HIF-1α 和结构亚单位HIF-1β 组成, 而HIF-1α 是功能性亚基, 其蛋白表达和转录活性受细胞内氧浓度的精确调控。国内外学者都认为, 乏氧条件下HIF-1α 的上调主要发生在转录后水平[16, 17], 所以, 通过免疫组织化学方法对HIF-1α 蛋白进行染色标记, 已成为研究HIF-1的公认方法。目前, 已经在宫颈癌、肺癌、乳腺癌、甲状腺癌、胃癌等多种恶性肿瘤中检测到HIF-1α 蛋白的过表达[10, 11, 18]。在口腔癌中, Brennan等[19]通过免疫组织化学技术也检测到HIF-1α 蛋白的广泛表达, 并指出主要的表达区域集中在肿瘤的浸润边缘区和中央区。本研究也采用免疫组织化学技术对HIF-1α 蛋白进行染色标记, 得到了与Brennan等[19]一致的结果, 该方法可靠、廉价, 操作简便, 适合此类分子分类诊断研究, 易于在临床上推广应用。
鳞癌为口腔颌面外科最常见的恶性肿瘤, 5年生存率一直徘徊在50%左右。颈淋巴转移与否是口腔鳞癌的最强预后影响因子, 这一点已得到公认。近年来, 随着HIF-1的发现及HIF-1α 调节机制研究的不断深入, HIF-1α 与口腔鳞癌预后的相关性成为了口腔颌面外科的研究热点。Gong等[20]对28篇相关文献进行meta分析, 得出结论:(1)HIFs的过表达可增加癌相关死亡风险; (2)亚组分析得出HIF-1α 的过表达与不良预后具有显著的相关性, 且这种相关性在亚洲人群中更明确, 提示HIF-1α 可能是一种具有种族相关性的预后影响因子; (3)HIF-1α 的预测价值与头颈癌种类有关, 对于口腔癌、鼻咽癌、口咽癌的预测价值明确, 对于喉癌的预测价值不明确。Zhou等[21]对18篇相关文献进行meta分析, 纳入1 474例病例, 总结分析HIF-1α 在口腔鳞癌中过表达对于临床和预后的意义, 研究表明, HIF-1α 的高表达与肿瘤体积、肿瘤分期、淋巴结转移、总生存率具有显著相关性。Dunkel等[22]以Ⅰ 期口腔鳞癌患者为研究对象, 得出HIF-1α 和CD44与Ⅰ 期口腔鳞癌患者预后显著相关的结论, 可以指导治疗方案的选择。总之, 国内外的相关报道中, 越来越多证据表明HIF-1α 在口腔鳞癌进展中具有关键作用, 对于预后具有一定的预测价值[23, 24]。本研究中HIF-1α 低表达组患者无病生存率显著高于高表达组(60.4% vs. 36%, P=0.009), 癌相关生存率显著高于高表达组(70.8% vs. 46.7%, P=0.005), 提示HIF-1α 的表达对口腔鳞癌患者的预后具有一定的预测价值, 与国内外文献报道结论一致。
对于HIF-1α 与口腔鳞癌颈淋巴转移的关系, 研究报道相对较少。部分基础研究及体外试验提示, HIF-1α 参与的一些信号通路可以促进肿瘤的转移[25, 26, 27]。杨大江等[28]和Liang等[29]研究表明, 口腔鳞癌中HIF-1α 可能通过上调血管内皮生长因子的表达来诱导淋巴管生成并最终导致肿瘤细胞发生区域淋巴结转移。van den Broek等[7]研究指出, HIF-1α 表达与总生存时间(over-all survival, OS)具有显著相关性, 但与头颈部鳞癌的局部控制(local control, LC)无明显相关性, 从另一个侧面提示HIF-1α 可能与头颈部鳞癌的转移有一定联系。本研究中HIF-1α 蛋白表达高、低亚组中, 颈淋巴转移情况差异具有统计学意义(P=0.027), 提示HIF-1α 的表达与口腔鳞癌的颈淋巴转移关系密切。基于以上研究可以推测, HIF-1α 促进颈淋巴转移可能是其影响头颈部鳞癌预后的一条途径。
HIF-1α 具有潜在的临床应用价值。早期口腔鳞癌(临床分期:T1-2N0M0)的手术治疗方案(是否同期行颈淋巴清扫术)一直存在争议[30], 虽然已有多种辅助检查手段, 但在目前的临床工作中主要还是依赖于术者主观上的临床经验判断。本研究提示, HIF-1α 可作为诊断早期口腔鳞癌隐匿性转移的分子标志物, 评估颈淋巴转移的风险, 为手术方案的制定提供客观依据。此外, 已有研究表明, 乏氧状态是放化疗抵抗的重要原因之一[31, 32], 相信随着抵抗机制的进一步研究, HIF-1α 潜在的筛选、增敏作用可以更好地应用于临床, 使相关治疗更具有针对性。HIF-1在肿瘤进展中的重要作用决定了以HIF-1为靶点的化学、基因治疗策略具有可行性, 有广阔的发展前景。
总之, HIF-1α 蛋白表达与口腔鳞癌颈淋巴转移及预后显著相关, 多因素分析也证实, HIF-1α 表达是判断口腔鳞癌患者预后的独立预测因子。由此可见, HIF-1在口腔鳞癌的诊断、治疗方面具有诸多潜在的临床应用价值, 发展前景广阔, 但仍需要相关的基础研究和更大样本的前瞻性临床研究来证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|