目的 观察并比较58S纳米生物活性玻璃(nano-sized 58S bioactive glass,nano-58S BG)和传统45S5生物活性玻璃(45S5 BG)促进兔顶骨临界骨缺损修复的效果。方法 在新西兰兔顶骨直径9 mm的贯通临界骨缺损中随机填入nano-58S BG或45S5 BG,空白对照组仅以血凝块充盈骨缺损。组织学切片组于术后4周和8周取材制作切片,HE染色和天狼星红苦味酸染色后观察;骨荧光磨片组分别于术后第14、28、42天皮下注射盐酸四环素、茜素红、钙黄绿素标记新生骨,8周取材制成硬组织磨片, 激光共聚焦显微镜下观察新骨形成范围,Image J软件定量分析。结果 4周时HE染色可见生物活性玻璃与周围组织紧密结合,未见急慢性炎症细胞浸润,nano-58S组和45S5组可见骨缺损边缘和中央均出现新骨,对照组中央未见新生骨;8周时nano-58S组新生骨多于45S5组和对照组,两个BG组新生骨可见与正常颅骨相同的中空结构,对照组新骨未见中空结构。天狼星红苦味酸染色可见nano-58S组Ⅰ型胶原分泌量大于45S5组和对照组。骨荧光磨片观察显示术后4~6周和6~8周nano-58S组新骨形成范围分别为(29.4±4.48)μm和(35.3±3.74)μm,高于45S5组[(13.43±3.44) μm和(17.64±4.13) μm]和对照组[(5.88±2.92) μm和(6.07±3.02) μm, P<0.01]。结论 58S纳米生物活性玻璃促进兔顶骨临界骨缺损修复的效果优于传统的45S5生物活性玻璃。
Objective: To compare the osteogenic effects of a nano-sized 58S bioactive glass (nano-58S BG) and a traditional 45S5 bioactive glass(45S5 BG) in penetrating parietal critical bone defects.Methods: Critical bone defect with 9 mm diameter was created in the parietal bone of New Zealand rabbits. The bone defects were then filled with either nano-58S BG, or 45S5 BG, or nothing but the newly-formed blood clot as the blank control at random. For histological observation, specimens were gained 4 and 8 weeks after the surgery, sectioned and stained by HE. The amount of collagen type Ⅰ was observed with Picric-Sirius Red staining through polarimetry. To observe the new bone formation with fluorescence under the laser confocal microscope, we injected fluorescent markers 14, 28, and 42 days after the surgery. The markers were tetracycline hydrochloride, alizarin red and calcin individually in chronological order. Image J software was used to quantify the bone regeneration.Results: HE staining showed that BG particulates were integrated with the surrounding tissue without any inflammatory cells infiltration 4 weeks after surgery. New bone regeneration was observed both from the border and in the center of the defects in both BG groups. No bone regeneration in defect center was observed in control group. At the end of 8 weeks, there was more bone regeneration in nano-58S group compared with 45S5 group and control group. The structure of the new bone in BG groups was hollow, which was similar to the natural normal parietal bone. No hollow structure was observed in the new bone of control group. Picric-sirius Red polarimetry showed that more amount of collagen type Ⅰ was found in nano-58S group than in either 45S5 or control group. The fluorescent observation of the hard tissue slices at the end of 8 weeks showed statistically larger scope and faster new bone formation in nano-58S group with (29.4±4.48) μm thickness from 4-6 weeks and (35.3±3.74) μm from 6-8 weeks compared with 45S5 group [(13.43±3.44) μm and (17.64±4.13) μm] and control group [(5.88±2.92) μm and (6.07±3.02) μm, P<0.01].Conclusion: Compared with the traditional 45S5 bioactive glass, 58S nano-sized bioactive glass showed better osteogenic effect in bone regeneration in parietal bones of rabbits.
虽然骨新生和重建在人体中持续存在, 但当骨缺损较大时, 机体难以自行修复[1]。生物活性材料因其来源广泛, 并且避免了自体骨移植的损伤和异体骨移植的免疫风险, 有利于骨的再生与重建, 作为植骨材料而被广泛的应用和研究[2, 3, 4, 5, 6]。1969年, Hench等[7]通过制备玻璃的熔融法发明了生物活性玻璃(bioactive glass, BG)45S5, 并发现其具有骨诱导性。随后, 该生物活性玻璃被商品化(Bioglass®> 等), 在临床上被应用于人工中耳的替代和牙槽嵴高度的维持, 以及牙周病造成骨缺损的植骨[8], 取得了一定的治疗效果, 证实了其良好的生物相容性、骨引导性和骨诱导性[9, 10, 11]。随着制备技术的进步, 1991年出现了溶胶-凝胶法制备的生物活性玻璃, 成分均匀, 颗粒形态和大小可控, 孔隙率增大并实现多级孔径分布, 比表面积增大, 使其生物活性得以提高[12, 13, 14]。生物活性玻璃与体液接触时, 能够在其表面产生一系列化学反应, 生成与骨基质无机成分类似的碳羟基磷灰石[15], 与骨组织直接牢固结合, 同时, BG释放出的离子产物, 可以激活成骨细胞的细胞周期[11]和相关细胞信号通路[16, 17, 18], 促进成骨相关基因和蛋白的表达[9, 10, 19, 20, 21], 从而诱导骨再生。
近年来, 利用有机模板溶胶-凝胶法, 可以将生物活性玻璃颗粒的粒径调控至20~100 nm, 一般来讲, 纳米材料由于其晶体内在缺陷少, 独特的表面效应使其比表面积和化学活性更高, 微拓扑结构可以在更大程度上介导细胞的行为, 具备更高的生物活性和骨组织整合特性[22]。本课题组前期的体外研究发现, 58S纳米生物活性玻璃的离子浸提液, 可以通过激活丝裂原激活蛋白酶通路中的ERK1/2和p38通路, 上调Runt相关转录因子2 (Runt-related transcription factor 2, Runx2)、碱性磷酸酶、骨钙素、Ⅰ 型胶原等成骨相关基因和蛋白的表达, 表现出比传统45S5生物活性玻璃更好的成骨诱导性[18], 但材料的生物学特性受制备工艺、表面形貌等多重因素影响[23], 58S纳米生物活性玻璃是否在体内具备较传统45S5生物活性玻璃更强的成骨促进作用还需要研究证实。本研究旨在通过将58S纳米生物活性玻璃植入兔颅骨临界骨缺损, 观察并比较58S纳米生物活性玻璃和传统45S5生物活性玻璃(45S5 BG)促进兔顶骨骨缺损修复的效果。
实验中所采用的溶胶-凝胶法制备的58S纳米生物活性玻璃(nano-sized 58S bioactive glass, nano-58S BG, 化学组分摩尔百分比为58% SiO2, 33% CaO, 9% P2O5)和传统的熔融法制备的45S5生物活性玻璃(45S5 BG, 化学组成摩尔百分比为45%SiO2, 24.5%CaO, 6%P2O5和24.5%Na2O)由华南理工大学生物医学工程中心制备, nano-58S的制备是将一定量的前驱体正硅酸乙酯(tetraethyl orthosilicate, TEOS)、四水硝酸钙(calcium nitrate tetrahydrate, CN)、磷酸氢二氨[(NH4)2HPO4]、磷酸三乙酯(triethylphosphate, TEP)等, 加入无水乙醇的乳酸溶液中形成均匀透明的溶胶, 并将氨水溶液加入上述溶胶, 同时剧烈搅拌, 促使溶胶凝胶共沉淀, 然后将沉淀进行漂洗和干燥, 再经600 ° C热处理2 h得到生物活性玻璃纳米颗粒[24]。用场发射扫描电子显微镜观察两种生物活性玻璃颗粒的表面形貌。
实验动物为6~8周龄雄性普通级新西兰白兔, 体重 2.5~3.5 kg。实验动物的使用已通过北京大学生物医学伦理委员会实验动物福利伦理分会审查批准(伦理批准号:LA2011-057)。将20只新西兰大白兔的左右两侧顶骨编号1~40号, 使用随机表随机分为空白对照组、45S5组和nano-58S组。动物检疫合格, 适应环境1周后, 耳缘静脉注射2%(质量分数)戊巴比妥钠至全身麻醉, 无角膜反射, 呼吸平稳, 备皮后沿颅中缝做4 cm矢状方向切口, 分层剥离皮下组织暴露两侧平坦的顶骨骨面, 用取骨环钻在两侧顶骨制备直径9 mm双层皮质骨贯通骨缺损, 保留下方完整硬脑膜。沿骨缺损直径, 在缺损边缘2 mm外球钻制备凹坑至松质骨层, 填入银汞合金作为缺损边缘的参考标记点。根据随机分组, 伴随骨缺损内新鲜出血分别填入nano-58S生物活性玻璃粉末或45S5生物活性玻璃粉末, 与出血混合形成血凝块充盈骨缺损, 空白组不填入任何材料, 仅以新鲜出血形成的血凝块充盈骨缺损。皮下组织、皮肤分层缝合, 术后肌肉注射青霉素(10万U/kg)3 d, 并定期观察手术区域愈合情况。
1.2.1 骨荧光标记 对进行成骨速度观察的动物进行骨荧光标记, 利用药物在成骨过程中与矿化组织结合沉积并且能够自发荧光的特性, 在术后第14、28和42天依次在术区附近皮下注射不同的骨荧光标记药物, 随矿化沉积于新生骨, 以标记观察各组实验动物手术部位新生骨的成骨方向和速度, 注射顺序及注射剂量如表1所示, 术后8周进行标本取材。
| 表1 骨荧光药物注射表 Table 1 Injection of the fluorescent markers |
1.2.2 脱钙标本的制取及组织学切片 术后4周和8周取得顶骨标本, 常规固定, 脱钙, 从标本中央过银汞标记点分切标本, 修整边缘。每个样本包括半径4.5 mm的半圆形骨缺损区域和周围3 mm正常骨组织区域, 石蜡包埋, 制成组织学切片, 进行HE染色及天狼星红苦味酸染色, 天狼星红苦味酸染色封片后, 在偏振光显微镜下观察Ⅰ 型胶原纤维在骨缺损中的沉积和表达。
1.2.3 骨荧光标记的硬组织磨片制作与观察 将标本取材后, 固定、脱水、Technovit 7200 VLC树脂包埋, 光照24 h固化后用Exakt 300CL过标本两端银汞标志点沿矢状方向切取经过骨缺损中心的100 μ m 宽的组织, 打磨至30 μ m厚度, 进行激光共聚焦显微镜照相。采用盐酸四环素、茜素红、钙黄绿素相应的激发光激发硬组织磨片标本, 在共聚焦显微镜下可以分别观察到黄色、红色和绿色的自发荧光。在德国Zeiss, LSM 5 EXCITER共聚焦显微镜下ZenLightEdition软件设置光路(表2), 可在3种药物对应的自发荧光波段检测到荧光, 收集荧光, 在10倍物镜下进行观察和拍照。自由选择颜色进行赋色后导出图片, 药物对应的图片荧光颜色如表3所示。
| 表2 骨荧光药物自发荧光观察条件 Table 2 Observing wavelength of fluorescent markers /nm |
| 表3 骨荧光标记物赋色 Table 3 Coloring of fluorescent markers in figures |
1.2.4 骨组织形态定量分析 应用Image J(1.50i)对骨荧光磨片的荧光图像定量分析, 光学显微镜在100倍放大下, 每组5个标本, 选择每个标本骨缺损边缘和中央5个不同视野, 应用Image J测量每个标本4~6周及6~8周的新生骨形成宽度。
采用SPSS 22.0统计软件进行分析, 计量资料以均数± 标准差表示, 采用单因素方差分析比较各组间及组内差异, P< 0.05认为差异有统计学意义。
扫描电子显微镜观察可见, nano-58S BG颗粒为规则的球形颗粒, 粒径在20 nm左右(图1A), 45S5 BG颗粒形态不规则, 粒径在2~15 μ m之间(图1B)。与45S5 BG相比, nano-58S BG具备更大的比表面积和孔隙率[24]。
手术过程中未出现实验动物死亡, 术后30 min内动物苏醒, 进食、饮水和活动正常, 术后每周称重, 所有实验动物体重均正常上升。
手术后1~2 d术区无明显肿胀, 皮温略升高, 缝合伤口无开裂、流血、流脓现象。术后3 d术区皮温恢复正常, 术后5 d术区缝合伤口基本愈合, 术后14 d手术伤口完全愈合, 术区毛发生长明显。术后30 d顶骨区域毛发恢复正常, 手术区域情况稳定, 无异物排斥现象。
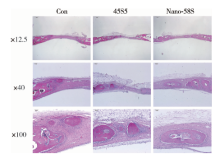
HE染色可以看到4周时45S5组和nano-58S组内可见生物活性玻璃颗粒周围有纤维组织或骨组织紧密包绕, 未见到急慢性炎性细胞浸润。缺损内有较多新骨形成, 并且缺损中央也可见到团块状新生骨的形成。对照组内可见少量新骨形成, 均是由缺损边缘开始向内形成, 骨缺损中央未见新骨形成(图2)。
8周时, nano-58S组和45S5组内可见更多新骨在缺损边缘和缺损中央形成, 骨缺损边缘和中央新生的团块骨为中间有空腔的结构, 与正常顶骨形态结构相似。对照组仍仅观察到自缺损边缘向中央爬行的新生骨, 多为实心团块状, 与正常顶骨的结构仍有较大差异(图3)。
术后8周的天狼星红苦味酸染色观察发现, 各组间Ⅰ 型胶原均充盈骨缺损区域, 随新骨的不断形成, 新生骨内部可见层状排列编织的Ⅰ 型胶原, 周围骨基质内也可见Ⅰ 型胶原的广泛表达。在相同曝光时间和感光强度下, nano-58S组显色亮度高于45S5组和对照组, 提示Ⅰ 型胶原表达量较高, 并且nano-58S组在骨缺损中央胶原编织厚度高于45S5组, 高于对照组。与对照组相比, nano-58S组和45S5组骨缺损边缘新生骨内部Ⅰ 型胶原的排列和编织更接近于正常颅骨的形态结构(图4)。
 | 图4 天狼星红苦味酸染色及偏振光观察(8周)Figure 4 Picric-sirius red staining and observation under polarimetry (8-week) |
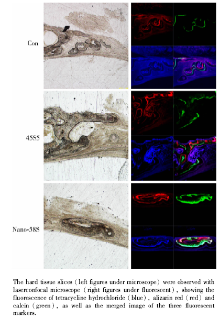
激光共聚焦显微镜下观察骨硬组织磨片可见, 各组硬组织磨片内3种颜色荧光染色带均可见, 说明新骨的形成和矿化过程贯穿了8周的观察期。3种荧光带分布位置和范围不同, 其中蓝色荧光带标记2~4周的新骨形成区域在生物活性玻璃组和对照组中均最为广泛, 各组中4~6周新骨形成的红色荧光带和6~8周新骨形成的绿色荧光带呈带状分布, 依次沉积在成骨前沿的外侧。45S5组和nano-58S组在荧光带的融合图像中可以看到3种荧光带之间有一定范围的重叠, 并且绿色荧光带有部分沉积在红色荧光新生骨团块的中央, 显示出6~8周生物活性玻璃组在新生骨前沿的外侧成骨的同时, 新生骨团块的内部也有骨组织的改建和成熟。在对照组中未观察到明显的骨团块内部改建成熟的荧光带沉积。在相同激发光强度和曝光强度下观察可见, nano-58S组4~6周红色荧光带和6~8周绿色荧光带荧光强度均高于45S5组, 且高于空白对照组(图5)。
在100倍放大下分别拍摄3种荧光条带并获得条带融合照片, 用Image J图像软件测量新生骨条带的宽度并与对照组比较, 可见nano-58S组术后4~6周新骨形成宽度为(29.4± 4.48)μ m, 6~8周为(35.3± 3.74)μ m, 45S5组术后4~6周新骨形成宽度为(13.43± 3.44)μ m, 6~8周为(17.64± 4.13)μ m, 对照组术后4~6周新骨形成宽度为(5.88± 2.92)μ m, 6~8周为(6.07± 3.02)μ m, 数据经单因素方差分析, 组间差异有统计学意义(P< 0.01), 在4~6周和6~8周, nano-58S组新生骨宽度均显著高于45S5组, 并显著高于对照组。对同一组内不同时间段荧光带宽度进行比较分析可见, nano-58S组6~8周新骨形成宽度显著高于4~6周(P< 0.05), 45S5组6~8周新骨形成宽度高于4~6周, 但差异无统计学意义(P> 0.05)。
研究颅颌面部骨缺损再生的骨缺损类型中, 颅骨圆形贯通骨缺损可重复性好, 解剖位置为手术入路和术中操作提供了充足的空间, 硬脑膜和皮肤为植入材料提供了充足的支撑, 不需要额外固定, 已经被广泛应用[25]。在骨缺损的大小方面, 临界骨缺损的定义为在某种特定部位, 动物不能自发愈合的最小骨内缺损[26], 因此临界骨缺损通常用于检测生物材料促进骨缺损愈合的作用。有研究表明[27], 兔颅骨直径大于等于8 mm的缺损为临界骨缺损, 因此, 本研究选择了兔颅骨直径9 mm贯通骨缺损作为实验动物模型, 研究纳米生物活性玻璃体内促进骨缺损愈合的作用。
以往的体内研究发现, 45S5生物活性玻璃能够促进骨质疏松小鼠的新骨生成[28], 维持牙槽嵴的高度[29]。与羟基磷灰石相比, 45S5生物活性玻璃颗粒表现出更好的骨诱导性[30], 能够显著促进骨缺损的修复。纳米溶胶-凝胶生物活性玻璃的颗粒直径可控制在20~100 nm, 比表面积明显提高, 其独特的表面效应和微拓扑结构可以在更大程度上介导细胞的行为。以往研究表明, 生物活性玻璃的比表面积, 孔隙率、孔隙大小和多孔结构等特性能够决定其体外生物活性。实验中的nano-58S BG具有更大的比表面积和孔隙率, 在体外能够加速羟基磷灰石的形成。
本研究将nano-58S和45S5生物活性玻璃植入兔顶骨贯通骨缺损观察8周, 通过多种组织学观察方法, 对nano-58S在骨缺损修复的过程中的作用进行了连续观察并与45S5比较后发现, nano-58S和45S5在体内对周围细胞和组织的作用与体外研究结果相似, 能够促进Ⅰ 型胶原的分泌, 促进骨缺损修复的快速启动, 并促进新生骨的矿化成熟。
HE染色显示, 材料植入后, 生物活性玻璃颗粒与周围组织紧密接触, 未见急慢性炎症细胞浸润, 提示nano-58S颗粒的纳米形貌未引起炎症坏死反应, 生物相容性良好, 此外, 在骨缺损区域内, nano-58S组和45S5组4周时可观察到大量新生骨组织团块出现在骨缺损中央, 而空白对照组可以观察到从骨缺损边缘向中央方向开始形成新生骨, 缺损中央未见新生骨, 提示了nano-58S和45S5良好的骨诱导性和骨引导性。8周时nano-58S组和45S5组内的新生骨组织团块呈现中空结构, 与缺损区域以外正常的颅骨组织形态相似, 空白对照组新生骨组织团块无中空结构, 与正常颅骨结构差异明显, 说明nano-58S组和45S5组新骨的形成和改建更为活跃, 新生骨形态结构更为成熟。
天狼星红苦味酸染色后偏振光观察Ⅰ 型胶原发现, nano-58S组Ⅰ 型胶原表达量高于45S5组和空白对照组, 且生物活性玻璃颗粒对Ⅰ 型胶原纤维束的分布和编织起到一定的引导和支撑作用, 纤维束排列分层更为有序, 排列方式与缺损边缘正常骨一致, 说明nano-58S和45S5能够在体内上调Ⅰ 型胶原的分泌和沉积, 从而促进新生骨胶原框架的搭建和矿化沉积, 本研究观察结果与体外研究结果相一致。
骨荧光标记法利用药物在成骨过程中与矿化组织结合沉积于新生骨, 并且能够在特定激发波长下自发荧光的特性, 动态和定量地观察骨缺损愈合过程中新生骨沉积的的范围和速度。本实验骨荧光磨片发现, 代表术后2~4周新骨沉积范围的蓝色荧光带在对照组、45S5组、nano-58S组中均范围最广, 以较弱的荧光带分布于大部分缺损内新生组织的范围, 术后2~4周, 组织生长充盈了骨缺损区域, 随着血凝块的机化和骨修复的启动, 盐酸四环素伴随着组织矿化在骨内广泛沉积。骨缺损的修复过程中包括新骨在缺损前沿的带状沉积, 同时也包括新生骨内部的成熟和改建。45S5组和nano-58S组4~6周和6~8周的荧光带沉积范围包括在骨缺损边缘向中央逐层分布的条带状荧光带, 骨缺损中央的新生骨团块外缘向外逐层沉积的条带状荧光带, 以及新生骨内部红色荧光和绿色荧光重叠的区域, 分别提示了生物活性玻璃组内的新生骨组织在骨缺损边缘向中央区域逐层推进, 骨缺损中央的新生骨外缘不断向外扩展生长, 并且新生骨组织的内部也同时在进行活跃的矿化成熟和改建。在对照组中, 仅观察到自缺损边缘向中央方向逐层沉积的荧光带, 未见明显的新生骨团块内部荧光重叠区域, 提示对照组中新生骨的成熟和改建不活跃。以上荧光带沉积特点与HE染色的观察结果相一致, 提示HE染色中nano-58S组和45S5组内的新生骨组织团块呈现中空结构, 与生物活性玻璃组新生骨团块活跃的成熟和改建有关。在对照组荧光磨片中未见新生骨团块内部的荧光带重叠, 能够解释空白对照组新生骨组织团块无中空结构, 与正常颅骨结构差异明显的特点, 说明nano-58S组和45S5组新骨的形成和改建更为活跃, 新生骨形态结构更为成熟。
对骨荧光磨片的定量分析可见nano-58S组术后4~6周和6~8周新生骨的形成速度均显著大于45S5组和空白对照组。对组内不同时间段新骨形成速度的比较发现, 对照组在4~6周和6~8周的新骨沉积速度差异无统计学意义, nano-58S组6~8周的新骨形成范围大于4~6周, 表明nano-58S组的新骨形成和改建在6~8周加快, 提示广泛并且活跃的骨组织新生和改建。骨荧光磨片观察结果提示, 与对照组相比, 45S5和nano-58S生物活性玻璃能够加快骨缺损内新生骨的沉积和成熟改建, 且nano-58S组新骨形成速度显著高于45S5组。
由于体内研究观察时间较短, 生物活性玻璃作用下骨缺损的最终修复效果仍有待于更长观察时间的评价, 此外nano-58S因其纳米级颗粒形貌易被吞噬和降解, 如何控制nano-58S的降解速度, 使其与新骨形成的速度更加匹配, 也是该材料值得进一步研究和改进的方向。
综上所述, 58S纳米生物活性玻璃促进兔顶骨临界骨缺损修复的效果优于传统的45S5生物活性玻璃。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|