阿尔兹海默病( Alzheimer’ s disease, AD)是一种严重的中枢神经系统退行性疾病, 主要表现为认知和记忆能力降低, 在发达国家65岁以上的人群中, 约13%的老年人遭受着阿尔兹海默病带来的痛苦[1, 2], 但迄今为止AD的发病机制尚未完全阐明, AD的治疗也不理想。有毒蛋白聚体淀粉样蛋白-β (amyloid beta, Aβ )斑块和高度磷酸化Tau 蛋白缠结是AD的重要病理特征。由于Aβ 产生和清除之间的稳态被打破, 导致Aβ 累积, 继而Aβ 清除能力下降是导致AD的关键因素[3], 因此, 如何加速脑内组织间液(interstitial fluid, ISF)的流动, 以保证有效清除Aβ 蛋白是减缓或停止AD的有效策略。
水通道蛋白4(aquaporin-4, Aqp4)高度表达于星型胶质细胞足突上, 有报道称其能够促进ISF的流动, 有利于脑脊液(cerebrospinal fluid, CSF)中营养物质输送进入脑实质和将代谢废物清除出脑[4], Aqp4的缺失会使ISF引流减慢。最新的研究表明, 改善AD模型中的Aqp4的表达和极性分布, 会显著加快ISF中Aβ 的清除[5], 可见Aqp4对于Aβ 的清除具有重要的作用, 但动物活体状态下观察AD的ISF引流改变却从未有过报道。基于目前的研究现状, 我们认为AD后脑ISF引流减慢, Aqp4的缺失会使AD的脑ISF引流更加缓慢。
本研究拟通过磁共振成像(magnetic resonance imaging, MRI)观察示踪剂钆喷酸葡胺(gadolinium-diethylene triamine pentacetic acid, Gd-DTPA)在脑组织间隙(extracellular space, ECS)内扩散的特征, 间接反映AD模型大鼠脑ISF引流的改变, 并通过比较示踪剂在ECS中的扩散和清除速率, 探讨Aqp4在AD模型大鼠脑内ISF引流中的作用。
本研究获得北京大学医学部实验动物伦理审查委员会的批准, 所用SD大鼠和Aqp4基因敲除(Aqp4-/-)SD大鼠均来自北京大学医学部实验动物科学部。实验动物体重为300~350 g, 将野生型SD大鼠和Aqp4-/-大鼠随机分为4组:Sham组(10只)、AD组(10只)、Aqp4-/--Sham组(10只)、Aqp4-/--AD组(10只)。
参照文献[6, 7, 8, 9], 本研究中D-半乳糖粉末在无菌生理盐水中溶解配制成3%(质量分数)浓度的溶液, AD组和Aqp4-/--AD组每天腹腔注射D-半乳糖溶液(5 mL/kg), Sham组和Aqp4-/--Sham组每天注射无菌生理盐水(5 mL/kg), 均连续注射6周。
对大鼠进行编号, 经腹腔注射戊巴比妥钠(50 mg/kg)麻醉。采用 Siemens Magnetom Trio 3.0T 超导MRI扫描仪, 用腕线圈快速采集大鼠颅脑磁化准备梯度回波序列(three-dimensional magnetization prepared rapid acquisition gradient echo sequences, 3D-MP-RAGE)T1加权图像, 扫描参数:TR 1 500 ms, TE 3.7 ms, 翻转角9° , TI 900 ms, 视野267 mm, 矩阵512× 512, 分辨率 0.5 mm× 0.5 mm× 0.5 mm, 获取每只大鼠的T1WI 零时刻扫描图像[10]。然后将大鼠固定于鼠脑立体定位仪(美国Stoelting公司), 切开大鼠头皮, 分离骨膜, 暴露前囟, 依照《大鼠脑立体定位图谱》定位海马区, 颅骨钻孔, 缓慢进针, 用微量注射泵(瑞士Hamilton公司)在海马区域注射Gd-DTPA(10 mmol/L)2 μ L(0.2 μ L/min), 注射完毕后再次行MRI扫描, 于0.5 h、1 h、1.5 h、2 h、3 h 连续观察示踪剂的扩散特征。应用自主开发的软件测量扩散速率D* 、清除速率k'和清除半衰期(half life, t1/2)[11]。
采用 SPSS 18.0 软件, 实验数据采用均值± 标准差来表示, 组间数据比较采用单因素方差分析(One-Way analysis of variance, One-Way ANOVA)的方法, 两两组间比较采用Tukey’ s Multiple Comparison Test的方法, P< 0.05 表示差异有统计学意义。
AD组和Aqp4-/--AD组大鼠在连续6周注射D-半乳糖溶液后行动缓慢, 对声音和触碰反应迟钝, Sham组和Aqp4-/--Sham组大鼠未出现异常, 说明AD模型成功。
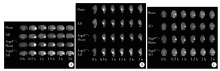
在Gd-DTPA注射进入海马区后0.5 h、1 h、1.5 h、2 h、3 h, 分别于冠状位(图1A)、矢状位(图1B)和水平位(图1C)连续观察示踪剂的扩散特征, 结果显示, Sham组、AD组、Aqp4-/--Sham组和Aqp4-/--AD组海马示踪剂的扩散速率D* 差异无统计学意义(F=1.351, P=0.286 3)。
示踪剂Gd-DTPA在AD组大鼠海马内的清除速率k'明显低于Sham组, Aqp4-/--Sham组清除速率也明显低于Sham组, Aqp4-/--AD组的示踪剂清除速率最慢, 4组之间差异具有统计学意义(F=277.2, P< 0.001)。
示踪剂Gd-DTPA在Sham组、AD组、Aqp4-/--Sham组和Aqp4-/--AD组的清除半衰期t1/2依次延长, 4组之间差异具有统计学意义(F=212.9, P< 0.001, 表1)。
| 表1 大鼠海马区示踪剂平均扩散速率D* 、清除速率k' 及t1/2的比较 Table 1 Comparisons of D* , k' and t1/2 of the tracer in the hippocampus |
本研究中, 我们将MRI示踪剂Gd-DTPA注射进入各组大鼠的海马, 通过MRI观察其流动和清除情况, 结果表明AD模型大鼠脑内ISF引流减慢, Aqp4的缺失使大鼠脑内ISF引流明显下降, 加重了AD大鼠脑内ISF引流损伤。
在ECS内流动的ISF含有细胞代谢及信号传递的各种物质, 是维持细胞内环境的重要组成部分, 能够将营养物质带入脑内并将代谢废物(包括Aβ 蛋白)引流出脑[12]。本研究中应用的示踪剂Gd-DTPA几乎不被细胞吸收, 并且能够缩短周围水分子的T1加权像弛豫时间, 可以间接反映其所在ISF的流动及代谢特征[13]。
本研究中应用的D-半乳糖致老化型大鼠AD模型是目前广泛接受的AD模型, 病变大鼠表现出接近自然老化的神经退行性变, 如Aβ 蛋白的产生、胆碱能退行性变、神经元凋亡和星形胶质细胞增生等[14]。本研究中发现, 示踪剂Gd-DTPA在AD模型大鼠海马内的流动和清除显著减慢, 我们推测其可能由于AD大鼠脑内ECS中有大量Aβ 蛋白沉积, 致使流动阻力增加; 同时, AD后神经元的凋亡和星形胶质细胞的增生等病变, 致使ESC空间构象严重变形, ECS内的迂曲度明显增加, 使得ISF的流动速度明显下降, 清除减慢且半衰期延长。
Aqp4是脑内表达量最多的水通道蛋白, 高度表达于星形胶质细胞足突, 能够促进ISF中水和部分离子的流动[15]。通常认为, 高度敏感和高代谢率的神经元和胶质细胞需要一个能将ISF中的代谢物质快速清除的细胞外环境[16], 但脑内并没有组织结构上的淋巴管, 也缺乏与外周系统类似的清除ISF溶质的独立路径。有研究表明, 主要由Aqp4组成的类淋巴系统(glymphytic system)是Aβ 蛋白清除的一个重要途径, 约40%~80%的大蛋白分子和溶质通过此途径清除[17]。类似于外周淋巴清除系统, 营养物质随着CSF沿软膜动脉和穿通动脉的血管周围间隙(virchow-robin space, VRS)进入, 再进入动脉管周间隙并通过Aqp4的作用进入ECS, 被神经细胞摄取, ECS中的废物随着ISF沿静脉管周间隙运输出脑实质, 因此, Aqp4的正常生理结构及功能对脑内ISF的流动和清除均有重要意义[18, 19]。另外, 有研究表明, Aqp4缺失后组织间隙变大、细胞水肿从而ECS迂曲度增加, 增加了ISF的流动阻力[20]。本研究的结果表明, 在Aqp4缺失后, 海马内的ISF流动和清除明显下降, 也进一步印证了这个观点。
综上所述, 本实验中我们发现, AD大鼠的脑内ISF引流系统明显受损, 而Aqp4对正常大鼠和AD大鼠脑内ISF引流均具有重要的意义, 在清除Aβ 蛋白层面来说, 对AD的产生、发展和转归均具有重要的意义。可以预见, 加强脑内Aqp4主导的类淋巴系统引流功能将有望成为未来治疗AD的新靶点。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|