由于龋、外伤等原因造成的牙髓感染常常导致牙髓的丧失, 进而使得年轻恒牙牙根发育停止。牙髓血运重建术是目前临床为使年轻恒牙牙根继续发育采取的一种牙髓再生的治疗方法。
感染控制是组织再生的先决条件, 在牙髓血运重建术中米诺环素与甲硝唑、环丙沙星一同被作为三联抗生素糊剂(triple antibiotic paste, TAP)用于根管封药来控制感染。米诺环素(minocycline)又名二甲胺四环素或美满霉素, 是一类广谱长效的四环素类抗生素。研究发现, 当TAP中米诺环素浓度达到25 mg/L时就有显著的抑菌作用[1], 此外, 米诺环素作为四环素一族, 也是一类强效的基质金属蛋白酶(matrix metalloproteinases, MMPs)抑制剂[2]。米诺环素通过下调MMP mRNA的表达[3], 干扰蛋白的活化过程, 使MMPs更容易水解[4], 降低了MMPs的活性, 可有效地避免牙本质中胶原纤维的降解, 具有维持牙本质胶原矿化, 促进矿物质形成的作用。有学者发现[5], 米诺环素在维护牙本质粘接界面稳定及促进骨组织再生中都有一定的作用。
在以往的应用中, 系统给药存在着局部组织液中药物浓度低, 抗感染效果不佳, 而局部给药又有药物代谢速率快, 药效维持时间短等问题。药物递送系统(drug delivery system)通过载体材料对药物的装载及在代谢降解的过程中缓释药物, 可维持有效的药物浓度, 是一种理想的递药策略。理想的载体材料应满足性质稳定、无生物毒性、对药物有一定的装载率和适宜的释放速率, 且不影响药物的药理作用等特点。
生物活性玻璃(bioactive glasse, BG)是一类具有良好生物活性的无机生物材料[6], BG植入体内后能迅速在界面形成羟基磷灰石, 释放硅钙磷等离子, 可激活细胞成骨、成血管等相关的多种基因, 目前已经作为植入材料成功地应用于骨缺损的治疗。本课题组的前期研究发现, BG能够促进牙髓细胞的增殖、成牙本质方向分化和矿化[7], 能够诱导大鼠牙髓组织形成牙髓牙本质复合体样结构[8], 具有诱导牙髓组织再生的潜能。在牙髓损伤的修复及再生策略中, 除干细胞和生长因子外, 适宜的生物材料可诱导干细胞的成牙本质向分化, 为干细胞的增殖提供适宜的微环境, 对牙髓损伤的修复再生具有重要的促进作用[9]。
介孔材料是指孔径在2~50 nm之间的一类多孔材料, 由于其具有规则的孔道结构、相对较窄的孔径分布以及较大的比表面积, 在药物控释、大分子分离及催化反应等方面都具有广泛的应用。介孔纳米生物活性玻璃(mesoporous nano-bioactive glass, MNBG)微球具有良好的抗菌性[10]、生物相容性[11, 12]和促进矿化的能力[13, 14, 15], 许多研究将介孔生物活性玻璃用于装载药物, 表现出较高的装载率, 介孔结构可与药物分子相互作用, 在一定程度上还能够减缓药物的释放速率, 使局部的药物浓度在相应的一段时间内维持在一定的水平而不快速衰减。
若能将介孔生物活性玻璃负载米诺环素, 则既可以诱导促进牙髓细胞成牙方向分化形成牙髓牙本质复合体, 又能在局部形成一个缓释药物分子的抗感染微环境, 将为牙髓损伤的修复再生提供有利条件。因此, 本研究旨在构建可缓释米诺环素的介孔纳米生物活性玻璃载药系统, 为牙髓再生治疗提供适宜的生物材料。
采用溶胶-凝胶法结合有机模板技术, 通过调节反应物中Ca的引入量制得以下4种MNBG颗粒, 分别为90S、80S、70S和60S, 其具体组分比例详见表1(由华南理工大学国家人体组织功能重建工程技术研究中心制备)。使用扫描电子显微镜(scanning electron microscope, SEM)观察材料的表面形貌及粒径, 氮气吸脱附实验测定材料的比表面积、孔径大小及分布。
| 表1 MNBG颗粒的组分与形貌参数 Table 1 The MNBG particles chemical composition and the parameters related to BET exams |
采用傅里叶(Fourier)红外光谱仪检测载药颗粒中米诺环素的特征性官能团, 将4组MNBG颗粒按1 g/L的浓度混悬于1 g/L米诺环素盐酸盐的水溶液中, 避光条件下于水平摇床上24 ℃振荡。24 h后离心(3 000 r/min, 5 min), 弃去上清液, 去离子水洗涤沉淀3次, 37 ℃烘干沉淀, 研磨混匀后得到4组载药颗粒备用, 分别为mino-60S、mino-70S、mino-80S和mino-90S。取1~2 mg样品于研钵中, 加入200 mg溴化钾充分研磨混匀后制成压片, 通过傅里叶红外光谱仪检测载药颗粒中米诺环素的特征性官能团。
采用热重分析法检测米诺环素的装载量, 取 3~5 mg样品置于热重分析仪坩埚内, 以10 ℃/min速率升温至700 ℃, 记录过程中样品质量的变化Δ m, 计算出米诺环素质量减少的百分比A(%)、MNBG质量减少百分比B(%)以及载药颗粒质量减少百分比C(%)。若假设载药系统中米诺环素的质量百分比x(%), MNBG的质量百分比为y(%), 依据反应前后载药系统的质量组成百分比得到方程组:① x+y=100%; ② Ax+By=C。通过计算可求得载药系统中米诺环素的组成百分比x, 即药物的装载效率。
采用紫外分光光度仪测定米诺环素-MNBG(mino-MNBG)载药系统的药物释放情况, 选用第1.2节中药物装载率最高的一组进行药物释放实验。称取50 mg的mino-MNBG载药颗粒, 置于截留相对分子质量为3 500的透析袋内, 加入5 mL的PBS溶液稀释, 透析袋夹扎紧, 置于45 mL的PBS体系内, 调整pH为7.4后, 密封37℃避光振荡。此后每24 h检测并调整溶液pH为7.4。分别于第3、6、12、24、72、168、336、504小时取样4 mL, 于紫外分光光度仪中检测其350 nm处的光密度, 根据标准曲线计算样品中米诺环素的含量, 每次取样后加入等量的PBS维持体系内溶液量为50 mL。
采用琼脂扩散实验检测米诺环素-MNBG载药系统的抑菌性, 分别配制浓度为1 g/L的mino-BG、MNBG和米诺环素的PBS浸提液及0.1 g/L的米诺环素PBS浸提液。37 ℃避光振荡24 h, 超净工作台内使用0.22 μ m的针式过滤器过滤后备用。将粪肠球菌(Enterococcus faecalis)菌液(108/mL)按照100 μ L/皿使用螺旋接种仪均匀接种于BHI琼脂培养基表面。将PBS、1 g/L mino-MNBG、MNBG和米诺环素的PBS浸提液, 以及0.1 g/L的米诺环素PBS浸提液各10 μ L滴加于无菌圆纸片(直径6 mm, 厚度0.7 mm)上, 随机分组放置于培养基表面(样本量n=5), 倒置培养24 h(37 ℃, 体积分数为5%的CO2), 测量抑菌环直径。
扫描电子显微镜结果显示MNBG颗粒为分散良好的微球(图1), 粒径约为350 nm, 表面粗糙, 提示其内含大量的介孔结构。氮气吸脱附等温曲线与孔径分布(图2)显示MNBG颗粒具有介孔材料典型的Ⅳ 型等温线, H2型迟滞环, 而迟滞环尾部又类似于H3型, 表明该材料颗粒中既有大量的介孔通道结构, 又在颗粒之间形成相互堆积的狭缝孔, 大幅提高了材料的比表面积。由孔径分布可知, 4种MNBG颗粒都具有相对较窄的孔径分布, 其孔径的峰值为3~5 nm。随着材料组分中Si含量的降低, 孔径分布宽度逐渐增宽, 60S可见较多的6~20 nm级介孔分布, 增大了其平均孔径, 而90S的平均孔径最小(表1)。4种MNBG颗粒都具有较大的比表面积, 其中60S比表面积最小, 为540.400 m2/g, 90S组最大, 为923.274 m2/g。
 | 图1 MNBG颗粒扫描电子显微镜图像Figure 1 The SEM image of MNBG A, 60S; B, 70S; C, 80S; D, 90S. The particle has a rough surface, and it’ s average size is about 350 nm. |
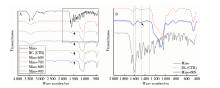
米诺环素的分子结构中含有4个苯环, 在傅里叶变换红外光谱上表现为400~1 750 /cm区间中多个复杂的吸收峰(图3A)。4种米诺环素-MNBG载药体系中, 在1 475 /cm处均出现了对照组(MNBG)没有的吸收峰, 峰位与米诺环素的吸收峰一致(图3B), 由此证明米诺环素成功地装载到了MNBG上。
由4种米诺环素-MNBG载药体系热重分析样品质量随温度变化曲线(图4)可知, 当温度从30 ℃升至700 ℃时, 米诺环素几乎全部分解无残余, 其质量变化的过程可大致分为3个阶段。第1阶段是在30~200 ℃范围内, 由于样品中水分挥发导致样品质量下降; 随后样品质量变化为一短暂平台期, 说明样品中水分子完全蒸发, 质量相对恒定; 第3阶段随着温度的进一步增加, 米诺环素分子开始分解, 样品质量出现大幅度减少, 直至700 ℃完全分解。因此, 为排除水分的影响, 选用200~700 ℃的样品质量下降数据计算MNBG颗粒装载米诺环素的质量。未载药的MNBG的热重曲线显示当温度升至700 ℃, 样品质量的减小幅度仅为10%左右。4组中, 米诺环素-MNBG曲线与MNBG曲线的差值由60S到90S递减, 表明其对米诺环素的装载量呈逐渐减小的趋势。通过计算, 药物装载率60S组为16.33%、70S组为13.85%、80S组为7.82%、90S组为 3.44%。
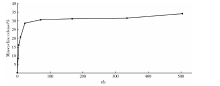
选取装载率最高的60S进行药物释放实验。用已知不同浓度的米诺环素标准溶液在350 nm处的光密度值绘制的标准曲线, 计算所得光密度y与底物浓度x(g/L)满足Beer-Lambert law的线性关系, 为y=21.21x+0.005 5, 其R2值为0.999 38, 具有良好的相关性。图5所示为米诺环素-MNBG(60S)载药体系在21 d中药物的累积释放量曲线, 可见米诺环素在前24 h中呈现突释, 之后药物的浓度仍有持续的小幅度上升, 最终药物浓度稳定并维持在约47 mg/L, 总药物释放量约为装载量的35%。
琼脂扩散实验结果(图6A、B)显示, 1 g/L的米诺环素-MNBG组以及1 g/L和0.1 g/L的米诺环素组可见抑菌环, 其抑菌环直径大小顺序为:1 g/L米诺环素> 0.1 g/L米诺环素> 1 g/L米诺环素-MNBG, 经统计学分析发现, 各组间差异均有统计学意义(图6C, P< 0.05), 而1 g/L MNBG与PBS组未见抑菌环。
与其他给药方式相比, 药物输送系统的优势在于:(1)提高难溶药物的溶解性; (2)保持药物的生物活性; (3)可实现对病灶部位的靶向治疗; (4)可实现药物释放的可控性及持续性。介孔材料因其比表面积大被广泛应用于药物输送系统[16, 17]。从药物的装载率来看, 介孔生物活性玻璃材料对药物和生物因子的装载率更高, 但对于不同类型的药物与不同材料的形貌特征, 装载率可能会有较大的差异。周艳玲等[18]将介孔58S的生物活性玻璃作为抗癌药物的载体评价了其对表阿霉素的装载量和释放性能, 结果表明, 介孔58S对亲水性药物表阿霉素的装载量为40%, 是溶胶凝胶58S生物玻璃的3倍, 并具有更长效的释放特性; 而Li等[19]的研究结果显示, 介孔BG对庆大霉素有高达79%~83%的装载率, 并可以在超过6 d的时间内持续释放抗菌药物。
本研究制备的介孔生物活性玻璃为350 nm左右的均匀球形, 具有大量介孔结构和较大的比表面积, 具备作为良好药物载体的条件。在本研究中, MNBG对米诺环素的最大装载量约为16%, 装载量相对较小, 这可能与四环素类药物本身具有的在碱性条件下不稳定、遇光易分解、易与金属离子螯合等特性有关。Domingues等[20]用非介孔BG对四环素的装载率不到10%, 而且该研究在BG制备的过程中加入药物, 材料制备过程中需要多步酸碱催化反应及加热烧结, 可能会对药物的活性产生影响。本研究利用介孔BG直接吸附米诺环素, 药物装载过程简单, 条件温和, 不经酸碱催化反应及加热烧结, 更利于保持药物的活性。MNBG对米诺环素的装载率大小不仅取决于材料的比表面积, 也与材料的孔径、药物分子的大小有关。本研究比表面积最大的90S对米诺环素的装载率远远小于60S, 分析原因可能是由于米诺环素在水溶液中易与二价金属离子螯合, 而60S中Ca的含量在4种MNBG中最高且平均孔径最大, 在水中会解离出更多的Ca2+与米诺环素螯合, 二者生成的络合物会吸附在颗粒孔径较大的孔里面, 因此增加了米诺环素的装载率。
米诺环素-MNBG载药系统的药物释放结果显示, 在开始的24 h内米诺环素呈现突释模式, 与既往文献中所描述的结果相似[20]。药物的突释是由于与材料相互作用力较弱的药物分子快速解离。在随后的20 d中可观察到药物浓度随时间缓慢小幅上升并维持在一定的水平, 表明MNBG对米诺环素有控释作用, 但药物的总释放量仅为35%, 这可能与MNBG螯合的米诺环素分子吸附在材料的大孔中难以溶出有关。Domingues等[20]用非介孔BG装载四环素后四环素的释放也观察到了类似的结果。
尽管MNBG对米诺环素的载药量相较于其他药物并不高, 但抗生素类药物在相对微量的条件下也能发挥其药理作用。有研究显示[1], 在牙髓的修复再生治疗中, 应用TAP药物中米诺环素达到25 mg/L时, 就有明显的抑制细菌生长的作用。本研究1 g/L的米诺环素-MNBG载药系统其米诺环素总体的释放量约为总量的35%, 最终浓度约为47 mg/L, 可以满足牙髓再生治疗中对于该药物浓度的要求。粪肠球菌作为一种在根尖炎中常见的致病菌, 常被用于各种牙髓根尖感染的研究。琼脂扩散实验的结果也证实, 1 g/L的米诺环素-MNBG浸提液可以抑制粪肠球菌的生长。尽管其产生的抑菌环直径仍小于0.1 g/L的米诺环素, 但计算可得载药系统浸提液中有效的药物浓度也仅能达到0.1 g/L米诺环素的70%左右。因此, 本研究结果显示采用60S的MNBG装载和缓释米诺环素, 能够抑制粪肠球菌的生长, 未来可通过提高米诺环素的装载量, 进一步提高药物的释放量, 增强载药系统的抑菌性。
综上所述, 60S MNBG可有效装载、缓释米诺环素, 是较为理想的载药材料; 米诺环素-MNBG载药系统可抑制粪肠球菌生长, 本课题组进一步将研究其在牙髓再生中的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|