颞下颌关节骨关节炎(temporomandibular joint osteoarthritis, TMJOA)是以关节软骨的进行性破坏为特征性表现的关节退行性疾病[1]。确切病因及发病机制尚不明确, 目前普遍认为环境因素与多基因协同作用使TMJOA易感性增加[2]。单核苷酸多态性(single nucleotide polymorphism, SNP)约占人类基因多态性的90%, 是人类DNA变异中最常见、最稳定的变异, 目前广泛用于基因多态性与疾病的关联性研究[3]。位于编码区内的SNP(coding SNP, cSNP)包括同义cSNP(synonymous cSNP)和非同义cSNP(non-synonymous cSNP)。
负荷过重、蛋白酶及细胞因子表达异常等因素可使软骨的细胞外基质(extracellular matrix, ECM)分解和合成代谢失衡, 最终导致软骨破坏[4]。带有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs, ADAMTS)在软骨ECM降解中发挥至关重要的作用[5, 6]。Colige等[7]的研究发现, ADAMTS14参与Ⅱ 型胶原纤维的形成。Ⅱ 型胶原是构成关节软骨ECM的主要成分之一, 其代谢异常可导致关节软骨机械强度减低, 是骨关节炎(osteoarthritis, OA)发病过程中的重要因素[8]。
ADAMTS14基因rs4747096是位于编码区的非同义SNP, 可使翻译的氨基酸序列发生改变, 最终可能影响生物学性状。Rodriguez-Lopez等[9]的研究表明, 需行膝关节置换的女性OA患者中, ADAMTS14基因rs4747096非同义cSNP等位基因G频率明显高于对照组, ADAMTS14基因多态性与膝关节OA的发病有相关性。然而, ADAMTS14基因多态性与TMJOA的相关性目前尚未见研究报道。本研究旨在通过对汉族女性TMJOA病例组及健康对照组ADAMTS14基因rs4747096非同义cSNP进行检测, 探讨ADAMTS14基因多态性与汉族女性TMJOA之间的相关性。
本研究的纳入对象均为中国汉族女性, 采用病例-对照研究。
病例组为在北京大学口腔医院颞下颌关节病及口颌面痛诊治中心就诊, 根据RDC/TMD (Research Diagnostic Criteria for Temporomandibular Disorders)诊断为TMJOA, 且影像学颞下颌关节有髁突骨质破坏、增生硬化、骨赘形成或囊样变的患者, 排除颞下颌关节感染性、创伤性、类风湿性等特殊类型的关节炎, 以及伴有髁突畸形、肿瘤的患者, 最终共纳入103例。病例组患者平均年龄为(33.74± 13.41)岁, 单侧发病44例(42.7%), 双侧发病59例(57.3%)。
对照组为无TMJOA及其他部位关节炎表现者, 无颞下颌关节紊乱病病史, 且影像学表现双侧髁突骨皮质光滑、连续, 共纳入110例。对照组平均年龄为(30.88± 9.57)岁。
本研究经北京大学口腔医院生物医学伦理委员会批准, 受试者均充分告知并签署知情同意书。
病例组与对照组均抽取2 mL外周静脉血, 置于EDTA抗凝管中, -80 ℃保存。使用血液基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kits, QIAGEN, 德国)提取基因组DNA, 具体方法根据产品操作手册进行。采用分光光度计(721分光光度计, 上海第三分析仪器厂)测光密度值(D)和DNA浓度, -20 ℃保存。
采用Generunner 6.2.07 Beta软件进行引物设计, 由北京六合华大基因公司进行引物合成。正向引物序列:5'-TGTGCAGGACCAACGCCAACAG-3', 反向引物序列:5'-GGAATTGCAGGTAACGGCTCATG-3'。PCR反应体系内含2× Es Taq MasterMix(康为世纪)12 μ L, 10 μ mol/L正、反向引物各2 μ L, DNA模版2 μ L, 灭菌双蒸水9 μ L。采用PCR仪(Biometra, 华粤)进行扩增, 反应条件:94 ℃预变性2 min后进入30个循环, 每个循环包括98 ℃变性10 s, 61 ℃退火30 s, 72 ℃延伸30 s, 最终72 ℃延伸2 min, 4 ℃保存。
将PCR产物送往北京六合华大基因公司进行DNA测序, 采用Chromas 2.22软件分析测序峰图, 确定基因分型。
采用SPSS 21.0软件进行统计学分析。年龄分布采用t检验, 基因型及等位基因频率分布采用卡方检验, 计算比值比(odds ratio, OR) 及95%可信区间(confidence interval, CI), P< 0.05为差异有统计学意义。
病例组平均年龄(33.74± 13.41)岁, 对照组平均年龄(30.88± 9.57)岁, 病例组与对照组平均年龄差异无统计学意义(t=1.798, P=0.074)。
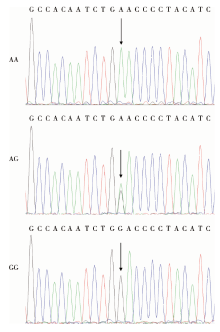
rs4747096位点AA、AG、GG基因型测序峰图见图1。基因型和等位基因频率满足Hardy-Weinberg平衡定律。ADAMTS14基因rs4747096位点SNP基因型频率在病例组和对照组中差异有统计学意义(χ 2=6.103, P=0.047, 表1), 等位基因型频率在两组中差异无统计学意义(χ 2=0.663, P=0.415, 表2)。显性模型中AA、AG为患病风险因素, 相对于GG明显增加了患TMJOA的风险(OR=1.114, 95% CI: 1.015~1.223, P=0.028, 表2)。
| 表1 ADAMTS14基因rs4747096非同义编码区SNP基因型频率分布 Table 1 Distribution of genotype frequency of non-synonymous coding SNP for rs4747096 of ADAMTS14 gene |
| 表2 rs4747096等位基因频率, 显性模型、隐形模型基因型频率分布 Table 2 Genotype frequency distribution of alleles, dominant model and recessive model for rs4747096 |
TMJOA可引起颞下颌关节疼痛、下颌运动受限以及咀嚼、言语等功能障碍, 长期慢性疼痛的症状甚至可引发心理问题。颞下颌关节髁突软骨破坏、骨质吸收严重者可导致错牙合、面部畸形, 影响患者的生活质量。不同个体对TMJOA的易感性存在差
异[10], 目前普遍认为是多基因协同作用的结果[11], 但确切的分子机制仍不明确。
关节软骨的进行性破坏是TMJOA的特征性表现之一。颞下颌关节的关节软骨为纤维软骨, 软骨基质中的胶原蛋白占软骨干重的50%~60%, 以Ⅱ 型胶原(90%)为主[4]。Ⅱ 型胶原蛋白可抵抗软骨承受的张力, 其正常结构对维护软骨的机械强度至关重要。关节软骨浅表区的胶原纤维破坏是早期OA的组织病理学标志[12]。动物实验表明, 早期OA关节软骨中胶原纤维直径增大, 此类软骨微结构的改变比软骨下骨破坏出现得更早[13, 14]。
ADAMTSs是一类具有金属蛋白酶结构域、解聚素结构域及血小板反应蛋白结构域的分泌型蛋白酶[15], 参与软骨基质中的胶原、蛋白多糖降解。针对ADAMTSs家族成员基因多态性、蛋白表达水平等的相关研究, 已成为OA发病机制研究的焦点。Li等[16]发现早期膝关节OA患者血清中ADAMTS4水平要明显高于健康人群, 而中、晚期患者血清ADAMTS5水平明显高于健康人群, 并推测ADAMTS4有可能成为早期OA的血清学标记物。Majumdar等[17]的研究发现敲除ADAMTS4/5基因的小鼠OA的严重程度较野生型明显减轻。Miller等[18]研究发现应用ADAMTS5抗体可减缓小鼠膝关节OA病程中的软骨破坏。Gok等[19]发现ADAMTS9基因CA重复序列长度≥ 20者膝关节OA更严重。ADAMTS1、4、5、8、9、15可促进关节软骨中的蛋白聚糖降解, ADAMTS7、12参与软骨基质中寡聚蛋白的降解[20]。国内外的研究成果显示ADAMTSs与OA密切相关, 而进一步明确这种相关性则有助于从根本上预防TMJOA的发生, 并有助于TMJOA的早期诊断和治疗。
ADAMTS14基因位于染色体10q22.1, 目前, ADAMTS14的功能尚不完全明确。由于ADAMTS14基因和ADAMTS3基因(63%)具有同源性, Fernandes等[21]推测ADAMTS14与ADAMTS3功能相似, 可裂解胶原单体N-端前肽, 促进Ⅱ 型胶原单体聚合成Ⅱ 型胶原纤维, 参与软骨损伤后的修复过程。
ADAMTS14基因编码的蛋白质包含1 223个氨基酸, 由信号肽、前结构域、金属蛋白酶结构域、解聚素结构域、4个凝血酶敏感蛋白结构域和羧基末端结构域组成, 4个凝血酶敏感蛋白结构域被富含半胱氨酸的氨基酸片段间隔开。rs4747096位点A> G, 等位基因G是祖先型等位基因, 但在欧、亚、非洲人中等位基因A所占比例更大, 因此等位基因A可能是自然选择过程中的优势基因。碱基序列的改变导致编码的蛋白质分子羧基端结构域中的氨基酸由谷氨酸(GAA)转变为甘氨酸(GGA), 但目前由此引发的功能改变尚不明确。我们推测ADAMTS14基因rs4747096位点的多态性, 可能会引起Ⅱ 型胶原蛋白成熟过程异常, 从而导致软骨破坏, 但这一过程仍需进一步的研究验证。
目前国际上已有多项关于ADAMTS14基因rs4747096非同义cSNP与OA相关性的研究。有一项涉及3 000例英国女性的全基因组关联分析(genome-wide association study, GWAS)研究表明, ADAMTS14基因rs4747096非同义cSNP与膝关节OA有明显相关性。Poonpet等[22]的研究发现, 泰国女性膝关节OA患者的基因型AA及等位基因A明显高于对照组, AA和AG增加了患病风险, 这一结果与我们的研究结果相符。除与OA易感性有关外, El Khoury等[23]的研究发现在跟腱病患者中, ADAMTS14基因rs4747096位点GG基因型可能是一个保护性因素, 可延缓病程的进展。
本研究通过对中国汉族女性病例组与对照组的ADAMTS14基因rs4747096非同义cSNP的基因型检测分析发现, 两组中ADAMTS14基因rs4747096非同义cSNP基因型频率的差异有统计学意义。显性模型中, 病例组的AA和AG明显高于对照组, 是TMJOA的风险因素(OR=1.114, 95% CI: 1.015~1.223, P=0.028), GG则是TMJOA的保护性因素(OR=0.377, 95% CI: 0.155~0.919, P=0.028)。
通过分析本研究结果以及回顾以往文献, 我们发现ADAMTS14基因rs4747096 非同义cSNP与高加索人种、蒙古人种的女性OA都有不同程度的相关性, 但在男性OA患者中未发现明显相关性[22], 我们推测这可能与女性特殊的雌激素水平有关, 今后可进一步对ADAMTS14、雌激素及其受体的基因多态性在OA发病中是否具有协同作用进行分析。
现有的TMJOA治疗方法的主要作用为缓解症状, 恢复功能, 防止软骨及软骨下骨进一步破坏, 较难从根本上阻止或逆转已发生的软骨病损[24]。然而, 进一步明确ADAMTS14基因rs4747096非同义cSNP与TMJOA的相关性, 明确其在发病过程中的作用, 有助于了解OA发病的分子机制, 探索新的药物靶点[2]。本研究样本量较小且仅限于女性, 今后还需要进一步扩大样本量进行验证, 并对更多的ADAMTS14基因SNP位点进行检测, 同时也应增进ADAMTS14基因的功能研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|