乳牙牙髓干细胞(stem cells from human exfoliated teeth, SHED)具有高度增殖能力和自我更新能力等生物学特性, 可以向成牙本质细胞、成骨细胞、脂肪细胞、神经细胞、肝细胞和软骨细胞等方向分化, 是组织工程的一种优良的种子细胞, 但目前的试验结果仍不能满足SHED的临床应用要求, 为提高SHED在细胞治疗中的成功率和最大程度地利用SHED的生物学特性, 细胞分选可能是一种有效的方法。
CD146也称为黑素瘤细胞黏附分子(melanoma cell adhesion molecule, MCAM)或细胞表面糖蛋白MUC18, 是血管内皮细胞活性和血管生成的关键细胞黏附蛋白[1]。作为一种被广泛承认的间充质干细胞标志, CD146已被用来鉴定多种成人或胎儿器官来源的间充质干细胞[2, 3]。
CD146在SHED中呈阳性表达[4], 本实验采用磁激活分选法(magnetically activated cell sorging, MACS)对SHED进行细胞分选, 得到CD146阳性及阴性细胞亚群, 对未筛选的混合细胞群、CD146阳性和阴性细胞亚群进行增殖能力、成骨分化、成脂分化及成神经分化等生物学特性的比较, 以明确SHED的CD146阳性及阴性细胞亚群的生物学特性, 探索其在组织工程不同领域中的针对性应用, 提高细胞疗法的成功率。本试验获得北京大学口腔医院医学伦理委员会批准, 研究对象均签署知情同意书。
取新鲜拔除的6~10岁健康儿童的无龋滞留乳牙, 70%(体积分数)乙醇溶液消毒牙齿表面, 钳开, 无菌条件下取出牙髓, 反复清洗后剪碎, 置于含Ⅰ 型胶原酶(3 g/L)和 Dispase酶 (4 g/L, Sigma公司, 美国)的消化液中37 ℃下消化45 min, 用含10%(体积分数)胎牛血清的培养基终止消化, 离心弃上清, 重悬后接种于10 cm培养皿, 细胞生长培养基为10%(体积分数)胎牛血清(Hyclone公司, 美国), 1%(体积分数)青、链霉素, 重悬, 接种, 置于37 ℃、5% (体积分数)CO2孵箱内培养, 每2~3天换液1次。待细胞生长汇合后传代培养。
取生长状态良好的第6代SHED 1× 107个, 加入到15 mL离心管中, 300× g离心10 min, 弃上清, 加入Buffer重悬至60 μ L, 按磁珠试剂盒(美天旎公司, 美国)说明加入磁珠, 混匀, 2~8 ℃孵育15 min。加入1 mL Buffer进行清洗, 300 × g离心10 min, 弃上清, 500 μ L缓冲液重悬。
将分选柱置于磁力架上, 预先润湿分选柱, 将细胞悬液加入到分选柱内, 将要滴完时加入3 mL缓冲液, 重复3次, 收集流出的未被磁珠标记的CD146阴性细胞; 从分选器上取下分选柱, 加入5 mL缓冲液, 用分选柱配套的活塞快速推下, 获得磁珠标记的CD146阳性细胞。
离心, 弃上清, 重悬, 计数。加入培养基, 置37 ℃、5%CO2培养箱中培养。
1.3.1 增殖能力 细胞计数试剂盒8(Cell Coun-ting Kit-8, CCK-8)法:取未进行筛选和筛选获得的CD146阳性、CD146阴性的SHED单细胞悬液, 以3× 103个/孔的密度接种于 96 孔板, 每组3个复孔, 分别于第1、3、5、7、9、11、13天加入10 μ L CCK-8 液, 37 ℃孵育2 h后于酶标仪内测定各孔450 nm的光密度值, 并进行统计学分析。
集落形成实验(colony-forming unit, CFU):取未筛选、CD146阳性、CD146阴性的SHED, 以200个/孔的密度接种于6孔板, 每组3个复孔, 7 d后终止培养, 4%(质量分数)多聚甲醛固定, 吉姆萨染液染色, 镜下观察, 大于50个细胞记为一个集落, 计数集落形成数量并进行统计学分析。
1.3.2 成骨分化能力 取未筛选混合细胞、CD146阳性细胞、CD146阴性细胞以1× 105个/孔的密度接种于6 孔板。诱导组加入成骨诱导液[α -伊格尔改良培养基(α -modification of Eagle’ s medium, α -MEM, GIBCO公司, 美国)、10% (体积分数)胎牛血清、10 nmol /L 地塞米松、10 mmol /L β -甘油磷酸钠、50 mg /L 抗坏血酸], 每3天换 1 次液。对照组采用细胞培养液连续培养。
茜素红染色:成骨诱导第21天, 选择普通培养基培养的未筛选细胞群、成骨诱导的未筛选混合细胞、CD146阳性细胞、CD146阴性细胞, 用磷酸盐缓冲液(phosphate buffered saline, PBS)冲洗细胞3次, 4%多聚甲醛固定30 min, PBS 洗3次, 加入0.1%茜素红(Sigma 公司, 美国) 染液, 室温染色10 min, 洗脱干燥后光学显微镜下观察并拍照。
实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qPCR):收集未诱导及成骨诱导14 d 的6组细胞, Trizol 试剂盒(Invitrogen公司, 美国)提取总RNA, 采用PrimeScrip 反转录酶(Promega 公司, 美国)合成cDNA模板。引物由生工生物工程(上海)股份有限公司合成, PCR引物序列见表1。采用qPCR仪(ABI 7500)进行qPCR, 检测各样本的Ct值。通过Ct值结果计算相对定量, 得出各样本中Runt相关转录因2(runt-related transcription factor 2, RUNX2)、骨钙蛋白(Osteocalcin, OCN)和骨涎蛋白(bone sialoprotein, BSP)基因的相对表达量, β -actin为内参基因。
| 表1 基因及实时荧光定量聚合酶链式反应引物序列 Table 1 Specific primer for quantitative real-time polymerase chain reaction |
1.3.3 成脂分化能力 取未筛选混合细胞、CD146阳性细胞、CD146阴性细胞以1× 105个/孔的密度接种于6孔板。诱导组加入成脂诱导液(10 mg/L牛胰岛素、20 μ mol/L 吲哚美辛、500 μ mol/L 3-异丁基-1-甲基黄嘌呤、50 mg/L庆大霉素), 每 3 天换 1 次液。对照组采用细胞培养液连续培养。
油红O染色:成脂诱导第21天, 选择未诱导的未筛选细胞群、成脂诱导的未筛选混合细胞、CD146阳性细胞、CD146阴性细胞, 用PBS冲洗细胞3次, 4%多聚甲醛固定30 min, 在 100%丙二醇中孵育5 min, 0.1%的油红O溶液60 ℃孵育10 min, 85%的异丙醇室温孵育10 min, ddH2O 水冲洗后显微镜观察及拍照。
qPCR:qPCR仪检测各样本的 Ct值。通过 Ct 值结果计算相对定量, 得出各样本中脂蛋白脂酶(lipoprotein lipase, LPL)和过氧化酶活化增生受体γ (peroxisome proliferator activated receptor gamma, PPARG)基因的相对表达量, β -actin为内参基因。
1.3.4 成神经分化能力 取未筛选、CD146阳性、CD146阴性的SHED以1× 105个/孔的密度接种于6孔板或接种于细胞爬片, 每组3个复孔。诱导组加入成神经诱导液:无血清DMEM/F12培养基, 2%(体积分数) B27, 2 %(体积分数) N2 , 40 μ g/L神经生长因子(nerve growth factor, NGF), 25 μ g/L 脑源性神经营养因子(brain-derived neurotrophic factor, BDNF), 25 μ g/L纤维母细胞生长因子 (basic fibroblast growth factor, bFGF), 诱导14 d, 每3天换1次液。对照组采用细胞培养液连续培养。
细胞免疫荧光:在爬片盖玻片上接种未筛选、CD146阳性、CD146阴性的SHED, 实验组进行成神经诱导, 对照组加入普通培养基14 d后, 4%多聚甲醛室温固定10 min, 0.1%(体积分数) TritonX-100 4 ℃孵育5 min, 1%(体积分数)牛血清白蛋白溶液37 ℃封闭2 h, 室温下PBS洗1次, 孵育巢蛋白(nestin)、微管相关蛋白2(microtubule-associated protein 2, MAP2)、神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)一抗, 4 ℃过夜, 室温下避光孵育二抗1 h, 洗脱后滴加含4’ , 6-二脒基-2-苯基吲哚二盐酸盐(4’ -6 diamidino-2 phenylindole, DAPI)的荧光封片剂封片, 避光保存, 激光共聚焦显微镜拍照。
qPCR: qPCR仪检测各样本的 Ct值。通过 Ct 值结果计算相对定量, 得出各样本中nestin、MAP2的相对表达量, β -actin为内参基因。
用IBM SPSS 19.0软件对结果数据进行统计学分析, 定量资料采用均数± 标准差表示, 多组数据比较采用单因素方差分析(One-way ANOVA), LSD法进行两两比较, P< 0.05认为差异具有统计学意义。
重复3次筛选, 得到CD146阳性亚群和阴性亚群计数结果分别为(4.50± 0.82)× 106个和(8.29± 0.11)× 106个。
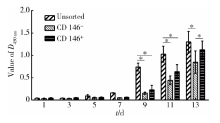
CCK8法结果(图1)显示, 3组细胞(未筛选的混合细胞群、CD146阳性和阴性亚群)的增殖趋势一致, 但CD146阳性和阴性亚群的增殖能力都显著低于未筛选的细胞(P< 0.05), 阴性细胞亚群的增殖能力略低于阳性细胞亚群, 但是仅在第13天时差异有统计学意义(P< 0.05)。
接种7 d后细胞均呈集落样生长, 肉眼可见克隆集落的形成, 集落大小不一, 分布均匀。计数各组细胞集落形成数目, 计算集落形成率, 对照组、阳性亚群和阴性亚群的集落形成率分别为28.6%± 3%、17.1%± 2.3%和27.5%± 2.5%, 结果显示阳性和阴性亚群的集落形成能力要低于未筛选细胞, 阳性亚群与阴性亚群和未筛选细胞之间的差异具有统计学意义(P< 0.05), 阴性亚群和未筛选细胞之间差异没有统计学意义(P> 0.05)。
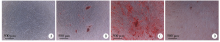
茜素红染色:3组细胞成骨诱导21 d后, 茜素红染色均可见红色的矿化沉积物质, 其中阳性亚群的染色最深, 阴性细胞亚群染色最浅(图2)。
成骨相关基因表达:在未进行诱导前, 阳性亚群的RUNX2、OCN、BSP的表达即显著高于未筛选的混合细胞群和阴性亚群(P< 0.05)。成骨诱导 14 d后, 未筛选的混合细胞、CD146阳性细胞中RUNX2、OCN、BSP基因的表达量均提高, 且显著高于未进行诱导的混合细胞群, 差异具有统计学意义(P< 0.05)。对诱导后的未筛选混合细胞、CD146阳性细胞、CD146阴性细胞进行两两比较发现, 成骨相关基因的表达量CD146阳性细胞> 未筛选的混合细胞> CD146阴性细胞, 差异均具有统计学意义(P< 0.05, 图3)。
油红O染色:3组细胞成脂诱导21 d后, 油红O染色均可见脂滴形成, 其中CD146阴性亚群的脂滴体积最大、数量最多, 阳性亚群成脂表现最弱(图4)。
成脂相关基因表达:诱导的3组细胞成脂相关基因表达都有升高(P< 0.01), 进行两两比较, 成脂相关基因表达CD146阴性亚群和混合细胞群都强于CD146阳性亚群(P< 0.05), PPARG在CD146阴性亚群中的表达要高于混合细胞群, 差异具有统计学意义(P< 0.05) , LPL的表达在混合细胞群和CD146阴性亚群中差异不大(图5)。
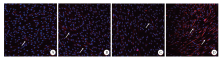
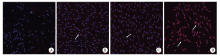
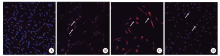
细胞免疫荧光:成神经诱导14 d天后, 纺锤样、带长突起的成纤维样细胞逐渐增多。采用细胞免疫荧光法检测nestin、NeuN在未诱导混合细胞群、诱导后的混合细胞群、CD146阳性亚群和CD146阴性亚群细胞内的表达, 结果发现在未诱导组中有nestin的少量表达, 诱导后未筛选的混合细胞群、CD146阳性亚群中nestin少量表达, CD146阴性亚群中nestin阳性表达。在未诱导组中没有发现NeuN的表达, 诱导后的混合细胞群、CD146阳性亚群中NeuN少量表达, CD146阴性亚群中NeuN阳性表达; 未诱导组中没有发现GFAP的表达, 诱导后的混合细胞群、CD146阳性亚群中GFAP阳性表达, CD146阴性亚群中GFAP阳性表达较弱(图6~8)。
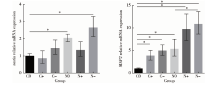
成神经相关基因表达:成神经诱导14 d后, CD146阴性亚群和混合细胞群的nestin和MAP2表达量均有提高, 但CD146阴性亚群和混合细胞群与CD146阳性亚群组间差异并不具有统计学意义(P< 0.05)。CD146阳性亚群MAP2表达显著提高, nestin表达稍高于未诱导前的混合细胞群, 但差异不具有统计学意义(P> 0.05, 图9)。
研究表明, 间充质干细胞是具有多个亚群的异质群体[5, 6, 7], 混杂存在的其他细胞可能使细胞疗法的疗效降低甚至导致治疗的失败, 对于分化能力不均的间充质干细胞, 纯化干细胞可以获得能够进行特定分化的细胞亚群, 可以使细胞的潜在分化能力得到最优利用。
CD146在间充质干细胞中的表达约为40%~70%[8, 9]。Schwab等[10]对子宫内膜基质细胞群根据不同表面标记物进行筛选后, 发现CD146阳性的细胞群的集落形成能力要强于CD90、Stro-1或CD133阳性细胞群。Halfon等[11]对骨髓源的间充质干细胞进行研究后发现, CD146仅表达在干细胞表面, 在成纤维细胞表面不表达。另有报道CD146的表达与多能性有关, 在骨髓源间充质干细胞中具有更大分化潜力的间充质干细胞, 在细胞表面表达的CD146水平更高[12], 这些研究表明, CD146的表达可能与细胞的某些生物学特性存在一定的关联, 但是具体的调控机制以及关联是否存在特异性尚无定论。
MACS技术基于抗原抗体特异性结合的免疫原理, 可以分离得到高纯度的特定间充质干细胞亚群[13], 该方法不影响分离细胞的生存和增殖能力。
CCK8法实验结果发现混合细胞群的增殖能力要强于阴性和阳性细胞群, 且在9 d以后差异存在统计学意义(P< 0.05)。阴性亚群的增殖能力略弱于阳性亚群, 但在13 d以前差异都不存在统计学意义(P> 0.05)。集落形成能力实验结果则表明混合细胞群和阴性亚群的集落形成能力相差不大, 但都显著性地强于阳性亚群(P< 0.05)。虽然都是对细胞的增殖能力进行检测, 但是CCK8与CFU实验的意义并不完全相同, CCK8是对细胞活性进行检测, 反映了大量细胞增殖和凋亡共同作用下的总体效果, 间接反映了细胞数量及细胞生长情况, 而CFU实验反映的则是单个细胞的增殖能力, 不能反映凋亡情况。大量细胞共同生长的情况下, 细胞之间存在着复杂的相互作用, 包括旁分泌、接触抑制等, 因此单个细胞的增殖与克隆形成能力与整体的增殖和凋亡情况并不一致。本试验结果显示CD146阳性亚群的集落形成能力要弱于阴性亚群, 但是从总体来看, 当阳性和阴性亚群共同生长时, 细胞总体的增殖能力要强于任何一种细胞亚群, 这可能表明阳性和阴性亚群之间存在着相互作用, 使得细胞总体的增殖能力得到强化。一般认为[14, 15]MACS技术对后续实验不产生影响, 但也不能排除分选过程或结合的磁珠影响了细胞增殖, 具体的机制有待进一步研究。研究细胞亚群间增殖能力互相促进作用的机制, 对细胞疗法的疗效提高有一定的指导意义。
SHED具有间充质干细胞特征性的多向分化能力。茜素红染色结果说明, CD146阳性细胞亚群成骨分化、促进骨基质沉积的能力最强。RUNX2、OCN与BSP都是矿化组织的重要检测指标, 但出现于成骨向分化的不同阶段。qPCR结果表明, 成骨诱导前和诱导后CD146阳性细胞群mRNA水平均显著高于混合细胞及阴性细胞群(P< 0.01)。本实验结果与Zhu等[16]对牙周膜干细胞进行CD146分选后得到的结论类似, 即CD146阳性细胞亚群的成骨能力要强于阴性亚群。CD146阳性细胞群可能还有良好的成软骨能力[17], 可能成为骨组织工程较为理想的种子细胞群。
成脂诱导3周之后进行油红O染色结果说明阴性细胞亚群的成脂能力强于其他两组细胞。本实验用qPCR方法对成脂诱导前后的未筛选的混合细胞群、CD146阳性细胞亚群和CD146阴性细胞亚群细胞内LPL、PPARG的mRNA的表达进行了检测, 结果表明, 在诱导前, CD146阴性细胞亚群的LPL-mRNA 水平稍高于阳性细胞群(P< 0.05); 进行成脂诱导后, 3组细胞的LPL、PPARG的水平都显著升高(P< 0.01), 3组进行两两比较后, mRNA水平为CD146阴性细胞群> 混合细胞群> 阳性细胞群(P< 0.05), 说明CD146阴性细胞亚群具有更强的成脂分化潜能。间充质干细胞既是成骨细胞的前体细胞, 又是脂肪样细胞的前体细胞, 其成骨和成脂分化存在竞争性的平衡关系, 这种平衡的打破与多种代谢疾病有着密切的联系[18]。成脂分化能力的抑制或可用来增强成骨能力, 防治骨质疏松症, 还可用来合成药物抑制肥胖症及其并发症等。
牙髓间充质干细胞已被多次证明具有神经分化潜能[19, 20, 21]。本实验对CD146阳性和阴性亚群的成神经分化潜能进行了比较, 成神经诱导方法参考Feng等[22]的研究。nestin是神经干细胞或前体细胞表达的一种中间丝蛋白, 其功能现在尚未完全明确, 但常利用nestin在早期神经元中分布的特征, 通过检测nestin的表达以确定多潜能干细胞的存在。对未进行诱导的SHED进行染色即可发现nestin的存在, 说明未筛选的混合细胞群中存在神经前体细胞成分, 有成神经分化的潜能。NeuN抗体可以特异性识别神经元, GFAP是胶质细胞的一种标志蛋白, 细胞免疫荧光结果发现阴性亚群的nestin和NeuN标记蛋白荧光最强, 而诱导后的阳性亚群与混合细胞群都阳性表达GFAP, 阴性亚群GFAP表达较弱。MAP2是树突的特异性标志物。qPCR结果表明诱导后阴性亚群和混合细胞群的nestin水平高于未诱导组(P< 0.05), 阴性亚群稍高于混合细胞群, 又高于阳性亚群, 差异无统计学意义, 进行诱导后的MAP2水平也存在类似的趋势。虽然本研究没有对胶质细胞分化进行qPCR, 但是免疫荧光的结果与文献中牙髓间充质干细胞在诱导后GFAP的mRNA表达水平上升是一致的[23]。结合免疫荧光和实时定量qPCR的结果来看, CD146阳性亚群及混合细胞群胶质细胞分化潜能更强, 可见CD146阳性及阴性亚群的神经分化可能有着不同的分化方向, 混合细胞群与阳性亚群倾向于胶质细胞分化, 阴性亚群神经前体细胞和神经元分化潜能更强。继续深入研究不同细胞亚群神经相关因子分泌情况, 结合其各自的分化潜能, 可以以不同的作用方式针对性地对特定的神经系统疾病进行治疗, 将对SHED在神经系统相关疾病中的应用起到指向作用。
本实验通过对SHED不同表型亚群的生物学特性的研究, 发现亚群间的生物学特性并不一致。CD146阳性亚群有着较强的成骨分化潜能, 有望用来改善组织工程成骨技术的治疗效果。CD146阴性亚群有较强的成脂分化潜能。混合细胞群与CD146阳性细胞群倾向于胶质细胞分化, 阴性亚群有更强的神经前体细胞和神经元分化潜能。不同间充质干细胞亚群的表型与功能之间的联系尚不清晰, 仍需要进一步的实验验证。现在细胞治疗已经开始进入临床应用, 有必要对间充质干细胞的获取、分选与培养等技术进行标准化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|