*These authors contributed equally to this work
MicroRNA(miRNA)是一类小分子非编码RNA, 一般为20~24个核苷酸, 经与靶基因的3'端非编码区域互补配对, 通过抑制或降解作用在转录后水平进行调控[1], 广泛存在于真核生物体内并发挥多种重要的调控功能[2]。当某些miRNA由于基因扩增、缺失、变异等原因发生表达失调(增多或减少)时, 可以导致恶性肿瘤的发生。miRNA可作为一类肿瘤标志物, 协助恶性肿瘤的早期诊断、疗效评估及预后判断, 甚至部分miRNA本身可作为治疗药物[3, 4]。microRNA-155(miR-155)是早期发现具有癌基因功能的miRNA, 定位于染色体21q23中的B细胞整合簇的非编码区, 参与分化、造血、炎症、凋亡和免疫过程[5]。研究证实, miR-155显著高表达于乳腺癌、肺癌、结肠癌、胰腺导管癌、甲状腺癌、淋巴瘤等多种恶性肿瘤, 在肿瘤发生、发展、侵袭及转移中发挥重要的作用[6]。评价恶性肿瘤中高表达的miR-155, 对恶性肿瘤的早期诊断、疗效评价、治疗指导等方面具有潜在的应用价值[4]。
反义寡核苷酸能够与序列互补的miRNA发生特异性的结合, 利用这一特点, 设计和合成与特定miRNA互补结合的反义寡核苷酸(anti-miRNA oligonucleotide, AMO), 标记放射性核素达到放射性示踪作用, 可在体内与互补的miRNA进行特异性结合, 显示肿瘤部位高表达的miRNA分布, 通过放射性显像设备在活体水平对肿瘤进行显像[7]。本研究通过双功能螯合剂NHS-MAG3介导放射性核素锝-99m(99mTc)标记miR-155靶向的AMO, 在活体水平评价其在乳腺癌荷瘤裸鼠模型的显像情况, 拟为肿瘤阳性显像提供一种新型的无创性显像探针。
S-乙酰基-NHS-MAG3(MW=402.38)由Wang Yi教授(University of Massachusetts Medical School)提供。AMO选择与miR-155完全互补的序列, 在5'端连接6碳己基和氨基提供偶联结构。AMO-155序列为5'-NH2-C6-ACCCCTATCACAATTAGCATTAA-3', 在AMO两端6个碱基进行硫代修饰(phosphorothioate, PS)、两端各3个碱基2'-甲氧基修饰(2'-O-methyl, 2'-OMe)以提高核酸稳定性。对照组探针(scramble control)序列为5'-NH2-C6-CATTAA TGTCGGACAACTCAAT-3', 修饰方式同上, 以上探针由生工生物工程(上海)股份有限公司进行化学合成和修饰。Sephadex G25购于美国GE Amersham公司, 99mTc高锝酸钠溶液购于中国北京原子高科技术股份有限公司, RM905放射性活度仪购自中国计量科学研究院, MPR SPECT为美国GE公司产品。N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES)、氯化亚锡(SnCl2· 2H2O)、二甲基甲酰胺购于Sigma-Aldrich公司; 酒石酸钠、乙酸铵、氢氧化铵等常规分析纯化学试剂购于北京化学试剂公司。
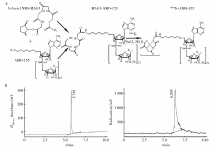
99mTc-AMO-155标记探针的制备分为AMO-155与NHS-MAG3的偶联反应及99mTc标记反应两步, 基本与之前研究相同[8]。取适量AMO探针溶于0.30 mol/L HEPES缓冲液(pH=8.0)中, 与适量NHS-MAG3相混, 使MAG3 :AMO的最终摩尔比为15 :1, 室温下静置反应1 h后得到偶联产物, 纯化后在碳酸氢钠(0.5 mol/L)、乙酸铵(0.25 mol/L)和氢氧化铵(0.175 mol/L)的酒石酸钠缓冲液(pH=9.2)中, 加入适量新鲜的99mTc
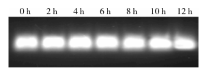
将99mTc标记的AMO-155(440 pmol)按照体积比1 :2溶于新鲜人血清中, 室温静置12 h, 分别使用2%(质量分数)琼脂糖凝胶电泳评价该探针在0 h、2 h、4 h、6 h、8 h、10 h、12 h的血清稳定性。
MCF-7、MDA-MB-231乳腺癌细胞系购买于美国典型培养物保藏中心(American Type Culture Collection, ATCC)。将细胞在5%(体积分数)CO2、37 ℃条件下常规培养于含10%(体积分数)胎牛血清及双抗的高糖DMEM培养基(Invitrogen公司)中。雌性nu/nu裸鼠(4周龄, 15 g)购买并饲养于北京大学第一医院实验动物中心。将处于对数生长期的1× 107的MCF-7和MDA-MB-231细胞分别接种于小鼠右腋下, 待肿瘤直径长至1.0~1.5 cm即可用于活体动物显像。
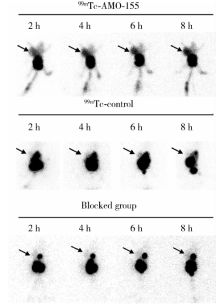
取miR-155高表达的MCF-7及miR-155低表达MDA-MB-231荷瘤裸鼠各6只, 分别经尾静脉注射99mTc-AMO-155及99mTc-control探针(2 mg/kg, 约400~600 μ Ci, 1 Ci=3.7× 1010 Bq)。此外, 取3只MCF-7荷瘤裸鼠预先尾静脉注射无标记的AMO-155(20 mg/kg)进行阻断, 2 h后再注射99mTc-AMO-155进行显像。将裸鼠俯卧位使用低能、高分辨平行孔准直器采集静态图像(0.5、1、3、6 h), 采集计数为200 000, 像素为256× 256, 放大倍数为2.67倍。
显像后, 脱颈处死荷瘤裸鼠取肿瘤组织, 通过qRT-PCR测定其miR-155水平。先使用Trizol试剂(Invitrogen公司)从肿瘤组织中提取总RNA, 再使用TaqMan miRNA逆转录试剂盒(ABI公司)合成cDNA, 然后使用TaqMan miRNA分析试剂盒(ABI公司)对其扩增。使用U6RNA作为内参, 对miR-155的含量进行定量, 以循环阈值(threshold cycle)表示miR-155的相对表达量。
应用SPSS 17.0统计学软件进行统计学分析, 定量资料用均数± 标准差来表示。两组间的比较采用Student’ s t检验进行分析, P值小于0.05为差异有统计学意义。
AMO-155偶联NHS-MAG3后, 在氯化亚锡的还原作用下可以被 99mTc标记(图1A)。向反应体系中加入新鲜15 μ L 99mTc
将99mTc-AMO-155置于人新鲜血清中不同时间, 经凝胶电泳鉴定其条带稳定性, 结果显示, 在12 h内, 标记探针均显示为唯一的条带, 随着时间延长, 条带亮度未见明显降低, 未见拖尾及扩散现象(图2), 说明经过2'-OMe及PS化学修饰的99mTc-AMO-155探针在新鲜人血清中具有良好的稳定性。
选择miR-155高表达的MCF-7荷瘤裸鼠作为动物显像模型, 通过尾静脉分别注射99mTc标记的AMO-155探针和无义靶向的对照探针, 结果显示, 注射后8 h内, 裸鼠腹部的放射性浓聚最多, 主要位于肝脏位置。随着显像时间延长, 全身的放射性本底逐渐降低, 注射 99mTc-AMO-155的荷瘤裸鼠可以清晰显示出肿瘤影像, 而注射对照探针及非标记AMO-155阻断后的裸鼠则无法显示出肿瘤(图3), 提示AMO-155探针在荷瘤裸鼠体内能够浓聚于miR-155高表达的肿瘤部位, 具有肿瘤靶向显像能力。
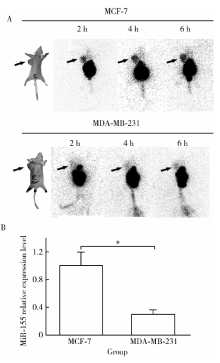
为评价99mTc标记的AMO-155探针在肿瘤部位的摄取情况能否反映miR-155的表达水平, 选择MCF-7和MDA-MB-231这两种荷瘤裸鼠模型分别高表达和低表达miR-155, 结果显示, MCF-7和MDA-MB-231这两种荷瘤裸鼠均可以显示出肿瘤放射性浓聚, 但MCF-7荷瘤裸鼠的肿瘤部位放射性浓聚在各个时间点均显著高于MDA-MB-231荷瘤裸鼠(图4A)。取两种模型的肿瘤进行qRT-PCR实验检测该肿瘤组织的miR-155表达水平, 结果显示, MCF-7荷瘤裸鼠肿瘤的miR-155表达显著高于MDA-MB-231肿瘤(t=3.79, P< 0.01, 图4B), 表明 99mTc-AMO-155在肿瘤部位的摄取水平可以反映miR-155的局部表达水平。
miRNA是一类小分子非编码RNA, 能够在转录后水平参与细胞增殖、分化和凋亡等多种细胞信号通路。研究表明, miR-155可以编码转录调控蛋白、蛋白受体、激酶、细胞核和DNA结合蛋白, 如C/EBPβ 、E2F2、CyclinD、PIK3R1、SOSCl、K-ras及TGF[5]。miR-155在乳腺癌、肺癌、结肠癌、胰腺导管癌、甲状腺癌、淋巴瘤等多种恶性肿瘤具有高表达特征, 特别是在乳腺肿瘤中, 相比癌旁组织显著高表达, 在肿瘤发生、发展、侵袭及转移中发挥重要的作用[9]。因此, 通过对肿瘤组织中高表达的miR-155进行活体显示, 有望在活体水平对恶性肿瘤组织进行显像。
本研究选择miR-155作为靶点, 将放射性核素示踪技术与microRNA的分子生物学特征相结合, 设计具备特定化学结构的核酸分子(AMO-155), 通过化学结构修饰如2'-甲氧基修饰和硫代修饰提高其血清稳定性及生物活性, 使之能够与miR-155发生特异性靶向结合, 并且通过与双功能螯合剂NHS-MAG3偶联可被放射性核素 99mTc所标记, 最终制得放射性核素 99mTc标记的miR-155靶向探针(99mTc-AMO-155), 为新型、无创性的肿瘤分子显像探针, 并分别从放射性标记、血清稳定性、肿瘤细胞摄取、体外抑制活性以及荷瘤动物体内生物分布与活体显像等方面评价 99mTc-AMO-155用于肿瘤显像的潜在应用价值。
目前针对miR-155在体内水平的检测方法均为肿瘤活检组织的离体测定, 如miRNA基因芯片技术、Northern blotting检测、qRT-PCR分析、免疫组织化学方法等[10], 这些检测方法存在以下问题:有创性, 需要穿刺活检, 操作过程较为繁琐, 结果有赖于病理组织的有效选取, 存在一定的假阴性率, 因此, miRNA的组织检测不能满足早期诊断的需要, 不适于广泛的筛查和预防。放射性核素示踪技术的最大优势就是避免了检查的创伤性, 实现了无创、活体、实时的肿瘤分子显像, 不受标本取材的限制, 对生物体进行整体全面的评价, 避免了假阴性结果[8]。
靶向核酸探针能否与靶基因特异性结合, 是靶向显像技术成功与否的关键。反义核酸与靶点的结合根本上取决于有效反义寡核苷酸的稳定性。未修饰的核酸分子在体内或血清环境下容易发生降解进而导致活性丧失, 必须要使用一定的化学修饰方法来保证寡核苷酸的生物稳定性。目前关于核酸分子的化学修饰方式主要包括2'糖基修饰(包括2'-OMe、2'-O-methoxyethyl、2'-flouro)、锁核酸(locked nucleic acid, LNA)和磷酸骨架修饰(phosphorothioate backbone modification)。合适的化学修饰不但能够提高核酸探针与靶向RNA的杂交亲和力, 提高其抵抗核酸酶降解的能力, 而且还可以减缓核酸探针的血浆清除速度并提高进入组织的能力。LNA修饰或肽核酸修饰的核酸探针通过抑制miR-155, 用于治疗实体和血液系统恶性肿瘤, 均取得了良好效果。
本研究通过构建MCF-7和MDA-MB-231动物模型并在荷瘤裸鼠体内对比miR-155高表达组和对照组标记的生物分布和肿瘤显像情况, 进一步证实了miRNA探针能够在体内发挥特异性靶向结合的能力。但是, 到目前为止, 设计实现肿瘤特异性的miRNA肿瘤靶向探针仍然极具挑战, 因为当99mTc标记的小分子核酸探针在体内应用时, 其活体分布是决定可否发挥活体作用性的重要问题。本研究采用99mTc标记的AMO探针进行活体显像, 虽然在活体水平可以显示miR-155过表达的肿瘤影像, 但是荷瘤裸鼠腹部的放射性浓聚非常明显。miR-155靶向的寡核苷酸AMO属于单链小分子DNA, 在前期研究中, 本课题组分别对反义核酸[8]、端粒酶靶向siRNA探针[11]进行了99mTc标记, 同样发现这类小分子探针在肾和肝中的浓聚过高。分析其原因, 一方面, 小分子核酸分子属于水溶性, 通过泌尿系统排泄, 另一方面, 本研究所采用的探针进行了全程硫代修饰, 这种修饰方法增加了探针的脂溶性, 使得其在肝脏摄取增多[12]。因此, 采用合适的载体来提高小分子核酸的体内有效分布对于提高肿瘤显像的敏感性、特异性意义重大。纳米载体可以将分子核酸进行包裹后提高其体内靶向分布[13], 这种载体是否可以提高本研究的核酸分布效果值得进一步研究。
综上所述, 99mTc标记的AMO探针能够在活体水平显示肿瘤部位的miR-155表达水平, 通过显示肿瘤高表达的miR-155, 有望探索其在恶性肿瘤的肿瘤靶向显像中具有的潜在应用价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|